Cho khí Clo tác dụng vừa đủ với dung dịch NaBr và NaI, thu được 2,34 gam NaCl. Số mol hỗn hợp NaBr và NaI đã tác dụng với clo là
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2NaI → 2NaCl + I2
=> nNaBr + nNaI = nNaCl thu được = 0,04 mol
Hòa tan 2,67 gam hỗn hợp NaI và NaCl vào nước được dung dịch X. Cho Br2 vừa đủ vào X thu được muối Y có khối lượng nhỏ hơn khối lượng muối ban đầu là 0,47 gam. Khối lượng NaCl trong hỗn hợp đầu là
Br2 + 2NaI → 2NaBr + I2
Muối Y thu được gồm NaCl ban đầu và NaBr
Gọi nBr2 phản ứng = x mol => nNaI phản ứng = nNaBr = 2.nBr2 = 2x mol
=> mgiảm = mNaI – mNaBr = 2x.150 – 2x.103 = 0,47 => x = 0,005 mol
=> mNaCl = 2,67 – mNaI = 2,67 – 2.0,005.150 = 1,17 gam
Hòa tan hoàn toàn 4,82 gam hỗn hợp gồm 3 muối NaF, NaCl, NaBr vào nước được dung dịch A. Sục khí Cl2 dư vào dung dịch A rồi cô cạn hoàn toàn dung dịch sau phản ứng thu được 3,93 gam muối khan. Mặt khác, lấy ½ lượng muối khan này vào nước rồi cho phản ứng với dung dịch AgNO3 dư, thu được 4,305 gam kết tủa. Phần trăm về khối lượng của NaF trong hỗn hợp là
Gọi nNaF = x mol; nNaCl = y mol; nNaBr = z mol
=> mhỗn hợp = 42x + 58,5y + 103z = 4,82 (1)
Sục khí Cl2 dư vào A thu được 2 muối NaF (x mol) và NaCl (y + z) mol
=> mmuối khan = 42x + 58,5.(y + z) = 3,93 gam (2)
Lấy ½ lượng muối khan tác dụng với dung dịch AgNO3 => thu được kết tủa là AgCl
=> nAgCl = 0,5.(y + z) = 0,03 (3)
Từ (1), (2) và (3) => x = 0,01 mol; y = 0,04 mol; z = 0,02 mol
=> %mNaF = 42.0,014,82.100%=8,71%
Hỗn hợp A gồm 3 muối MgCl2, NaBr, KI. Cho 93,4g hỗn hợp A tác dụng với 700ml dung dịch AgNO3 2M. Sau khi phản ứng kết thúc thu được dung dịch D và kết tủa B. Cho 22,4 gam bột Fe vào dung dịch D, sau khi phản ứng xong thu được chất rắn F và dung dịch E. Cho F vào dung dịch HCl dư tạo ra 4,48 lít H2 (đktc). Cho dung dịch NaOH dư vào dung dịch E thu được kết tủa, nung kết tủa trong không khí cho đến khối lượng không đổi thu được 24 gam chất rắn. Khối lượng kết tủa B là
Gọi a, b, c lần lượt là số mol MgCl2, NaBr, KI
=> mA = 95a + 103b + 166c = 93,4 (1)
93,4gam{MgCl2NaBrKI1,4molAgNO3→{ddD:Mg(NO3)2, NaNO3, KNO3, và AgNO3↓B:AgCl,AgBr,AgI
Vì rắn F tác dụng với dung dịch HCl dư sinh ra khí H2 => trong F chứa Fe dư và Ag
nFe dư = nH2 = 0,2 mol => nFe phản ứng = 0,4 – 0,2 = 0,2 mol
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
0,2 → 0,4
=> nAgNO3 dư trong D = 0,4 mol
Bảo toàn nguyên tố Ag và halogen: nAgNO3 ban đầu = nAgCl + nAgBr + nAgI + nAgNO3 dư = 2.nMgCl2 + nNaBr + nKI + nAgNO3 dư
=> 2a + b + c + 0,4 = 1,4 (2)
Dung dịch E: Fe(NO3)2, Mg(NO3)2, NaNO3, KNO3 chỉ có Fe(NO3)2, Mg(NO3)2 tham gia phản ứng với dung dịch NaOH dư => 24 gam rắn sau khi nung là: Fe2O3 và MgO
mrắn = mFe2O3 + mMgO = 160.0,1 + 40a = 24 => a = 0,2 (3)
Từ (1), (2) và (3) => a = 0,2; b= 0,4; c = 0,2
=> mB = 143,5.0,4 + 188.0,4 + 235.0,2 = 179,6 gam
Cho một lượng dư dung dịch AgNO3 tác dụng với 100 ml dung dịch chứa hỗn hợp NaF 0,4M; NaBr 0,5M và NaCl 0,2M . Khối lượng kết tủa thu được là:
100 ml = 0,1 (lít)
nNaF = 0,1.0,4 =0,4 (mol); nNaBr = 0,1.0,5 = 0,05 (mol); nNaCl = 0,1.0,2 = 0,02 (mol).
Cho dd AgNO3 vào hỗn hợp trên chỉ phản ứng với dd NaBr và NaCl, không phản ứng với dd NaF.
PTHH: AgNO3 + NaBr → AgBr↓ + NaNO3 (1)
AgNO3 + NaCl → AgCl↓ + NaNO3 (2)
Theo PTHH (1): nAgBr = nNaBr = 0,05 (mol) → mAgBr = nAgBr×MAgBr = 0,05×(108 +80)= 9,4 (g)
Theo PTHH (2): nAgCl = nNaCl = 0,02 (mol) → mAgCl = nAgCl×MAgCl = 0,02×(108 +35,5)= 2,87 (g)
Khối lượng kết tủa thu được là: mkết tủa = mAgBr + mAgCl = 9,4 + 2,87 =12,27 (g)
Hòa tan hoàn toàn hỗn hợp 4,82 gam gồm 3 muối NaF, NaCl, NaBr trong nước được dung dịch A. Sục khí clo dư vào dung dịch A rồi cô cạn hoàn toàn dung dịch sau phản ứng thu được 3,93 gam muối khan. Lấy 1/2 lượng muối khan này hoà tan vào nước rồi cho sản phẩm phản ứng với dung dịch AgNO3 dư thì thu được 4,305 gam kết tủa. Phần trăm khối lượng của NaF trong hỗn hợp ban đầu có giá trị gần nhất với giá trị nào sau đây?
Giả sử trong 4,82 gam hỗn hợp có x mol NaF, y mol NaCl và z mol NaBr
⟹ mhỗn hợp = 42x + 58,5y + 103z = 4,82 (1)
Sục khí Cl2 dư vào A:
Cl2 + 2NaBr → 2NaCl + Br2
z → z (mol)
Sục khí Cl2 dư vào A thu được 2 muối NaF (x mol) và NaCl (y + z mol)
⟹ mmuối khan = 42x + 58,5.(y + z) = 3,93 gam (2)
Lấy ½ lượng muối khan {0,5x mol NaF và (0,5y+0,5z) mol NaCl} tác dụng với dung dịch AgNO3 xảy ra phản ứng:
AgNO3 + NaCl → AgCl↓ + NaNO3
0,5y+0,5z → 0,5y+0,5z (mol)
Kết tủa thu được là AgCl ⟹ nAgCl = 0,5.y + 0,5z = 4,305/143,5 = 0,03 (3)
Từ (1), (2) và (3) ⟹ x = 0,01 mol; y = 0,04 mol; z = 0,02 mol
Phần trăm khối lượng của NaF trong hỗn hợp ban đầu là:
%mNaF = 0,01.424,82.100% = 8,71% gần nhất với giá trị 8,7%.
Nguyên tố R là phi kim thuộc phân nhóm chính trong bảng tuần hoàn. Tỉ lệ giữa phần trăm nguyên tố R trong oxit cao nhất và phần trăm R trong hợp chất khí với hiđro bằng 0,5955. Cho 4,05 gam một kim loại M chưa rõ hóa trị tác dụng hết với đơn chất R thì thu được 40,05 gam muối. Xác định công thức của muối M.
Đặt công thức oxi cao nhất của R với oxi là R2Ox (với x - số thứ tự nhóm của R trong BTH)
→ Hóa trị của R với hidro là: 8 - x
→ Công thức của X với hợp chất hidro là RH8-x
Phần trăm của R trong R2Ox là: %R=2MR2MR+16x.100%
Phần trăm của R trong RH8-x là: %R=MRMR+(8−x).100%
Theo bài ta suy ra
⇒2MR2MR+16x.100%MRMR+(8−x).100%=0,5955⇒2[MR+(8−x)]2MR+16x=0,5955⇒2MR+16−2x=1,191.MR+9,528x⇒0,809MR=11,528x−16
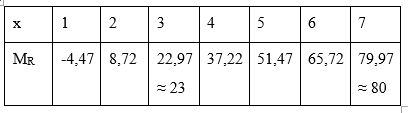
Vậy với x = 7 thì MR = 80 thỏa mãn → R là Brom
Đặt hóa trị của kim loại M là n
PTHH: 2M + nBr2 t0⟶2MBrn
Theo PT có: nM = nMBrn
⇒4,05M=40,05M+80n⇒4,05M+324n=40,05M⇒36M=324n⇒M=9n
Hóa trị của kim loại thường là 1,2, 3. Chạy n = 3 thì M = 27 thỏa mãn → M là Nhôm (Al)
Vậy công thức muối là AlBr3.
Cho V lít khí Cl2 (đktc) vào dung dịch chứa 30gam NaI và 30,9 gam NaBr. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cô cạn dung dịch Y thu được 33,7 gam muối khan Z. Giá trị của V và phần trăm khối lượng các muối trong Z là:
Tính khử của I- mạnh hơn Br- nên phản ứng theo thứ tự
Cl2 + 2NaI → 2NaCl + I2 (1)
(mol) 0,1← 0,2 mol → 0,2 mol
khối lượng giảm là: m1 = mNaI – mNaCl = 0,2.150 – 0,2.58,5 = 18,3 (g)
Cl2 + 2NaBr → 2NaCl + Br2 (2)
(mol) 0,3 mol → 0,3 mol
khối lượng giảm là: m’ = mNaBr – mNaCl = 0,3.103 – 0,3.58,5 = 13,35 (g)
Mốc 1: Xảy ra vừa đủ phản ứng (1) thì khối lượng rắn giảm m1 = 18,3 (g)
Mốc 2: Xảy ra phản ứng (1) và (2) vừa đủ thì khối lượng rắn giảm là: m2 = m1 + m’ = 18,3 + 13,35 = 31,65 (g)
Theo bài: mrắn giảm = mNaI + mNaBr – mZ = 30 + 30,9 – 33,7 = 27,2 (g)
Ta thấy: m1 = 18,3 g < m rắn giảm = 27,2 g < m2 = 31,65 g
=> xảy ra phản ứng (1) và (2). Cl2; NaI pư hết, NaBr dư
Ta có: mrắn giảm (2) = 27,2 – 18,3 = 8,9 (g)
Cl2 + 2NaBr → 2NaCl + Br2 (3)
Cứ (mol) 1 mol → 1 mol khối lượng giảm là 44,5g
Vậy (mol) 0,1← 0,2 mol ← 0,2 mol ← khối lượng giảm là 8,9 g
Vậy ∑ nCl2 pư = nCl2 (1) + nCl2 (3) = 0,1 + 0,1 = 0,2 (mol) → VCl2(đktc) = 0,2.22,4 = 4,48 (lít)
Hh muối Z gồm: NaCl: 0,4 (mol) và NaBr dư: 0,3 – 0,2 = 0,1 (mol)
{%mNaCl=mNaClmZ.100%=0,4.58,533,7.100%=69,44%%mNaBr=100%−%mNaCl=30,56%

