Để nhận biết các dung dịch NaF, KCl, MgCl2 ta dùng
Đáp án B
Thêm 78 ml dung dịch AgNO3 10% (D=1,09 g/ml) vào dung dịch có chứa 3,88 g hỗn hợp KBr và NaI. Lọc bỏ kết tủa. Nước lọc phản ứng vừa đủ với 13,3 ml dung dịch HCl 1,5 M. Phần trăm khối lượng KBr trong hỗn hợp muối ban đầu là
\({m_{{\rm{dd AgN}}{{\rm{O}}_3}}} = D.V = 1,09.78 = 85,02g\)
\(C\% = \frac{{{m_{AgN{O_3}}}}}{{{m_{{\rm{dd}}AgN{O_3}}}}}.100\% \Leftrightarrow 10\% = \frac{{{m_{AgN{O_3}}}}}{{85,02}}.100\% \Leftrightarrow {m_{AgN{O_3}}} = 8,502g \Leftrightarrow {n_{AgN{O_3}}} = 0,05mol\)(lượng ban đầu)
\(\begin{array}{l}\begin{array}{*{20}{c}}{KBr}\\x\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{AgN{O_3}}\\x\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{KN{O_3}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{AgBr}\\{}\end{array}\\\begin{array}{*{20}{c}}{NaI}\\y\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{AgN{O_3}}\\y\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{AgI}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{NaN{O_3}}\\{}\end{array}\end{array}\)
Phần nước lọc phản ứng tác dụng với dung dịch HCl ⇒ AgNO3 còn dư
\({C_{M(HCl)}} = \dfrac{{{n_{HCl}}}}{{{V_{{\rm{dd}}HCl}}}} \Leftrightarrow 1,5 = \frac{{{n_{HCl}}}}{{13,{{3.10}^{ - 3}}}} \Leftrightarrow {n_{HCl}} \simeq 0,02mol\)
\(\begin{array}{*{20}{c}}{AgN{O_3}}\\{0,02}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{HCl}\\{0,02}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{AgCl}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{HN{O_3}}\\{}\end{array}\)
Ta có hệ phương trình:
\(\left\{ {\begin{array}{*{20}{c}}{119x + 150y = 3,88}\\{x + y + 0,02 = 0,05}\end{array} \Leftrightarrow \left\{ {\begin{array}{*{20}{c}}{x = 0,02}\\{y = 0,01}\end{array}} \right.} \right.\)
Phần trăm khối lượng của KBr=\(\dfrac{{0,02.119}}{{3,88}}.100\% \simeq 61,34\% \)
Cho các dung dịch sau: NaCl, KI, Mg(NO3)2, AgNO3. Chỉ dùng thuốc thử duy nhất là dung dịch HCl thì nhận biết được bao nhiêu dung dịch trên?

\(AgN{O_3} + NaCl \to AgCl \downarrow + NaN{O_3}\)
\(AgN{O_3} + KI \to AgI \downarrow + KN{O_3}\)
Cho các phản ứng sau:
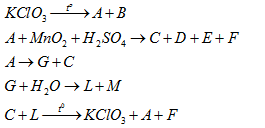
Cho các phát biểu sau:
(1) B là khí không màu, nặng hơn không khí, ít tan trong nước và duy trì sự cháy.
(2) Cả 5 phản ứng trên đều thuộc phản ứng oxi hóa – khử.
(3) 1 mol G tác dụng với nước tạo 0,5 mol khí H2.
(4) L làm quỳ ẩm chuyển màu xanh.
Số phát biểu đúng là
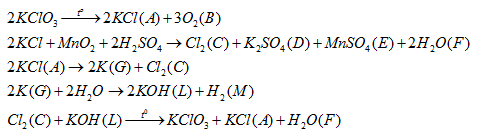
Cả 4 phát biểu đều đúng
Có 6 ống nghiệm đánh số đựng các dung dịch (không theo thứ tự) NaNO3, CuCl2, Na2SO4, K2CO3, Ba(NO3)2, CaCl2. Biết rằng: khi trộn các dung dịch (1) với (3); (1) với (6); (2) với (3); (2) với (6); (4) với (6) thì có kết tủa. Ngoài ra, cho dung dịch AgNO3 tác dụng với (2) cũng có kết tủa. Từ (1) đến (6) tương ứng với các chất là
(2) tác dụng với dung dịch AgNO3 tạo kết tủa nên (2) có thể là CuCl2, CaCl2
- Nếu (2) là CuCl2 thì chỉ tạo được một kết tủa với K2CO3
- Nếu (2) là CaCl2 thì tạo được hai kết tủa với K2CO3 và Na2SO4
Theo đề bài (2) tạo với (3) và (2) với (6) tạo 2 kết tủa ⇒ (2) là CaCl2; (3) và (6) có thể là K2CO3 và Na2SO4
Với (3) là Na2SO4: Ba(NO3)2 với Na2SO4 là một cặp vì tạo được kết tủa BaSO4 ⇒ (1) là Ba(NO3)2
Với (6) là K2CO3: K2CO3 ngoài tạo kết tủa với Ba(NO3)2 và CaCl2 còn tạo kết tủa với CuCl2 ⇒ (4) là CuCl2, (5) là NaNO3.
Các phương trình hóa học:
(1) + (3): \(Ba{(N{O_3})_2} + N{a_2}S{O_4} \to BaS{O_4} \downarrow + 2NaN{O_3}\)
(1) + (6): \(Ba{(N{O_3})_2} + {K_2}C{O_3} \to BaC{O_3} \downarrow + 2KN{O_3}\)
(2) + (3): \(CaC{l_2} + N{a_2}S{O_4} \to CaS{O_4} \downarrow + 2NaCl\)
(2) + (6): \(CaC{l_2} + {K_2}C{O_3} \to CaC{O_3} \downarrow + 2KCl\)
(4) + (6): \(CuC{l_2} + {K_2}C{O_3} \to CuC{O_3} \downarrow + 2KCl\)
(2) + (AgNO3): \(CaC{l_2} + 2AgN{O_3} \to 2AgCl \downarrow + Ca{(N{O_3})_2}\)
Cho 14,25 gam hỗn hợp NaX, NaY (X, Y là hai halogen ở hai chu kì liên tiếp) vào dung dịch AgNO3 có dư thu được 14,35 gam kết tủa. X và Y là
TH1: Gỉa sử X là F, Y là Cl
\( \Rightarrow {n_ \downarrow } = {n_{AgCl}} = \dfrac{{14,35}}{{143,5}} = 0,1mol\)
\(\begin{array}{*{20}{c}}{NaCl}\\{0,1}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{AgN{O_3}}\\{}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{NaN{O_3}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{AgCl}\\{0,1}\end{array}\)
\( \Rightarrow {n_{NaCl}} = 0,1.58,5 = 5,85g\)
TH2: Gọi hai nguyên tố X, Y là \(\mathop R\limits^ - \)
\(\begin{array}{*{20}{c}}{Na\mathop R\limits^\_ }\\{\dfrac{{14,25}}{{23 + \mathop R\limits^\_ }}}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{AgN{O_3}}\\{}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{NaN{O_3}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{Ag\mathop R\limits^\_ \downarrow }\\{\frac{{14,35}}{{108 + \mathop R\limits^\_ }}}\end{array}\)
\( \Rightarrow \dfrac{{14,25}}{{23 + \mathop R\limits^\_ }} = \dfrac{{14,35}}{{108 + \mathop R\limits^\_ }} \Rightarrow \mathop R\limits^\_ = 12089,5\) (Không có giá trị PTK của halogen nào thỏa mãn) (Loại)
X là F, Y là Cl

