Trong muối NaCl có lẫn NaBr và NaI. Để loại 2 muối này ra khỏi NaCl, người ta có thể
Để loại 2 muối này ra khỏi NaCl, người ta cho dung dịch hỗn hợp tác dụng với khí Cl2 dư, sau đó cô cạn dung dịch.
2NaBr + Cl2 → 2NaCl + Br2
2NaI + Cl2 → 2NaCl + I2
Cho phản ứng: KX rắn + H2SO4 đặc, nóng → K2SO4 + HX khí. KX có thể là
KX có thể là KF và KCl
không thể là KBr và KI vì khí HBr và HI sinh ra phản ứng được với H2SO4 đặc nóng
Có các dung dịch sau: NaClO, NaCl, NaOH, NaF, Na2CO3, NaI. Có bao nhiêu dung dịch có pH > 7?
Các dung dịch có pH > 7 là: NaClO, NaOH, NaF, Na2CO3 (các muối của axit yếu)
Phản ứng không đúng là
Phản ứng không đúng là : HF + NaCl → NaF + HCl
Vì HF là axit yếu, không phản ứng để sinh ra axit mạnh được.
Thuốc thử đặc trưng để nhận biết hợp chất halogenua trong dung dịch là
Thuốc thử đặc trưng để nhận biết hợp chất halogenua trong dung dịch là AgNO3.
Vì AgNO3 tạo kết tủa với các halogen (trừ F)
Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa;
(b) Axit flohiđric là axit yếu;
(c) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng;
(d) Trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa -1, +1, +3, +5, +7;
(e) Tính khử của các ion halogenua tăng dần theo thứ tự: F-, Cl-, Br-, I-.
Trong các phát biểu trên, số phát biểu đúng là
Các phát biểu đúng là
(a) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa;
(b) Axit flohiđric là axit yếu
(c) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng;
(e) Tính khử của các ion halogenua tăng dần theo thứ tự: F-, Cl-, Br-, I-.
Cho các chất: CaCO3; KOH; KI; KMnO4; Si; Na ; FeSO4; MnO2; Mg; Cl2. Trong các chất trên có bao nhiêu chất có khả năng phản ứng được với dung dịch HBr mà trong đó HBr đóng vai trò là chất khử?
Các phản ứng trao đổi
CaCO3 + 2HBr → CaBr2 + CO2↑ + H2O
KOH + KBr → KBr + H2O
Các phản ứng HBr đóng vai trò là chất oxi hóa
2Na + 2HBr → 2NaBr + H2↑
Các phản ứng HBr đóng vai trò là chất khử
\(\eqalign{
& 2K\mathop {Mn}\limits^{ + 7} {O_4} + 16H\mathop {Br}\limits^{ - 1} \buildrel {} \over
\longrightarrow 2KBr + \mathop {2Mn}\limits^{ + 2} B{r_2} + \mathop {5B{r_2}}\limits^0 + 8{H_2}O \cr
& \mathop {Mn}\limits^{ + 4} {O_2} + 4H\mathop {Br}\limits^{ - 1} \buildrel {} \over
\longrightarrow \mathop {Mn}\limits^{ + 2} B{r_2} + \mathop {B{r_2}}\limits^0 + 2{H_2}O \cr
& \mathop {C{l_2}}\limits^0 + 2H\mathop {Br}\limits^{ - 1} \buildrel {} \over
\longrightarrow 2H\mathop {Cl}\limits^{ - 1} + \mathop {B{r_2}}\limits^0 \cr} \)
=> có 3 chất phản ứng với HBr mà HBr đóng vai trò là chất khử.
Muốn khắc thủy tinh, người ta nhúng thủy tinh vào sáp nóng chảy và nhấc ra cho nguội, dùng vật nhọn tạo hình chữ, biểu tượng,… cần khắc. Sau đó, người ta sẽ chờ lớp sáp (nến) khô rồi nhỏ dung dịch HF vào thủy tinh và thu được sản phẩm được khắc theo mong muốn. Phương trình hóa học của phản ứng xảy ra khi khắc thủy tinh bằng dung dịch HF là
PTHH: 4HF + SiO2 ⟶ SiF4 + 2H2O.
Điều nào sau đây đúng khi nói về cấu tạo của phân tử hydrogen halide HX với X là các halogen?
A sai vì liên kết H với X là liên kết cộng hoá trị
C sai. Để đạt được trạng thái bền của khí hiếm gần nhất, các nguyên tố halogen nhận thêm 1 electron
D sai. Liên kết HX thuộc loại liên kết cộng hóa trị phân cực
Cho các tính chất vật lí sau:
(1) Ở điều kiện thường tồn tại dạng thể khí.
(2) Không tan trong nước lạnh, tan tốt trong nước nóng.
(3) Nhiệt độ sôi tăng dần.
(4) Độ dài liên kết tăng dần.
(5) Năng lượng liên kết tăng dần.
Số phát biều đúng khi nói về tính chất vật lí của các hydrogen halide từ HF đến HI là
Đáp án A
Tại sao HF lỏng có nhiệt độ sôi cao bất thường?
HF lỏng có nhiệt độ sôi cao bất thường vì HF phân cực mạnh, có khả năng tạo liên kết hydrogen
Cho giá trị nhiệt độ sôi của các hydrogen halide không theo thứ tự: +19,5oC, -35,8oC, -84,9oC và -66,7oC. Đâu là sự sắp xếp giá trị nhiệt độ sôi tương ứng đúng với các hydrogen halide?
Nhiệt độ sôi của hydrogen halide giảm từ HF đến HCl và tăng từ HCl đến HI
=> HF: +19,5oC; HCl: -84,9oC; HBr: -66,7oC; HI: -35,8oC.
Cho bảng thông tin về các hydrogen halide như sau:
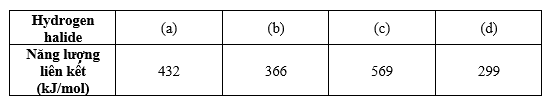
Chất (b) và (d) lần lượt là
Năng lượng liên kết của Hydrogen halide giảm dần từ HF đến HI
=> (c) là HF, (a) là HCl, (b) là HBr và (d) là HI
Đâu là phương trình hóa học sai?
PTHH đúng: \(Fe + 2HCl \to FeC{l_2} + {H_2}\)
Phương trình hóa học thể hiện tính khử của HCl là
HCl thể hiện tính khử khi tác dụng với chất oxi hoá có nguyên tố có số oxi hoá thay đổi từ cao xuống thấp
KMnO4 là chất oxi hoá mạnh do Mn có số oxi hoá +7 trong KMnO4 xuống +2 trong MnCl2
Cho các phát biểu sau:
(1) Từ HF đến HI, tính acid tăng dần.
(2) Acid HCl thường được dùng để đánh sạch lớp oxide, hydroxide, muối carbonate bám trên bề mặt kim loại trước khi sơn, hàn, mạ điện dựa trên tính acid của HCl.
(3) Trong công nghiệp, hỗn hợp gồm KF và HF (có tỉ lệ mol tương ứng 3:1) được dùng để điện phân nóng chảy sản xuất fluorine.
(4) Acid HF phân li hoàn toàn trong nước, còn các acid HCl, HBr, HI phân li một phần trong nước.
Số phát biểu sai là
(3) sai. Trong công nghiệp, hỗn hợp gồm KF và HF (có tỉ lệ mol tương ứng 1:3) được dùng để điện phân nóng chảy sản xuất fluorine.
(4) sai. Từ HF đến HI, tính acid tăng dần nên HF phân li một phần, còn HCl, HBr, HI phân li hoàn toàn trong nước
Thứ tự sắp xếp tính khử theo chiều tăng dần là
Thứ tự sắp xếp tính khử theo chiều tăng dần là Cl-, Br-, I-
Cho các phản ứng sau:
\(KCl + {H_2}S{O_4} \to KHS{O_4} + HCl \uparrow \) (1)
$CaC{l_2}\xrightarrow{{dpnc}}Ca + C{l_2} \uparrow $ (2)
\(2HI + N{a_2}O \to 2NaI + {H_2}O\) (3)
\(2HBr + {H_2}S{O_4} \to B{r_2} + S{O_2} + 2{H_2}O\) (4)
\(6KI + 4{H_2}S{O_4} \to 3{I_2} + S + 3{K_2}S{O_4} + 4{H_2}O\) (5)
Số phương trình thể hiện tính khử của các ion halogen là
Đáp án C
Cho phản ứng: \(aNaI + b{H_2}S{O_4} \to cNaHS{O_4} + d{I_2} + e{H_2}S + f{H_2}O\). Tổng hệ số cân bằng là
Đáp án A
Phản ứng nào sau đây viết sai?
Đáp án A

