Hòa tan hoàn toàn 11,9 gam hỗn hợp gồm Al và Zn bằng H2SO4 đặc nóng thu được 7,616 lít SO2 (đktc), 0,64 gam S và dung dịch X. Khối lượng muối trong dung dịch X là:
${{n}_{S{{O}_{2}}}}=0,34\,\,mol;\,\,{{n}_{S}}=0,02\,\,mol$
Nhận e: $\overset{+6}{\mathop{S}}\,$ + 2e → $\overset{+4}{\mathop{S}}\,$ (SO2) $\overset{+6}{\mathop{S}}\,$ + 6e → $\overset{0}{\mathop{S}}\,$
0,68 ← 0,34 0,12 ← 0,02
Bảo toàn e: ne cho = ne nhận = 2.nSO2 + 6.nS = 0,68 + 0,12 = 0,8 mol
=> ${{m}_{SO_{4}^{2-}}}$ trong muối kim loại = $\frac{{{n}_{e\text{ }cho}}}{2}$ = 0,4 mol
=> mmuối = mKL + mgốc SO4 = 11,9 + 0,4.96 = 50,3 gam
Cho 1,86 gam hỗn hợp Mg và Al vào dung dịch HNO3 loãng dư sau phản ứng thu được 560 ml N2O ( đktc) là sản phẩm khử duy nhất . Phần trăm khối lượng của Mg trong hỗn hợp ban đầu là
Gọi số mol Mg và Al lần lượt là x và y mol => mhỗn hợp = 24x + 27y = 1,86 (1)
Theo đề bài ta thấy khi tham gia phản ứng Mg nhường 2e, Al nhường 3e và NO3- (+5e) thu 8e tạo N2O
Áp dụng định luật bảo toàn e :2.nMg + 3.nAl = 8.nN2O => 2x + 3y = 8.0,025 = 0,2 (2)
Giải hệ phương trình ta có x = 0,01 và y = 0,06 mol
=> mMg = 0,24 gam => % mMg = $\frac{0,01.24}{1,86}.100%$ = 12,90 %
Một hỗn hợp gồm hai bột kim loại Mg và Al được chia thành hai phần bằng nhau:
- Phần 1: cho tác dụng với HCl dư thu được 3,36 lít H2.
- Phần 2: hoà tan hết trong HNO3 loãng dư thu được V lít một khí không màu, hoá nâu trong không khí .
Biết các thể tích khí đều đo ở đktc, giá trị của V là
Phần 1: ${{n}_{{{H}_{2}}}}=0,15\,\,mol$
Bảo toàn e: ne cho = ne nhận = $2.{{n}_{{{H}_{2}}}}=0,3\,\,mol$
Vì số mol của Mg và Al ở 2 phần bằng nhau và Mg, Al phản ứng với HCl hay với HNO3 đều có số oxi hóa như nhau
=> ne cho (phần 2) = ne cho (phần 1) = 0,3 mol
Phần 2: khí không màu, hóa nâu trong không khí là NO
Bảo toàn e: ne cho (phần 2) = 3.nNO => nNO = 0,3 / 3 = 0,1 mol
=> VNO = 0,1.22,4 = 2,24 lít
Cho 29,6 gam hỗn hợp X gồm Fe, Mg, Cu theo tỉ lệ mol 1 : 2 : 3 bằng H2SO4 đặc nguội được dung dịch Y và 11,2 lít SO2 (đktc). Cô cạn dung dịch Y được khối lượng muối khan là
Gọi x là số mol Fe trong hỗn hợp X => nMg = 2x, nCu = 3x
=> 56x + 24.2x + 64.3x = 29,6 => x = 0,1 mol
=> nFe = 0,1 mol, nMg = 0,2 mol, nCu = 0,3 mol
Do axit H2SO4 đặc nguội, nên sắt không phản ứng.
SO42- + 2e → S+4
1 → $\frac{11.2}{22,4}$
=> mmuối = mCu + mMg + ${{m}_{SO_{4}^{2-}}}$ = mCu + mMg + 96.$\frac{1}{2}\sum{{}}$etrao đổi
= 64.0,3 + 24.0,2 + 96.$\frac{1}{2}$1 = 72 gam
Hòa tan hoàn toàn 12 gam hỗn hợp Fe, Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (ở đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là
Đặt nFe = nCu = a mol => 56a + 64a = 12 => a = 0,1 mol
Quá trình oxi hóa kim loại:
Fe → Fe3+ + 3e Cu → Cu2+ + 2e
0,1 → 0,3 0,1 → 0,2
Quá trình khử N+5:
N+5 + 3e → N+2 N+5 + 1e → N+4
3x ← x y ← y
Áp dụng định luật bảo toàn electron => 3x + y = 0,5
Mặt khác: Do tỉ khối của hỗn hợp X với H2 là 19
=> 30x + 46y = 19.2.(x + y)
=> x = 0,125 ; y = 0,125.
Vhh khí (đktc) = 0,125.2.22,4 = 5,6 lít
Cho 3 kim loại Al, Fe, Cu vào 2 lít dung dịch HNO3 phản ứng vừa đủ thu được 1,792 lít khí X (đktc) gồm N2 và NO2 có tỉ khối hơi so với He bằng 9,25. Nồng độ mol/lít HNO3 trong dung dịch ban đầu là:
Ta có: ${{\bar{M}}_{X}}=9,25.4=37=\frac{\left( {{M}_{{{N}_{2}}}}+{{M}_{N{{O}_{2}}}} \right)}{2}=>{{n}_{{{N}_{2}}}}={{n}_{N{{O}_{2}}}}=\frac{{{n}_{X}}}{2}=0,04\,\,mol$
Bảo toàn e: ne nhận = $10.{{n}_{{{N}_{2}}}}+1.{{n}_{N{{O}_{2}}}}$= 0,44 mol
=> ${{n}_{NO_{3}^{-}}}$= ne nhận = 0,44 mol
Bảo toàn nguyên tố N: ${{n}_{HN{{O}_{3}}}}={{n}_{NO_{3}^{-}}}$trong muối + nN (spk) = 0,44 + 2.0,04 + 0,04 = 0,56 mol
=> $\left[ HN{{O}_{3}} \right]=\frac{0,56}{2}=0,28M$
Thể tích dung dịch HNO3 1M loãng ít nhất cần dùng để hoà tan hoàn toàn 18 gam hỗn hợp gồm Fe và Cu trộn theo tỉ lệ mol 1 : 1 là (biết phản ứng tạo chất khử duy nhất là NO):
Gọi nFe = nCu = a mol => 56a + 64a = 18 => a = 0,15 mol
Do thể tích dung dịch HNO3 cần dùng ít nhất, nên sắt sẽ bị hòa tan hết bởi HNO3 vừa đủ tạo muối Fe3+, Cu tác dụng vừa đủ với Fe3+ tạo muối Cu2+ và Fe2+ => sau phản ứng chỉ thu được hai muối Cu(NO3)2 và Fe(NO3)2
$Fe~\,\,\to ~~~\overset{+2}{\mathop{Fe}}\,\,\,\text{+ }2e~~~$
0,15 → 0,3
$Cu~~\to \,\,\overset{+2}{\mathop{Cu}}\,\,\,+\,\,2e$
0,15 → 0,3
=> ∑ne cho = 2.(0,15 + 0,15) = 0,6 mol
=> ne nhận = 3.nNO = 0,6 => nNO = 0,2 mol
Ta có:${{n}_{NO_{3}^{-}}}$ = ne cho = 0,6 mol
Bảo toàn nguyên tố N: ${{n}_{HN{{O}_{3}}}}={{n}_{NO_{3}^{-}}}+{{n}_{NO}}=0,6+0,2=0,8\,\,mol$
=> [HNO3] = $\frac{0,8}{1}$= 0,8 lít
Hoà tan 6,21 gam kim loại R trong dung dịch HNO3 loãng thu được 1,68 lít hỗn hợp khí X (đktc) gồm 2 khí N2 và N2O. Tỉ khối hơi của X so với H2 là 17,2. Kim loại R là
nX = 1,68 : 22,4 = 0,075 mol; MX = 17,2.2 = 34,4
Đặt nN2 = x mol và nN2O = y mol
Ta có hệ phương trình: \(\left\{ \begin{array}{l}{n_{khi}} = x + y = 0,075\\{m_{khi}} = 28{\rm{x}} + 44y = 0,075.34,4\end{array} \right. \to \left\{ \begin{array}{l}x = 0,045\\y = 0,03\end{array} \right.\)
R0 → R+n + n e 2N+5 + 10e → 2N0 (N2)
0,69/n ← 0,69 0,45 ← 0,045
2N+5 + 8e → 2N+1 (N2O)
0,24 ← 0,03
Ta có: \({m_R} = \dfrac{{0,69}}{n}.R = 6,21 \Leftrightarrow R = 9n\)
Dễ thấy nghiệm thỏa mãn là n = 3, R = 27 (Al).
Hòa tan hoàn toàn 14,8 gam hỗn hợp X gồm Fe và Cu vào lượng dư dung dịch hỗn hợp HNO3 và H2SO4 đặc nóng. Sau phản ứng thu được 0,45 mol khí NO2 và 0,1 mol khí SO2. Khối lượng Fe trong hỗn hợp X là
Đặt nFe = x và nCu = y (mol)
Fe0 → Fe+3 + 3e N+5 + 1e → N+4 (NO2)
x → 3x 0,45 ← 0,45
Cu0 → Cu+2 + 2e S+6 + 2e → S+4 (SO2)
y → 2y 0,2 ← 0,1
Từ khối lượng hỗn hợp và định luật bảo toàn e ta có hệ phương trình:
\(\left\{ \begin{array}{l}56{\rm{x}} + 64y = 14,8\\3x + 2y = 0,45 + 0,2\end{array} \right. \to \left\{ \begin{array}{l}x = 0,15\\y = 0,1\end{array} \right.\)
⟹ mFe = 0,15.56 = 8,4 gam
Hòa tan hoàn toàn 11,2 gam Fe vào HNO3 dư, thu được dung dịch A và 6,72 lít (đktc) hỗn hợp khí B gồm NO và một khí X, với tỉ lệ số mol là 1 : 1. Khí X là
nFe = 11,2 : 56 = 0,2 mol
nhh B = 6,72 : 22,4 = 0,3 mol
Theo đề bài NO và X có số mol bằng nhau nên ta có nNO = nX = 0,15 mol
Giả sử 1 mol khí X trao đổi n mol e
Áp dụng bảo toàn e:
3nFe = 3nNO + n.nX
⇔ 3.0,2 = 3.0,15 + 0,15n
⇔ n = 1
⟹ Khí X là NO2
Nung m gam bột sắt trong oxi, thu được 3 gam hỗn hợp chất rắn X. Hòa tan hết hỗn hợp X trong dung dịch HNO3 dư, thoát ra 0,56 lít (đktc) NO (là sản phẩm khử duy nhất). Giá trị của m là
Sơ đồ: \(F{\rm{e}} + {O_2} \to X\left\{ {F{\rm{e}}O,F{{\rm{e}}_2}{O_3},F{e_3}{O_4},F{\rm{e}}} \right\} + HN{O_3} \to F{\rm{e}}{\left( {N{O_3}} \right)_3} + NO + {H_2}O\)
Fe0 → Fe+3 + 3e O2 + 4e → 2O-2
x → 3x (mol) y → 4y (mol)
N+5 + 3e → N+2 (NO)
0,075 ← 0,025 (mol)
Ta có hệ phương trình: \(\left\{ \begin{array}{l}56{\rm{x}} + 32y = 3\\3x = 4y + 0,075\end{array} \right. \to \left\{ \begin{array}{l}x = 0,045\\y = 0,015\end{array} \right.\)
⟹ m = mFe = 56.0,045 = 2,52 gam
Hòa tan hoàn toàn 13,00 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí X duy nhất (đktc). Cô cạn dung dịch X thu được 39,8 gam chất rắn. Khí X là:
Chất rắn khan thu được chứa Zn(NO3)2 và có thể có NH4NO3.
Ta có: nZn(NO3)2 = nZn = 0,2 mol
Giả sử 1 phân tử khí trao đổi n electron.
BT electron: n e cho = n e nhận => 2nZn = 8nNH4NO3 + n.n khí => 2.0,2 = 8.0,025 + n.0,02
=> n = 10 => X là N2
Hỗn hợp X gồm Al, Fe2O3, Fe3O4, CuO trong đó oxi chiếm 25,39% khối lượng hỗn hợp. Cho m gam hỗn hợp X tác dụng với 8,96 lít CO (đktc) sau một thời gian thu được chất rắn Y và hỗn hợp khí Z có tỉ khối so với hiđro là 19. Cho chất rắn Y tác dụng với dung dịch HNO3 loãng dư thu được dung dịch T và 7,168 lít NO (điều kiện tiêu chuẩn, sản phẩm khử duy nhất). Cô cạn dung dịch T thu được b gam muối khan (biết b = 3,456m). Giá trị của b gần nhất với giá trị nào sau đây?
Giả sử Z gồm a mol CO dư và b mol CO2
+ BTNT "C": nCO bđ = nCO dư + nCO2 => a + b = 0,4 (1)
+ mZ = 28a + 44b = 0,4.19.2 (2)
Giải hệ (1) và (2) được a = 0,15 và b = 0,25
Quá trình khử oxit KL bằng CO có thể viết đơn giản là: CO + O → CO2
→ nO pư = nCO2 = 0,25 mol
→ nO dư = 0,2539m/16 - 0,25 mol
nNO = 7,168/22,4 = 0,32 mol
Coi hỗn hợp Y gồm {KL: 0,7461m (gam); O: 0,2539m/16 - 0,25 (mol)}
Ta có các quá trình nhận electron:
O0 + 2e → O-2
0,2539m/16-0,25 → 0,2539m/8-0,5
N+5 + 3e → N+2
0,96 ← 0,32
Cô cạn dung dịch T thu được 3,456m gam muối khan gồm kim loại và NO3- (trong muối)
Ta có: n NO3- trong muối = n e nhận = 0,2539m/8 - 0,5 + 0,96 = 0,2539m/8 + 0,46 (mol)
→ m muối = m kim loại + mNO3-trong muối
=> 0,7461m + 62.(0,2539m/8 + 0,46) = 3,456m
→ m = 38,4276 gam → b = 3,456m = 132,8 gam
Vậy giá trị của b gần nhất với giá trị 133,056.
Hòa tan hoàn toàn 0,1 mol Fe và 0,2 mol Al vào dung dịch HNO3 dư thu được hỗn hợp khí A gồm NO và NO2 có tỉ lệ mol tương ứng là 2 : 1. Thể tích của hỗn hợp khí A (ở đktc) là:
Gọi số mol NO là 2a mol; số mol NO2 là a mol
Quá trình cho - nhận electron:

Áp dụng định luật bảo toàn electron: ne cho = ne nhận suy ra 0,3 + 0,6 = 6a + a = 7a
Giải phương trình trên ta được a = 9/70 (mol) → Vhỗn hợp A = VNO + VNO2 = 3a.22,4 = 8,64 (lít)
Hoà tan hết 9,6 gam kim loại M trong dung dịch H2SO4 đặc, nóng, thu được SO2 là sản phẩm khử duy nhất. Cho toàn bộ lượng SO2 này hấp thụ vào 0,5 lít dung dịch NaOH 0,6M, sau phản ứng đem cô cạn dung dịch được 18,9 gam chất rắn. Kim loại M đó là
nNaOH = 0,5 . 0,6 = 0,3 mol
TH1: nếu là NaHSO3 => nNaHSO3 = 18,9: 104 = 0,1817 < 0,3 mol => loại
TH2: nếu là Na2SO3 => nNa2SO3 = 18,9: 126 = 0,15 mol
Bảo toàn nguyên tố ta có nNa2SO3 . 2 = n NaOH <=> 0,15 . 2 = 0,3 (thỏa mãn)
=> Chất rắn chứa Na2SO3
=> n SO2 = n Na2SO3 = 0,15 mol
=> n M . x = n SO2 . 2 = 0,3 mol
+ Với x = 1 => n M = 0,3 mol => MM = 9,6: 0,3 = 32 (loại)
+ Với x = 2 => n M = 0,15 mol => MM = 9,6: 0,15 = 64 (Cu chọn)
+ Với x = 3 => n M = 0,1 mol => MM = 9,6: 0,1 = 96 (loại)
Vậy kim loại cần tìm là Cu
Hòa tan hoàn toàn m gam Al vào dung dịch HNO3 loãng, dư thu được 1,344 lít khí N2 (đktc) và dung dịch X. Thêm NaOH dư vào dung dịch X và đun sôi thì thu được 1,344 lít khí NH3. Gía trị của m là:
Vì khi cho NaOH vào dd X thì tạo ra khí NH3 nên pư tạo muối NH4NO3
Al → Al+3 + 3e 2N+5 +10e→ N2 N+5 + 8e→ N-3
Số mol khí N2 là 0,06 mol
Số mol khí NH3 là 0,06 mol
Ta có NH4NO3 + NaOH → NaNO3 + NH3 +H2O
Số mol NH4NO3 là 0,06 mol
Áp dụng đinh luật bảo toàn e thì 3nAl = 10.0,06 + 8.0,06 nên nAl=0,36 mol
Khối lượng của Al là 0,36 .27=9,72 g
Thực hiện hai thí nghiệm:
1) Cho 5,76 gam Cu phản ứng với 120 ml dung dịch HNO3 1M thoát ra V1 lít khí NO
2) Cho 5,76 gam Cu phản ứng với 120 ml dung dịch chứa HNO3 1M và H2SO4 0,5M thoát ra V2 lít NO.
Biết NO là sản phẩm khử duy nhất, các thể tích khí đo cùng điều kiện. Quan hệ giữa V1 và V2 là:
Phần 1:
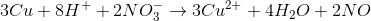
\({n_{Cu}} = 0,09\)
Số mol HNO3 là 0,12 mol
Theo PTHH thì số mol H+ hết nên NO sẽ tính theo H+ suy ra nNO= 0,03mol
V1 = 0,672 lít
Phần 2
Số mol H+ là 0,12.1 + 0,12.0,5.2 = 0,24 mol
Số mol NO3- là 0,12 mol
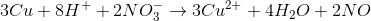
Theo phương trình hóa học số mol H+ và Cu vừa đủ nên nNO= 0,06 mol
V2 = 1,344 lít
Suy ra V2= 2V1
Chia 26,8 gam hỗn hợp gồm Mg, Na, K và Ca thành 2 phần bằng nhau. Phần 1: Tác dụng hoàn toàn với dung dịch HNO3 loãng thu được 1,344 lít khí N2 duy nhất (đktc) và dung dịch chứa x gam muối ( không chứa NH4NO3). Phần 2: Tác dụng hoàn toàn với oxi thu được y gam hỗn hợp oxit. Gía trị của x và y là:
Phần 1 : nặng 13,4 g
Ta có Mg → Mg+2 + 2e K → K+1 + 1e
Na → Na+1 + 1e Ca → Ca+2 + 2e
2N+5 + 10e → N2
Theo định luật bảo toàn e mol e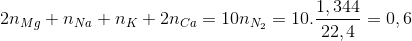
Ta có 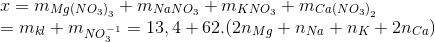
Suy ra x = 13,4 +62.0,6 =50,6 g
Phần 2 : tác dụng với oxi tạo oxit
Thì Mg → Mg+2 + 2e K → K+1 + 1e
Na → Na+1 + 1e Ca → Ca+2 + 2e
O2 + 4e →2O-2
Theo định luật bảo toàn e 4nO2= 0,6 ( do số e trao đổi ở phần 1 cũng là 0,7 mol e
Khối lượng oxit là 13,4 + 0,6:4.32 =18,5
Cho m gam bột Fe vào dụng dịch HNO3 lấy dư, ta được hỗn hợp X gồm hai khí NO2 và NO có VX = 8,96 lít (đktc) và tỉ khối đối với O2 bằng 1,3125. Thành phần % NO và % NO2 theo thể tích trong hỗn hợp X và khối lượng m của Fe đã dùng lần lượt là
Gọi số mol NO2 và NO lần lượt là x, y
Ta có hệ phương trình:
x + y = 0,4
46x + 30y = 0,4.(1,3125.32)
=> x = 0,3 và y = 0,1
(có thể dùng phương pháp đường chéo để tìm số mol các chất)
%VNO2 = 75% ; %VNO = 25%
N+5 + 1e → N+4 (NO2)
0,3 ← 0,3
N+5 + 3e → N+2 (NO)
0,3 ← 0,1
Fe0 → Fe+3 + 3e
0,2 ← 0,6
=> mFe = 0,2.56 = 11,2 gam
Hỗn hợp X gồm hai kim loại đứng trước H trong dãy điện hoá và có hoá trị không đổi trong các hợp chất. Chia m gam X thành hai phần bằng nhau
- Phần 1 : Hoà tan hoàn toàn trong dung dịch chứa axit HCl và H2SO4 loãng tạo ra 6,72 lít khí H2
- Phần 2 : Tác dụng hoàn toàn với dung dịch HNO3 thu được V lít khí NO (sản phẩm khử duy nhất).
Biết các thể tích khí đo ở điều kiện tiêu chuẩn. Giá trị của V là
Do hai kim loại đứng trước H trong dãy điện hoá và có hoá trị không đổi trong các hợp chất => số mol e cho ở cả 2 phần là bằng nhau => số mol e nhận 2 phần bằng nhau
Phần I:
2H+ + 2e → H2
0,6 ← 0,3
Phần II:
N+5 + 3e → N+2
0,6 → 0,2
=> VNO = 0,2 . 22,4 = 4,48 lít

