Hòa tan hoàn toàn 2,4 gam kim loại Mg vào dung dịch HNO3 loãng, giả sử chỉ thu được V lít khí NO duy nhất (đktc). Giá trị của V là
n Mg = 0,1 mol
Áp dụng định luật bảo toàn e: 2 n Mg = n NO . 3 => n NO = 2/3 mol
=> V NO = 2/3 . 22,4 = 1.4933 l
Cho m gam Cu phản ứng hết với dung dịch HNO3 thu được 8,96 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối đối với H2 là 19. Giá trị của m là
n hh = 0,4 mol
Ta có = 19 .2 = 38 => m NO + m NO2 = 38 . 0,4 = 15,2 g
=> Hệ phương trình:
\(\left\{ \begin{gathered}
{n_{NO}}\; + {\text{ }}{n_{NO2}} = 0,4 \hfill \\
{n_{NO}}\;.{\text{ }}30{\text{ }} + {\text{ }}{n_{NO2}}.{\text{ 46}} = 15,2 \hfill \\
\end{gathered} \right\}\)
=> n NO = 0,2 và n NO2 = 0,2 mol
Vận dụng định luật bảo toàn e: 2 n Cu = n NO . 3 + n NO2 . 1
=> n Cu = (0,2 .3 + 0,2): 2 = 0,4 mol
=> m Cu = 0,4 . 64 = 25,6 g
Hòa tan hoàn toàn 2,43 gam kim loại M (hóa trị n) vào dung dịch H2SO4 đặc nóng thu được 3, 024 lít( đktc) khí SO2. Kim loại M là:
Biện luận tìm M
Lời giải
Ta có M → M+n + n e
S +6 + 2 e → S+4
Số mol SO2 là 0,135 mol
Theo định luật bảo toàn e ta có 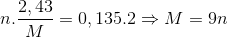
Vì n là hóa trị của kim loại nên n =1,2,3
Thỏa mãn n=3 và M =27 (Al)
Cho 8,1 gam Al tác dụng với dung dịch HNO3 thu được 2,016 lít khí X (không có sản phẩm khử khác). Khí X là:
Số mol Al là 8,1 : 27 =0,3 mol
Số mol khí X là 2,016 : 22,4 =0,09 mol
TH1 : khí tạo ra chỉ có 1 N trong công thức
Ta có Al → Al+3 + 3e
N+5 + (5 - x) e→ N+x
Theo định luật bảo toàn e thì 0,3.3=0,09.x suy ra x = 10 (loại vì x < 5)
TH2 : khí tạo ra có 2 N
Ta có Al → Al+3 + 3e
2N+5 + 2(5 - x) e→ 2N+x
Khi đó 0,3.3 = 0,09.2.(5-x) suy ra x = 0
Vậy N có số oxh O trong khí X do đó X là khí N2
Chia 29,8 gam hỗn hợp gồm Mg, Na, K và Ca thành 2 phần bằng nhau.Phần 1: Tác dụng hoàn toàn với dung dịch HNO3 loãng thu được 1,568 lít khí N2 duy nhất (đktc) và dung dịch chứa x gam muối ( không chứa NH4NO3).Phần 2: Tác dụng hoàn toàn với oxi thu được y gam hỗn hợp oxit.Gía trị của x và y là:
Phần 1 : nặng 14,9 g
Ta có Mg → Mg+2 + 2e K → K+1 + 1e
Na → Na+1 + 1e Ca → Ca+2 + 2e
2N+5 + 10e → N2
Theo định luật bảo toàn e mol e 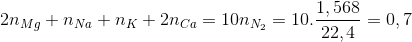
Ta có 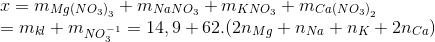
Suy ra x = 14,9 +62.0,7 =58,3 g
Phần 2 : tác dụng với oxi tạo oxit
Thì Mg → Mg+2 + 2e K → K+1 + 1e
Na → Na+1 + 1e Ca → Ca+2 + 2e
O2 + 4e →2O-2
Theo định luật bảo toàn e 4nO2= 0,7 ( do số e trao đổi ở phần 1 cũng là 0,7 mol e
Khối lượng oxit là 14,9 + 0,7:4.32 =20,5
Hoà tan hoàn toàn 1,08 gam Al bằng dung dịch HNO3 dư, sản phẩm ứng thu được 0,336 lít khí X (sản phẩm khử duy nhất ở đktc). Công thức phân tử của X là
nAl = 0,04 mol
Al0 → Al+3 + 3e
ne cho = 3.nAl = 0,12 mol
Áp dụng định luật bảo toàn e => ne nhận = ne cho = 0,12 mol
Mà nX = 0,015 mol => 1 mol X nhận số mol e là: 0,12 : 0,015 = 8 mol
=> X là N2O
Nung 11,2 gam Fe trong không khí, sau một thời gian thu được m gam hỗn hợp rắn X gồm: Fe, FeO, Fe2O3 và Fe3O4. Hoà tan hoàn toàn hỗn hợp X bằng dung dịch HNO3 vừa đủ, sau phản ứng thu được dung dịch A chỉ chứa muối Fe(NO)3 và 2,24 lít NO (đktc). Giá trị của m là:
Quy đổi hh X gồm Fe và O2
nFe = 0,2mol; nNO= 0,1mol
Fe → Fe+3 + 3e O2 + 4e→ O-2 N+5 + 3e → N+2
0,2 → 0,6 mol x→ 4xmol 0,3 ←0,1
Áp dụng định luật bảo toàn e ta có: 0,6 = 4x + 0,3 => x = 0,075mol
=> m = mFe + mO2 = 11,2 + 0,075 . 32 = 13,6g
Hoà tan hoàn toàn 2,24 gam kim loại R chưa rõ hoá trị bằng dung dịch HNO3, sau phản ứng thu được dung dịch gồm muối nitrat của kim loại R và 0,896 lít khí NO (đktc) là sản phẩm khử duy nhất . Kim loại R là:
nNO= 0,04mol
R → R+n + ne N+5 + 3e → N+2
0,12/n ← 0,12mol 0,12 ← 0,04
Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 0,12 mol
=> nR = 0,12/n
=> MR = 2,24 : (0,12/n) = 56n/3

Hoà tan hoàn toàn 3,6 gam kim loại R có hoá trị II (không đổi) bằng dung dịch HNO3, sau phản ứng thu được dung dịch gồm muối nitrat của kim loại R và 2,24 lít khí NO (đktc) là sản phẩm khử duy nhất. Kim loại R là:
nNO= 0, 1mol
R → R+2 + 2e N+5 + 3e →N+2
0,15 ← 0,3 mol 0,3 ← 0,1
Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 0,3 mol
=> nR = 0,15 mol
=> MR = 3,6 : 0,15 = 24 (Mg)
Hoà tan hoàn 12,4 gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 1M vừa đủ, sau phản ứng thu được dung dịch A gồm 2 muối Fe(NO3)3 và Cu(NO3)2 đồng thời thu được hỗn hợp khí Y gồm: 0,1 mol NO và 0,15 mol NO2 (đktc). Phần trăm theo khối lượng Fe có trong hỗn hợp là:
nCu= x mol; nFe= y mol
=> mX = 64x + 56y = 12,4 (1)
Cu → Cu+2 + 2e N+5 + 3e → N+2
x → 2x mol 0,3 ← 0,1
Fe → Fe+3 +3e N+5 +1e →N+4
y → 3y mol 0,15←0,15
Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 2x + 3y = 0,45 mol (2)
Giải hệ (1) và (2) => x = 0,15 và y = 0,05
=> %Fe = [(0,05 . 56) : 12,4] . 100% = 22,58%
Hoà tan hoàn toàn m gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 1M vừa đủ, sau phản ứng thu được dung dịch A gồm 2 muối Fe(NO3)3 và Cu(NO3)2 và 2,24 lít khí NO (đktc) là sản phẩm khử duy nhất. Thể tích dung dịch HNO3 đã dùng là:
Cách 1: (nhanh)
nNO=0,1 mol
NO3- + 4H+ + 3e → NO + 2H2O
0,4 ← 0,1
VHNO3 = nHNO3 : CM = 0,4 : 1 = 0,4 lít
Cách 2:
nNO = 2,24 :22,4 = 0,1 (mol)
Sau phản ứng Fe lên Fe+3; Cu lên Cu+2; N+5 xuống N+2 (trong NO)
Qúa trình nhường e:
Fe → Fe+3 + 3e
x → x → 3x (mol)
Cu → Cu +2 + 2e
y → y → 2y (mol)
Qúa trình nhận e
N+5 +3e → N+2 (NO)
0,3 ← 0,1 (mol)
Bảo toàn e ta có:
∑ne KL nhường = ∑ne N+5 nhận
=> (3x+2y) = 0,3 (1)
Ta có:
nHNO3 ban đầu = nNO3- (trong muối) + nNO
= 3nFe(NO3)3 + 2nCu(NO3)2 + nNO
= 3x + 2y + 0,1
= 0,3 + 0,1 (do thế (1) vào)
= 0,4 (mol)
=> VHNO3 đã dùng = n : CM = 0,4 : 1 = 0,4 (lit)
Đốt cháy m gam Fe trong 1,12 lít O2 (đktc), sau một thời gian thu được hỗn hợp Y gồm: FeO, Fe2O3, Fe3O4 và Fe dư. Hoà tan hoàn toàn hỗn hợp X bằng dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y chỉ chứa muối Fe(NO3)3 và 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là:
Quy đổi hh X gồm Fe và O2
nNO2 = 0,1 mol; nO2 = 0,05 mol
Fe → Fe+3 + 3e O2 + 4e→ O-2 N+5 + 1e → N+4
x → 3x mol 0,05→ 0,2mol 0,1← 0,1
Áp dụng định luật bảo toàn e ta có 3x = 0,2 + 0,1 => x = 0,1 mol
=> m = 5,6g
Hoà tan hoàn toàn 15,2 gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y gồm 2 muối nitrat và hỗn hợp Y gồm 2 khí NO và NO2 có số mol lần lượt là 0,1 và 0,3. Thể tích dung dịch HNO3 1M đã dùng là:
nCu= x mol; nFe= y mol
=> mX = 64x + 56y = 15,2 (1)
Cu → Cu+2 + 2e N+5 + 3e → N+2
x → 2x mol 0,3 ← 0,1
Fe → Fe+3 +3e N+5 +1e →N+4
y → 3y mol 0,3←0,3
Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 2x + 3y = 0,6 mol (2)
Giải hệ (1) và (2) => x = 0,15 và y = 0,1
n HNO3 = 2nCu(NO3)2 + 3nFe(NO3)3 + nNO + nNO2 = 0,15 . 2 + 0,1 . 3 + 0,1 + 0,3 = 1mol
=> V = 1 lít
Hoà tan hoàn toàn 15,2 gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y gồm 2 muối nitrat và hỗn hợp Y gồm 2 khí NO và NO2 có số mol lần lượt là 0,1 và 0,3. Tổng khối lượng muối thu được trong dung dịch Y là:
nCu= x mol; nFe= y mol
=> mX = 64x + 56y = 15,2 (1)
Cu → Cu+2 + 2e N+5 + 3e → N+2
x → 2x mol 0,3 ← 0,1
Fe → Fe+3 +3e N+5 +1e →N+4
y → 3y mol 0,3←0,3
Áp dụng định luật bảo toàn e ta có n e cho = n e nhận = 2x + 3y = 0,6 mol (2)
Giải hệ (1) và (2) => x = 0,15 và y = 0,1
m muối = mCu(NO3)2 + mFe(NO3)3 = 0,15 . 188 + 0,1 . 242 = 52,4g
Hòa tan hoàn toàn 2,4 gam kim loại Mg vào dung dịch HNO3 loãng chỉ thu được V lít khí N2 (đktc, sản phẩm khử duy nhất). Giá trị của V là
nMg = 0,1 mol
Bảo toàn electron: $2.{{n}_{Mg}}=10.{{n}_{{{N}_{2}}}}=>{{n}_{{{N}_{2}}}}=\frac{{{n}_{Mg}}}{5}=0,02\,\,mol$
=> V = 0,02.22,4 = 0,448 lít
Hoà tan hoàn toàn m gam Al vào dung dịch HNO3 rất loãng thì thu được hỗn hợp gồm 0,015 mol khí N2O và 0,01 mol khí NO (không còn sản phẩm khử nào khác). Giá trị của m là
Bảo toàn electron:
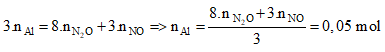
=> mAl = 0,05.27 = 1,35 gam
Hòa tan 0,1 mol Al và 0,2 mol Cu trong dung dịch H2SO4 đặc dư thu được V lít SO2 (ở 00C, 1 atm). Giá trị của V là
Ở 00C, 1 atm là điều kiện tiêu chuẩn.
Áp dụng định luật bảo toàn electron:
2.nCu + 3.nAl= 2.${{n}_{S{{O}_{2}}}}$=> 2.0,2 + 3.0,1 = (6 – 4).${{n}_{S{{O}_{2}}}}$
=> ${{n}_{S{{O}_{2}}}}$ = 0,35 mol => ${{V}_{S{{O}_{2}}}}=\frac{n.R.T}{p}=\frac{0,35.0,082.273}{1}=$ 7,84 lít
Hòa tan hoàn toàn 1,2 gam kim loại X vào dung dịch HNO3 dư thu được 0,224 lít khí N2 (đktc). Giả thiết phản ứng chỉ tạo ra khí N2. Vậy X là
Bước 1: Tính nN2
${{n}_{{{N}_{2}}}}=0,01\,\,mol$
Bước 2: Tìm X
Giả sử kim loại X tác dụng với HNO3 lên số oxi hóa +a
Bảo toàn e: $a.{{n}_{X}}=10.{{n}_{{{N}_{2}}}}\,\,=>{{n}_{X}}=\dfrac{0,1}{a}\,\,=>\dfrac{1,2}{{{M}_{X}}}=\dfrac{0,1}{na}=>{{M}_{X}}=12a$
Với a = 2 => M = 24 => M là Mg
Cho 5,94 gam Al tác dụng vừa đủ với dung dịch H2SO4 đặc nóng thu được 1,848 lít sản phẩm X có chứa lưu huỳnh (đktc), muối sunfat và nước. X là
nAl = 0,22 mol
nX = 0,0825 mol
Quá trình cho e:
Al → $\overset{+3}{\mathop{Al}}\,$ + 3e
0,22 → 0,66
=> ne cho = 0,22.3 = 0,66 mol
Quá trình nhận e : S+6 + (6 – x)e → Sx
0,0825(6-x) ← 0,0825
=> ne nhận = 0,0825.(6 – x) mol
Áp dụng định luật bảo toàn electron, ta có : 0,0825.(6 – x) = 0,66 → x = -2
Vậy X là H2S
Cho 1,35 gam X gồm Cu, Mg, Al tác dụng hết với HNO3 thu được 0,01 mol NO và 0,04 mol NO2. Khối lượng muối tạo ra là
Nhận e: $\overset{+5}{\mathop{N}}\,$ + 3e → $\overset{+2}{\mathop{N}}\,$ (NO) $\overset{+5}{\mathop{N}}\,$ + 1e → $\overset{+4}{\mathop{N}}\,$ (NO2)
0,03 ← 0,01 0,04 ← 0,04
Bảo toàn e: ne cho = ne nhận = 3.nNO + 1.nNO2 = 0,07 mol
=> ${{m}_{NO_{3}^{-}}}$trong muối kim loại = ne cho = 0,07 mol
=> mmuối = mKL + mgốc NO3 = 1,35 + 62.0,07 = 5,69 gam

