Potassium (K) có vai trò quan trọng trong chống co cơ và việc gởi tất cả các xung động thần kinh ở động vật qua các tiềm năng hành động (Action potential). Sự thiếu hụt potassium trong các dung dịch trong cơ thể có thể gây ra các tình trạng có thể tử vong như thiếu kali máu, đặc biệt gây nôn mửa, tiêu chảy hoặc tăng bài tiết niệu đạo. Cho cấu hình electron của potassium: 1s22s22p63s23p64s1. Phát biểu nào sau đây không đúng?
Cấu hình orbital nguyên tử của K là
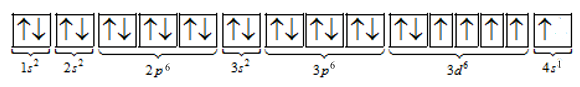
A đúng
B đúng
C sai. Số hạt mang điện của K là 19.2 = 38 hạt
D đúng
Cho biết cấu hình electron của X và Y lần lượt là 1s22s22p63s23p3 và 1s22s22p63s23p64s1.
Nhận xét nào sau đây đúng?
Nguyên tử X có 5 electron ở lớp ngoài cùng (3s23p3) nên X là phi kim.
Nguyên tử Y có 1 electron ở lớp ngoài cùng (4s1) nên Y là kim loại.
Nguyên tố X có phân lớp electron ngoài cùng là 3p3. Nhận định nào đúng khi nói về X?
1s22s22p63s23p3
A sai. Hạt nhân nguyên tử của X có 15 proton.
B sai. Lớp ngoài cùng của nguyên tử nguyên tố X có 5 electron.
C đúng
D sai. X là nguyên tố thuộc nhóm VA.
Magnesium là nguyên tố phổ biến thứ 8 trong lớp vỏ của Trái Đất, ở điều kiện thường là chất rắn, có màu trắng bạc, rất nhẹ. Magnesium được sử dụng để làm cho hợp kim bền nhẹ, đặc biệt là cho ngành công nghiệp hàng không vũ trụ, cũng như sử dụng trong pháo hoa bởi vì nó đốt chảy với một ngọn lửa trắng rực rỡ. Trong bảng tuần hoàn, magnesium nằm ở chu kỳ 3, nhóm IIA. Số electron độc thân của magnesium là
Trong bảng tuần hoàn, magnesium nằm ở chu kỳ 3, nhóm IIA.
=> Cấu hình electron nguyên tử của magnesium là 1s22s22p63s2
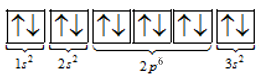
Từ cấu hình suy ra magnesium không có electron độc thân
Cấu hình electron của nguyên tố Fe (Z = 26) là:
Cấu hình e của Fe (Z = 26) là: 1s22s22p63s23p63d64s2.
Cấu hình electron của ion Mg2+ (Z = 12) là:
Cấu hình của Mg là : 1s22s22p63s2 => Mg2+có cấu hình e : 1s22s22p6
Cấu hình electron của ion N3- (Z = 7) là:
Cấu hình của N là : 1s22s22p3 => N3-có cấu hình e : 1s22s22p6
Số electron lớp ngoài cùng của các nguyên tố có Z = 19, Z = 16 và Z = 18 lần lượt là:
Z = 19 : 1s22s22p63s23p64s1
Z = 16 : 1s22s22p63s23p4
Z = 18 : 1s22s22p63s23p6
Nguyên tử của nguyên tố hóa học nào sau đây có cấu hình electron là 1s22s22p63s23p64s1
Tổng số e = 2 + 2 + 6 + 2 + 6 + 1 = 19 = Z
=> K (Z = 19)
Cấu hình electron nào sau đây viết không đúng?
Cấu hình e viết sai là: 1s2 2s2 2p7 vì phân lớp p chứa tối đa 6 e
Ion X có 18 electron và 16 proton, mang điện tích là
Vì X có 16p => trong nguyên tử X có 16 e
Mà trong ion X có 18 e => ion nhiều hơn nguyên tử 2 e
=> mang điện tích 2-
Cu2+ có cấu hình electron là (biết Cu có Z = 29)
Cấu hình e của Cu: 1s22s22p63s23p63d104s1
=> Cấu hình e của Cu2+ là: 1s22s22p63s23p63d9
Nhận định nào đúng?
Nhận định đúng là: Tất cả các nguyên tố mà nguyên tử có 7 electron ở lớp ngoài cùng đều là phi kim.
Cấu trúc electron nào sau đây là của phi kim:
(1). 1s22s22p63s23p4
(2). 1s22s22p63s23p63d24s2
(3). 1s22s22p63s23p63d104s24p3
(4). [Ar]3d54s1
(5). [Ne]3s23p3
(6). [Ne]3s23p64s2
(1). 1s22s22p63s23p4 là phi kim vì có 6e lớp ngoài cùng
(2). 1s22s22p63s23p63d24s2 là kim loại vì có 2e lớp ngoài cùng
(3). 1s22s22p63s23p63d104s24p3 là phi kim vì có 5e lớp ngoài cùng
(4). [Ar]3d54s1 là kim loại vì có 1e lớp ngoài cùng
(5). [Ne]3s23p3 là phi kim vì có 5e lớp ngoài cùng
(6). [Ne]3s23p64s2 là kim loại vì có 2e lớp ngoài cùng
Vậy cấu hình (1), (3), (5) là của phi kim.
Cho biết cấu hình electron nguyên tử của các nguyên tố sau:
X là 1s2 2s2 2p2
Y là 1s2 2s2 2p6 3s1
Z là 1s2 2s2 2p6 3s2;
T là 1s2 2s2 2p6 3s2 3p1
Q là 1s2 2s2 2p6 3s2 3p5
R là 1s2 2s2 2p6 3s2 3p6
Các nguyên tố kim loại là
Các nguyên tố kim loại là Y, Z, T
Nguyên tử của nguyên tố R có lớp ngoài cùng là lớp M, trên lớp M có chứa 2 electron. Cấu hình electron của R và tính chất của R là
Lớp M là lớp thứ 3 => lớp thứ nhất và lớp thứ 2 đã đầy e
=> cấu hình e của R là: 1s22s22p63s2
R có 2e lớp ngoài cùng => R là kim loại
Nguyên tử của nguyên tố X có điện tích hạt nhân là 13+, số khối 27 có số electron lớp ngoài cùng là
Số e = số điện tích hạt nhân = 13
=> cấu hình e của X là: 1s22s22p63s23p1
=> số e lớp ngoài cùng = 2 + 1 = 3
Tổng số hạt của nguyên tử nguyên tố X là 52. Cấu hình electron ở phân lớp ngoài cùng của X là 3p5. Số khối của X là
+) Cấu hình e lớp ngoài cùng của X là 3p5 => cấu hình e của X là 1s22s22p63s23p5
=> X có 17 e => X có 17 p
+) Tổng số hạt trong X: p + n + e = 52 => n = 52 – 17.2 = 18
+) số khối A = p + n = 17 + 18 = 35
Nguyên tử X có electron cuối cùng phân bố vào phân lớp 3d và làm cho phân lớp d có tất cả là 7 electron. Tổng số electron của nguyên tử X là
X có electron cuối cùng phân bố vào phân lớp 3d
=> mức năng lượng e của X là: 1s22s22p63s23p64s23d7
=> cấu hình e của X là 1s22s22p63s23p63d74s2
=> tổng số e của X là 27
Nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 10. Nguyên tố X là
X có tổng số electron ở các phân lớp p là 10
Vì lớp thứ 2 chỉ có 6e ở phân lớp p => X có 3 lớp e
=> cấu hình e của X : 1s22s22p63s23p4
=> X có 16e, 16p => X là S

