Nguyên tử X có tổng số hạt p, n, e là 52 và số khối là 35. Cấu hình electron của X là:
Z = số E và A = số P + số N = Số E + số N
=> 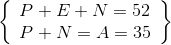 => số E = 17
=> số E = 17
Z = 17 : 1s22s22p63s23p5
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z=11) là:
Cấu hình electron của nguyên tử Na (Z=11) là: 1s22s22p63s1
Phát biểu nào dưới đây là đúng?
Trong nguyên tử, các electron được sắp xếp thành từng lớp, các lớp được sắp xếp từ gần hạt nhân ra ngoài. Các electron trên cùng một lớp có năng lượng gần bằng nhau. Vậy phát biểu D sai.
Những electron ở lớp trong liên kết với hạt nhân bền chặt hơn những electron ở lớp ngoài. Do đó năng lượng của electron ở lớp trong thấp hơn năng lượng electron ở lớp ngoài suy ra electron ở obitan 4p có mức năng lượng cao hơn electron ở obitan 4s và những electron gần hạt nhân có năng lượng thấp nhất. Vậy phát biểu C sai và phát biểu B sai.
Theo trình tự sắp xếp lớp K là lớp gần hạt nhân nhất. Năng lượng của electron trên lớp K là thấp nhất.
Vậy phát biểu A đúng.
Cho các nguyên tố với số hiệu nguyên tử sau: X (Z = 1); Y (Z = 7); E (Z = 12); T (Z = 19). Dãy gồm các nguyên tố kim loại là:
1X: 1s1 => H
7Y: 1s22s22p3 => phi kim
12E: 1s22s22p63s2 => kim loại
19T: 1s22s22p63s23p64s1 => kim loại
Vậy các kim loại là E và T
Chỉ ra cấu hình electron nguyên tử viết đúng:
Cấu hình 1s22s22p63s23p64s23d6 (Z=26) sai
Cấu hình 1s22s22p63s23p63d94s2 (Z=29) sai vì electron ở 4s sẽ chuyển sang 3d để đạt được cấu hình e bão hòa.
Cấu hình 1s22s22p63s23p63d6 (Z=24) sai vì electron phải điền vào phân lớp 4s trước
Cấu hình electron 1s22s22p63s23p64s2 (Z=20) là đúng.
Cho biết cấu hình electron của X và Y lần lượt là:
X: 1s22s22p63s23p3 và Y: 1s22s22p63s23p64s1
Nhận xét nào sau đây là đúng?
Nguyên tử X có 5 electron ở lớp ngoài cùng nên X là phi kim.
Nguyên tử Y có 1 electron ở lớp ngoài cùng nên Y là kim loại.
Nguyên tử nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Xác định tên các nguyên tố X và Y (biết số hiệu nguyên tử của nguyên tố: Na = 11, Al =13, P= 15, Cl=17, Fe= 26)
Nguyên tử nguyên tố X có tổng số hạt electron trong các phân lớp p là 7.
Vậy cấu hình electron của X là 1s22s22p63s23p1
Số electron của X bằng 13. Suy ra số hạt mang điện của X bằng 2.13= 26
Số hạt mang điện của Y bằng 26 + 8 =34 hạt → Y có số hiệu nguyên tử Z = 34 : 2 = 17
Vậy X, Y lần lượt là Al và Cl
Một ion M3+ có tổng số hạt proton, notron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Viết cấu hình electron của nguyên tử M?
Một ion M3+ có tổng số hạt proton, notron và electron là 79 → 2Z + N – 3 = 79
Số hạt mang điện nhiều hơn số hạt không mang điện là 19 → 2Z – 3- N= 19
Giải hệ trên ta có Z= 26 và N = 30
Với Z= 26 ta có cấu hình electron nguyên tử là 1s22s22p63s23p63d64s2 hay [Ar]3d64s2
Nguyên tử của một nguyên tố có cấu hình electron là 1s22s22p63s2 thì nguyên tố đó thuộc:
Vị trí của nguyên tử trong bảng tuần hoàn:
- Có 3 lớp e là 1, 2 và 3 ⇒ Thuộc chu kì 3.
- Lớp electron ngoài cùng là 3s2:
+ Có 2 e ở lớp ngoài cùng nên ở nhóm thứ II.
+ 2e ở lớp ngoài cùng thuộc phân lớp s nên ở nhóm A.
⇒ Ở nhóm IIA.
Vậy chỉ có phương án B đúng.
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
Na (Z = 11) có cấu hình e là: 1s22s22p63s1
Nguyên tử của nguyên tố X có cấu hình electron kết thúc ở phân lớp 4s2. X có số proton bằng
Cấu hình electron nguyên tử: 1s22s22p63s23p64s2
⇒ Số proton = số electron = 20
Anion X- có cấu hình electron ở phân lớp ngoài cùng là 3p6. Vị trí của X trong bảng tuần hoàn:
X- có cấu hình electron: 1s22s22p63s23p6 => Cấu hình e của X: 1s22s22p63s23p5
Vậy vị trí của X trong bảng tuần hoàn là:
- Chu kì 3 (vì có 3 lớp e)
- Nhóm VIIA (vì là nguyên tố p và có 7e lớp ngoài cùng)
Cấu hình electron nào sau đây viết sai?
Cấu hình 1s22s22p63s23p64s24p5 thiếu phân lớp 3d. Trước khi electron được điền vào phân lớp 4p phải điền vào phân lớp 3d.
Nguyên tử 27X có cấu hình electron 1s22s22p63s23p1. Hạt nhân nguyên tử X có
27X có cấu hình electron 1s22s22p63s23p1 => số p = số e = 2 + 2 + 6 + 3 + 1 = 13
→ số n = A – p = 27 - 13 = 14
Nguyên tử của nguyên tố X có cấu hình electron: 1s22s22p63s23p3. X là kim loại hay phi kim?
X có 5e lớp ngoài cùng (3s23p3) → X là nguyên tố phi kim
Nguyên tử Ne (Z=10) và các ion Na+ (Z=11), F- (Z=9) có:
Nguyên tử Ne (Z=10) và các ion Na+ (Z=11), F- (Z=9) đều có 10e.
Cation R2+ có cấu hình electron ở phân lớp ngoài cùng là 2p6 . Cấu hình electron của nguyên tử R
Cấu hình electron của R2+: 1s22s22p6 → R nhận thêm 2e từ R2+
→ Cấu hình e của R: 1s22s22p63s2
R2+ + 2e → R
(1s22s22p6) → (1s22s22p63s2)
Cho các nguyên tố có số hiệu nguyên tử lần lượt là Y (Z=3) ; Z(Z=7) ; E(Z=12);T(Z=18); R(Z=19). Dãy gồm các nguyên tố kim loại là?
Cấu hình e của các nguyên tố:
Y (Z=3): 1s22s1→ có 1e lớp ngoài cùng
Z (Z = 7): 1s22s22p3→ có 5e lớp ngoài cùng
E (Z=12): 1s22s22p63s2 → có 2e lớp ngoài cùng
T (Z=18): 1s22s22p63s23p6 → có 8e lớp ngoài cùng
R (Z = 19): 1s22s22p63s23p64s1→ có 1e lớp ngoài cùng
→ 3 nguyên tử Y, E, R có 1-3 electron lớp ngoài cùng nên là nguyên tố kim loại
Cấu hình electron nguyên tử của một nguyên tố là 1s22s22p63s23p4. Số electron độc thân của nguyên tố là
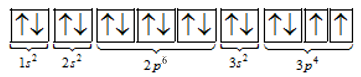
Từ cấu hình trên suy ra nguyên tố có 2 electron độc thân
Nguyên tử nguyên tố X có tổng số hạt cơ bản là 82. Số hạt mang điện nhiều hơn số hạt không mang điện là 22. Phát biểu không đúng là
Theo bài có hệ phương trình {2p+n=822p−n=22⇔{p=26n=30
=> Cấu hình electron của X là 1s22s22p63s23p63d64s2
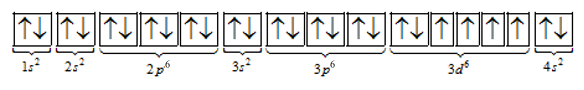
A đúng vì X thuộc nhóm B, nhóm B đều là kim loại
B sai. X có 4 electron độc thân
C đúng
D đúng. Electron cuối cùng của X được điền vào phân lớp 3d của lớp thứ 3 tức lớp M

