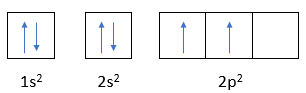
X có tổng số electron trên phân lớp p là 12. Cấu hình electron của X là
1s22s22p63s23p6
Đáp án C
Nguvên tử X và Y có số hiệu nguyên tử lần lượt là 19 và 15. Nhận xét nào sau đây đúng ?
19X: 1s22s22p63s23p64s1 => X có 1e lớp ngoài cùng => KL
15Y: 1s22s22p63s23p3 => Y có 5e lớp ngoài cùng => PK
Nguyên tử của nguyên tố X có cấu hình electron kết thúc ở phân lớp 4s2. X có số proton bằng
Cấu hình electron nguyên tử: 1s22s22p63s23p64s2
⇒ Số proton = số electron = 20
Đáp án A
Cấu hình electron nào sau đây vi phạm nguyên lí pau-li ?
Phân lớp s chứa tói đa 2 e :
Phân lớp p chứa tối đa 6 e :
Phân lớp d chứa tối đa 10 e
Phân lớp f chứa tối đa 14 e
Ở trạng thái cơ bản, nguyên tử của những nguyên tố nào dưới đây không chứa electron độc thân?
| Nguyên tố | Cấu hình electron | Cấu hình electron dạng orbital |
| C (Z=6) | 1s22s22p2
| |
| Ne (Z=10) | 1s22s22p6
| |
| Mg (Z=12) | 1s22s22p63s2
| |
| Ar (Z=18) | 1s22s22p63s23p6
|
Đáp án A
Cấu hình electron của ion được thiết lập bằng cách thêm hoặc bớt electron, bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng. O có số hiệu nguyên tử Z=8. Cấu hình electron của ion O2- là
- Cấu hình electron của O: 1s22s22p4
- O nhận thêm 2 electron thì thành ion O2-
⇒ Cấu hình electron của O2-: 1s22s22p6
Đáp án C
Nguyên tử X có 3 lớp electron, tổng số electron trên lớp ngoài cùng là 7 electron và số khối là 35. Số lượng các hạt của nguyên tử X là
- Viết cấu hình electron của X: 1s22s22p63s23p5
⇒ Số proton = số electron = 17
Mà A=Z+N ⇒ N=35-17=18
Đáp án D
Nguyên tử Cu có Z = 29. Cấu hình electron của nguyên tử Cu là:
Bước 1: Cu có Z = 29 => có 29 e trong nguyên tử
Bước 2: Cấu hình e theo phân mức năng lượng:
1s22s22p63s23p64s23d9
Bước 3: Vì d chứa tối đa 10 e => 1 e từ 4s2 chuyển qua 3d9 để lớp d bão hòa thành 10 e
=> Cấu hình e của Cu là: 1s22s22p63s23p63d104s1
Hai ion đơn nguyên tử X- và Y+ đều có cấu hình electron của nguyên tử khí hiếm Neon (Z=10). Điện tích hạt nhân của X và Y lần lượt là
- Cấu hình electron của Ne: 1s22s22p6
- X- mất đi 1 electron thì tạo thành X
- Y+ nhận thêm 1 electron thì tạo thành Y
⇒ Cấu hình electron của X, Y
X: 1s22s22p5 (Z=9)
Y: 1s22s22p63s1 (Z=11)
Đáp án B
Cho nguyên tố Ca (Z=20), cấu hình electron của Ca là
Cấu hình electron của 20Ca: 1s22s22p63s23p64s2
Cho số hiệu nguyên tử của Mg là 12. Số lượng hạt electron và proton của ion Mg2+ lần lượt là
- Viết cấu hình electron của Mg: 1s22s22p63s2
- Viết cấu hình electron của Mg2+: 1s22s22p6
⇒ Số proton và số electron của Mg2+ là 12 và 10
Đáp án A
Nguyên tử của nguyên tố A có cấu hình electron ở phân lớp ngoài cùng là 3d6. Số hiệu nguyên tử của A là:
Electron cuối cùng được xắp vào phân lớp 3d => 4s phải được xắp đầy mới đến 3d
=> 1s22s22p63s23p63d64s2 => có 26 e => số hiệu 26
Cho số hiệu nguyên tử của aluminum là 13. Aluminum là
- Cấu hình electron của Al: 1s22s22p63s23p1
- Từ cấu hình electron thấy lớp ngoài cùng có 3 electron nên Al là một kim loại
Đáp án D
Ion X2- và M3+ đều có cấu hình electron là 1s22s22p6 . X, M là những nguyên tử nào sau đây ?
X2- : 1s22s22p6 => X : 1s22s22p4 ( X nhận thêm 2 electron để tạo thành X2- ) : X là O
M3+ : 1s22s22p6 => M : 1s22s22p63s23p1 ( M bị mất đi 3 electron tạo thành M3+ ) M là Al
Nguyên tử Na, Mg, F lần lượt có số hiệu nguyên tử là 11, 12, 9. Các ion Na+, Mg2+, F- khác nhau về
Những ion thuộc những nguyên tố khác nhau thì có số p khác nhau
Các nguyên tử có Z < 20, thỏa mãn điều kiện có 2e độc thân lớp ngoài cùng là:
C (Z = 6) : 1s22s22p2 : 2 e độc thân ( phân lớp p có 3 ô obitan mỗi 1 e ở 1 obitan )
Si (Z = 14) : 1s22s22p63s23p2
O (Z = 6) : 1s22s22p4 : 2 e độc thân ( 1 obitan đã ghép đôi e ,2 obitan chưa được ghép đôi )
S (Z = 16) : 1s22s22p63s23p4 : 2 e độc thân ( 1 obitan đã ghép đôi e ,2 obitan chưa được ghép đôi )
Cho cấu hình electron của các nguyên tử sau :
(X) 1s22s22p63s23p3
(Y) 1s22s22p63s23p64s1
(Z) 1s22s22p63s2
(T) 1s22s22p63s23p63d84s2
Dãy các cấu hình electron của các nguyên tử kim loại là :
X có 5e lớp ngoài cùng => PK
Y có 1e lớp ngoài cùng => KL
Z có 2e lớp ngoài cùng => KL
T có 2e lớp ngoài cùng => KL
Câu trúc electron nào sau đây là của phi kim:
(1) 1s22s22p63s23p4 (4) [Ar] 3d54s1
(2) 1s22s22p63s23p6 (5) [Ne] 3s23p3
(3) 1s22s22p63s23p63d104s24p3 (6) [Ne] 3s23p64s2
Số electron lớp ngoài cùng là : 5 ,6 ,7 là của phi kim
(1) 1s22s22p63s23p4 : e ngoài cùng là : 3s23p4 : 6 e ngoài cùng
(3) 1s22s22p63s23p63d104s24p3 : : e ngoài cùng là : 4s24p3 có 5 e ngoài cùng
(5) [Ne] 3s23p3 : e ngoài cùng là : 3s23p3 có 5 e ngoài cùng
Một nguyên tử có Z là 14 thì nguyên tử đó có đặc điểm sau:
Z = 14 : 1s22s22p63s23p2 : lớp p có 3 obitan : trong đó có 2 obitan đã chứa e độc thân còn 1 obitan trống
Nguyên tử của nguyên tố X có e cuối cùng điền vào phân lớp 3p1. Nguyên tử nguyên tố Y có e cuối cùng điền vào phân lớp 3p3. Số proton của X,Y lần lượt là:
X : 1s22s22p63s23p1 : có 13 electron
Y : 1s22s22p63s23p3 : có 15 electron