Dung dịch BaCl2 có thể làm thuốc thử để nhận biết cặp dung dịch nào sau đây ?
|
|
Na2SO4 |
NaCl |
|
BaCl2 |
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl → xuất hiện kết tủa trắng |
Không hiện trượng |
Cho sơ đồ sau:
\({S^{ - 2}} \to S \to {S^{ + 4}} \to {S^{ + 6}} \to {S^{ - 2}}\)
Vậy S-2, S+4 và S+6 có thể tương ứng với dãy các chất nào sau đây ?
S-2, S+4 và S+6 có thể tương ứng với dãy các chất: H2S, SO2, H2SO4
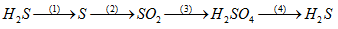
(1) 2H2S + SO2 → 3S +2 H2O
(2) S + O2 → SO2
(3) 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
(4) 15H2SO4 đặc + 8Fe → 4Fe2(SO4)3 + 3H2S + 12H2O
Để nhận biết các dung dịch muối sunfat, người ta thường dùng thuốc thử là
Để nhận ra sự có mặt của ion SO42- trong dung dịch, người ta dùng dung dịch chứa ion Ba2+.
Thuốc thử dùng để nhận biết các dung dịch BaCl2, Ba(HCO3)2, NaOH là
Dãy các chất có thể dùng H2SO4 để phân biệt là BaCl2, Ba(HCO3)2, NaOH.
|
|
BaCl2 |
Ba(HCO3)2 |
NaOH |
|
H2SO4 |
Tạo kết tủa trắng |
Tạo kết tủa trắng và có khí bay ra |
Không hiện tượng |
Hòa tan hết 5,2 gam hỗn hợp hai kim loại A và B bằng dung dịch H2SO4 loãng, dư thu được dung dịch X và 3,36 lít khí H2 (đktc). Vậy lượng muối có trong dung dịch sau phản ứng là
Áp dụng nhanh công thức:
m muối \( = {m_{KL}} + {m_{SO_4^{2 - }}} = {m_{KL}} + 96.{n_{{H_2}}} = 5,2 + \frac{{3,36}}{{22,4}}.{\text{ }}96 = 19,6{\text{ }}gam\;\)
Hòa tan vừa hết 15,0 gam hỗn hợp các oxit Fe2O3, Al2O3, ZnO và MgO cần dùng 400 ml dung dịch H2SO4 0,8M. Tính khối lượng muối thu được sau phản ứng
Đổi 1 mol O2- lấy 1 mol SO42- khối lượng tăng = 96 – 16 = 80 gam
=> 0,32 mol O2- lấy 0,32 mol SO42- khối lượng tăng = 0,32.80 = 25,6 gam
=> mmuối = 15 + 25,6 = 40,6 gam
Để hòa tan vừa hết 14,4 gam hiđroxit của kim loại M cần 160 ml dung dịch H2SO4 1M. Xác định công thức của hiđroxit
Gọi công thức của hiđroxit là M(OH)n
2M(OH)n + nH2SO4 → M2(SO4)n + 2nH2O
Mol 0,32/n← 0,16
Ta có: \((M + 17n)\frac{{0,32}}{n} = 14,4 = > M = 28\)
Chọn n = 2 => M = 56 (Fe)
Vậy công thức cần tìm là Fe(OH)2
Khi hòa tan b gam oxit kim loại hóa trị II bằng một lượng vừa đủ dung dịch axit H2SO4 15,8% người ta thu được dung dịch muối có nồng độ 18,17%. Vậy kim loại hóa trị II là
Công thức oxit kim loại X là XO. Giả sử lấy 1 mol XO
XO + H2SO4 → XSO4 + H2O
1 mol → 1 mol → 1 mol
mH2SO4 = 98 gam => mdd H2SO4 = \(\frac{{98.100}}{{15,8}} = 620\,\,gam\)
=> mdd sau phản ứng = mdd trước phản ứng = mdd H2SO4 + mXO = 620 + X + 16 gam\( = > C{\% _{dd\,\,{\text{XS}}{O_4}}} = \frac{{(X + 96).100\% }}{{620 + X + 16}} = 18,17\% \,\, = > \,\,X = 24\)
=> X là Mg
Thêm từ từ dung dịch BaCl2 vào 300ml dung dịch Na2SO4 1M cho đến khi khối lượng kết tủa bắt đầu không đổi thì dừng lại, thấy hết 500 ml. Nồng độ mol/l của dung dịch BaCl2 là:
n Na2SO4 = 0,3 mol
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Mol 0,3← 0,3
CM (BaCl2) = 0,3: 0,5 = 0,6 M
Dung dịch nào sau đây làm quỳ tím chuyển sang màu đỏ?

Để pha loãng dung dịch H2SO4 đặc, người ta dùng cách nào sau đây ?
Để pha loãng dung dịch H2SO4 đặc, người ta rót từ từ dung dịch H2SO4 đặc vào nước, khuấy đều.
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là K, Mg, Fe, Zn.
Loại A vì Cu không phản ứng
Loại C vì Ag không phản ứng
Loại D vì Au và Pt không phản ứng
Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?
Dung dịch H2SO4 loãng tác dụng được với kim loại hoạt động (đứng trước H trong dãy điện hóa).
Mg, Al, Fe đứng trước H trong dãy điện hóa → A, B, C sai
Cu đứng sau H trong dãy điện hóa → D đúng
Cho những chất sau : CuO, Al2O3, FeO, Na2O. Chất tác dụng với dung dịch H2SO4 sinh ra dung dịch có màu xanh lam là
Dung dịch là hợp chất của Cu có màu xanh lam
CuO + H2SO4 → CuSO4 + H2O
MgCO3 tác dụng với dung dịch H2SO4 sinh ra
PTHH: MgCO3 + H2SO4 → MgSO4 + CO2 ↑ + H2O
CO2 + Ca(OH)2 → CaCO3 ↓+ H2O
Dung dịch H2SO4 loãng phản ứng được với tất cả các chất trong dãy nào sau đây ?
Dung dịch H2SO4 loãng phản ứng được với BaCl2, Na2CO3, FeS.
BaCl2 + Na2CO3 → BaCO3 + 2NaCl
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
FeS + H2SO4 → FeSO4 + H2S
Loại A vì Ag không phản ứng
Loại B vì NaCl không phản ứng
Loại C vì Cu không phản ứng
Chỉ dùng dung dịch H2SO4 có thể phân biệt được cặp kim loại nào sau đây?
|
|
Fe |
Cu |
|
H2SO4 |
Fe + H2SO4 → FeSO4 + H2 ↑ → Kim loại tan dần và sủi bọt khí không màu |
Không có hiện tượng gì |
Để nhận biết dung dịch H2SO4 và dung dịch HCl người ta dùng

Cho sơ đồ sau: X + Y → Na2SO4 + CO2 + H2O. Có bao nhiêu cặp X, Y thỏa mãn sơ đồ trên?
Y là H2SO4 hoặc muối NaHSO4 => X là muối cacbonat của Na => X là NaHCO3 hoặc Na2CO3
=> có 4 cặp X, Y thỏa mãn
Hòa tan m gam hỗn hợp Al và Fe vào dung dịch H2SO4 loãng dư. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào dung dịch X thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi thu được chất rắn Z gồm
$\left\{ \begin{gathered}Al \hfill \\F{\text{e}} \hfill \\ \end{gathered} \right. + {H_2}S{O_4} \to \left\{ \begin{gathered}A{l_2}{(S{O_4})_3} \hfill \\F{\text{e}}S{O_4} \hfill \\ \end{gathered} \right.$$\xrightarrow{{ + Ba{{(OH)}_2}dư}}$$ \downarrow Y:BaS{O_4},F{\text{e}}{(OH)_2}$$\xrightarrow{{kk,{t^o}}}Z:BaS{O_4},F{{\text{e}}_2}{O_3}$

