Phát biểu nào sau đây là sai?
A sai vì các kim loại kiềm có nhiệt độ nóng chảy giảm dần từ Li đến Cs (SGK Hóa 12NC trang 150)
B đúng
C đúng vì các kim loại kiềm ở nhóm IA có bán kính lớn nhất so với các kim loại khác cùng chu kì
D đúng vì do các electron tự do trong kim loại kiềm gây ra.
Phát biểu nào sau đây là đúng?
A đúng vì các kim loại kiềm thuộc nhóm IA
B sai vì Be và Mg có mạng tinh thể lục phương, Ca và Sr có mạng tinh thể lập phương tâm diện, Ba có mạng tinh thể lập phương tâm khối.
C sai vì Mg tác dụng chậm với nước ở nhiệt độ thường, Be không tác dụng với nước.
D sai vì trong nhóm IA, tính khử của các kim loại tăng dần từ Li đến Cs.
Kim loại nào sau đây tan hết trong nước dư ở nhiệt độ thường?
A đúng vì Na là kim loại kiềm nên tan hết trong nước.
Na + H2O → NaOH + $\dfrac{1}{2}$H2↑
B, C sai vì Fe, Mg tác dụng với H2O ở nhiệt độ cao.
D sai Al phản ứng với H2O nhưng phản ứng dừng ngay vì tạo màng Al(OH)3 ngăn cản phản ứng => Al không tan hết
Dung dịch nào dưới đây khi phản ứng hoàn toàn với dung dịch NaOH dư, thu được kết tủa trắng?
A đúng vì Ca(HCO3)2 + 2NaOH → CaCO3↓ trắng + Na2CO3 + 2H2O
B sai vì Fe(OH)3 kết tủa nâu đỏ: FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
C sai vì không thu được kết tủa: Al3+ + 4OH- dư → AlO2- + 2H2O
D sai vì không có kết tủa: H2SO4 + 2NaOH → Na2SO4 + H2O
Từ hai muối X và Y thực hiện các phản ứng sau:
X → X1 + CO2
X1 + H2O → X2
X2 + Y → X + Y1 + H 2O
X2 + 2Y → X + Y2 + H2O
Hai muối X, Y tương ứng là
X là CaCO3, Y là NaHCO3.
CaCO3 $\xrightarrow{{{t^ \circ }}}$ CaO + CO2↑
X X1
CaO + H2O $\xrightarrow{{}}$ Ca(OH)2
X2
Ca(OH)2 + NaHCO3 $\xrightarrow{{}}$ CaCO3 + NaOH + H2O
Y Y1
Ca(OH)2 + 2NaHCO3 $\xrightarrow{{}}$ CaCO3 + Na2CO3 + 2H2O
Y Y2
Thực hiện các thí nghiệm sau:
(I) Cho dung dịch NaCl vào dung dịch KOH.
(II) Cho dung dịch Na2CO3 vào dung dịch Ca(OH)2.
(III) Điện phân dung dịch NaCl với điện cực trơ, có màng ngăn.
(IV) Cho Cu(OH)2 vào dung dịch NaNO3.
(V) Sục khí NH3 vào dung dịch Na2CO3.
(VI) Cho dung dịch Na2SO4 vào dung dịch Ba(OH)2.
Các thí nghiệm đều điều chế được NaOH là:
(I),(IV),(V): Không phản ứng
(II) Na2CO3 + Ca(OH)2 $\xrightarrow{{}}$ 2NaOH + CaCO3↓
(III) 2NaCl + 2H2O $\xrightarrow[{mnx}]{{{}đpdd}}$ 2NaOH + H2↑ + Cl2↑
(VI) Na2SO4 + Ba(OH)2 $\xrightarrow{{}}$ 2NaOH + BaSO4↓
Một cốc nước có chứa các ion: Na+ (0,02 mol), Mg2+ (0,02 mol), Ca2+ (0,04 mol), Cl- (0,02 mol), HCO3- (0,10 mol) và SO42- (0,01 mol). Đun sôi cốc nước trên cho đến khi các phản ứng xảy ra hoàn toàn thì nước còn lại trong cốc
$2HCO_3^ - \xrightarrow{{{t^ \circ }}}CO_3^{2 - } + C{O_2} + {H_2}O$
0,1 → 0,05
${\text{C}}{{\text{a}}^{{\text{2 + }}}}{\text{ + CO}}_{\text{3}}^{{\text{2 - }}}\xrightarrow{{}}{\text{CaC}}{{\text{O}}_{\text{3}}} \downarrow $
${\text{M}}{{\text{g}}^{{\text{2 + }}}}{\text{ + CO}}_{\text{3}}^{{\text{2 - }}}\xrightarrow{{}}{\text{MgC}}{{\text{O}}_{\text{3}}} \downarrow $
${{\text{n}}_{{\text{C}}{{\text{a}}^{{\text{2 + }}}}}}{\text{ + }}{{\text{n}}_{{\text{M}}{{\text{g}}^{{\text{2 + }}}}}}{\text{ = 0,04 + 0,02 = 0,06}}\,\,{\text{ > }}\,{{\text{n}}_{{\text{CO}}_{\text{3}}^{{\text{2 - }}}}}$
→ Đun sôi cốc nước trên cho đến khi các phản ứng xảy ra hoàn toàn thì trong cốc còn $C{a^{2 + }},M{g^{2 + }},N{a^ + },C{l^ - },SO_4^{2 - }$ nên nước còn lại trong cốc là nước cứng vĩnh cửu.
Hấp thụ hoàn toàn 2,688 lít khí CO2 (ở đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mol/l, thu được 15,76 gam kết tủa. Giá trị của a là
${n_{C{O_2}}} > {n_{BaC{O_3}}} \to $ Có 2 muối được tạo thành $\xrightarrow{{BTNT.C}}{n_{Ba{{(HC{O_3})}_2}}} = \dfrac{{{n_{C{O_2}}} - {n_{BaC{O_3}}}}}{2} = \dfrac{{0,12 - 0,08}}{2} = 0,02\,mol$
$\xrightarrow{{BTNT.Ba}}{n_{Ba{{(OH)}_2}}} = {n_{BaC{O_3}}} + {n_{Ba{{(HC{O_3})}_2}}} = 0,08 + 0,02 = 0,1\,mol$
$\to {C_{M\,\,Ba{{(OH)}_2}}} = a = \frac{{0,1}}{{2,5}} = 0,04\,\,M$
Hấp thụ hoàn toàn 4,48 lít khí CO2 (ở đktc) vào 500 ml dung dịch gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra m gam kết tủa. Giá trị của m là
${n_{C{O_2}}} = 0,2\,mol;{n_{NaOH}} = 0,5.0,1 = 0,05\,mol\,;\,{n_{Ba{{(OH)}_2}}} = 0,5.0,2 = 0,1\,mol$
$\to {n_{O{H^ - }}} = {n_{NaOH}} + 2{n_{Ba{{(OH)}_2}}} = 0,05 + 2.0,1 = 0,25\,mol$
Do $2.{n_{C{O_2}}} > {n_{O{H^ - }}} > {n_{C{O_2}}} \to $ Có kết tủa $ \to {n_{CO_3^{2 - }}} = {n_{O{H^ - }}} - {n_{C{O_2}}} = 0,25 - 0,2 = 0,05\,mol < {n_{B{a^{2 + }}}}$
$ \to {n_{BaC{O_3}}} = {n_{CO_3^{2 - }}} = 0,05\,mol \to {m_{BaC{O_3}}} = 0,05.197 = 9,85\,gam$
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước, thu được 1,12 lít khí H2 (đktc) và dung dịch Y, trong đó có 20,52 gam Ba(OH)2. Hấp thụ hoàn toàn 6,72 lít khí CO2 (đktc) vào Y, thu được m gam kết tủa. Giá trị của m là
Quy đổi hỗn hợp X thành Na, Ba, O.
Gọi số mol Na, Ba, O lần lượt là a, b, c (mol) → 23a + 137b + 16c = 21,9 (1)
${n_{{H_2}}} = 0,05\,mol;\,{n_{Ba{{(OH)}_2}}} = 0,12\,mol$ → b = 0,12 (2)
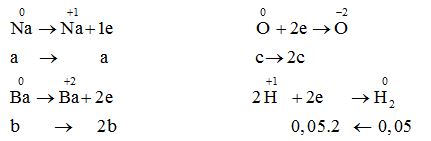
Áp dụng định luật bảo toàn electron a + 2b = 2c + 0,05.2 (3)
Từ (1),(2),(3) → a = 0,14; b = 0,12; c = 0,14
${n_{O{H^ - }}} = {n_{Na}} + 2{n_{Ba}} = 0,14 + 0,12.2 = 0,38\,mol$
${n_{C{O_2}}} = 0,3\,mol$
$T = \dfrac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}} = \dfrac{{0,38}}{{0,3}} \approx 1,23$
$C{O_2} + O{H^ - }\xrightarrow{{}}HCO_3^ - $
$C{O_2} + 2O{H^ - }\xrightarrow{{}}CO_3^{2 - } + {H_2}O$
${n_{CO_3^{2 - }}} = {n_{O{H^ - }}} - {n_{C{O_2}}} = 0,38 - 0,3 = 0,08\,mol < {n_{B{a^{2 + }}}} = 0,12 \to {n_{BaC{O_3}}} = {n_{CO_3^{2 - }}} = 0,08\,mol$
$ \to {m_{BaC{O_3}}} = 0,08.197 = 15,76\,gam$
Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 100 ml dung dịch gồm K2CO3 0,2M và KOH x mol/lít, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 (dư), thu được 11,82 gam kết tủa. Giá trị của x là
${n_{C{O_2}}} = \,0,1\,mol;\,{n_{{K_2}C{O_3}}} = 0,1.0,2 = 0,02\,mol\,;$
${n_{BaC{O_3} \downarrow }} = 0,06\,mol \to {n_{{K_2}C{O_3}(Y)}} = 0,06\,mol$
$ \to {n_{{K_2}C{O_3}\,(C{O_2} + KOH)}} = \,0,06 - 0,02 = 0,04\,mol < {n_{C{O_2}}}$
$\xrightarrow{{BTNT\,\,C}}{n_{KHC{O_3}}} = {n_{C{O_2}}} - {n_{{K_2}C{O_3}\,(C{O_2} + KOH)}} = 0,1 - 0,04 = 0,06\,mol$
$\xrightarrow{{BTNT\,\,K}}{n_{KOH}} = {n_{KHC{O_3}}} + 2{n_{{K_2}C{O_3}}} = 0,06 + 2.0,04 = 0,14\,mol \to {C_{M\,\,KOH}} = \,\dfrac{{0,14}}{{0,1}} = 1,4\,M$
Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là
${n_{CO_3^{2 - }}} = {n_{N{a_2}C{O_3}}} = 1,5.0,1 = 0,15\,mol;\,{n_{HCO_3^ - }} = {n_{KHC{O_3}}} = 0,1\,mol;{n_{{H^ + }}} = {n_{HCl}} = 0,2.1 = 0,2\,mol$
$CO_3^{2 - }\,\,\,\, + \,\,\,\,\,{H^ + }\xrightarrow{{}}HCO_3^ - $
0,15 → 0,15 → 0,15
$ \to {n_{HCO_3^ - }} = 0,1 + 0,15 = 0,25\,mol;\,{n_{{H^ + }}} = 0,2 - 0,15 = 0,05\,mol$
$HCO_3^ - + {H^ + }\xrightarrow{{}}C{O_2} \uparrow + {H_2}O$
0,25 0,05 → 0,05
$\Rightarrow {V_{C{O_2}}} = 0,05.22,4 = 1,12\,(l)$
Cho hỗn hợp K2CO3 và NaHCO3 (tỉ lệ mol 1 : 1) vào bình dung dịch Ba(HCO3)2 thu được kết tủa X và dung dịch Y. Thêm từ từ dung dịch HCl 0,5M vào bình đến khi không còn khí thoát ra thì hết 560 ml. Biết toàn bộ Y phản ứng vừa đủ với 200 ml dung dịch NaOH 1M. Khối lượng kết tủa X là
${n_{{K_2}C{O_3}}} = {n_{NaHC{O_3}}} = a\,mol;\,{n_{Ba{{(HC{O_3})}_2}}} = b\,mol \to \left\{ \begin{gathered}{n_{CO_3^{2 - }}} = a\,mol \hfill \\{n_{HCO_3^ - }} = (a + 2b)\,mol \hfill \\ \end{gathered} \right.$
$2{H^ + } + CO_3^{2 - }\xrightarrow{{}}C{O_2} \uparrow + {H_2}O$
${H^ + } + HCO_3^ - \xrightarrow{{}}C{O_2} \uparrow + {H_2}O$
${n_{HCl}} = 0,5.0,56 = 0,28\,mol \to 2a + (a + 2b) = 0,28\,\,\,(1)$
$HCO_3^ - + O{H^ - }\xrightarrow{{}}CO_3^{2 - } + {H_2}O$
$\,{n_{NaOH}} = 0,2.1 = 0,2\,mol \to a + 2b = 0,2\,\,\,(2)$
$ (1),(2) \to a = 0,04;\,\,b = 0,08$
${K_2}C{O_3} + Ba{(HC{O_3})_2}\xrightarrow{{}}BaC{O_3} \downarrow + 2KHC{O_3}$
0,04 0,08 → 0,04
${m_{BaC{O_3}}} = 0,04.197 = 7,88\,g$
Hòa tan hoàn toàn 2,45 gam hỗn hợp X gồm hai kim loại kiềm thổ vào 200 ml dung dịch HCl 1,25M, thu được dung dịch Y chứa các chất tan có nồng độ mol bằng nhau. Hai kim loại trong X là
Do trong Y các chất tan có nồng độ mol bằng nhau → Đặt số mol mỗi kim loại là a mol
A + 2HCl → ACl2 + H2↑
a 2a a
B + 2HCl → BCl2 + H2↑
a 2a a
nHCl = 0,2.1,25= 0,25 mol
TH1: HCl vừa đủ
4a = 0,25 → a = 0,0625 mol $ \to {M_A}{\text{ + }}{{\text{M}}_B}{\text{ = }}\frac{{{\text{2,45}}}}{{{\text{0,0625}}}}{\text{ = 39,2}}$ (lẻ) → loại
TH2: HCl dư " nHCl dư = a mol
4a + a = 5a = 0,25 → a = 0,05 mol $\to {M_A}{\text{ + }}{{\text{M}}_B}{\text{ = }}\frac{{{\text{2,45}}}}{{{\text{0,05}}}}{\text{ = 49}}$
=> MA = 9 và MB = 40 thỏa mãn → Be và Ca
Cho 7,1 gam hỗn hợp gồm một kim loại kiềm X và một kim loại kiềm thổ Y tác dụng hết với lượng dư dung dịch HCl loãng, thu được 5,6 lít khí (đktc). Kim loại X, Y là
2X + 2HCl → 2XCl + H2↑
Y + 2HCl → YCl2 + H2↑
${n_{{H_2}}} = 0,25\,mol$
=> ne nhận = ne cho = 2.nH2 = 2.0,25 = 0,5 mol
Ta có: $\left\{ \begin{gathered}M = \dfrac{m}{n} \hfill \\{n_{e\,cho}} = n.hóa\,trị \hfill \\ \end{gathered} \right. \to M = \dfrac{m}{{{n_{e.td}}}}. hóa\,trị$
Vì hh gồm 1 kim loại kiềm và 1 kim loại kiềm thổ => 1 < hóa trị trung bình < 2
$ \to \,14,2 < {\overline M _{hh}} < 28,4$
A sai vì $\,\overline M \,\, > 39$
B sai vì $\,\overline M \,\, < 9$
D sai vì $\,\overline M \,\, > 39$
→ Kim loại X, Y là Na, Mg
X là kim loại thuộc phân nhóm chính nhóm II (hay nhóm IIA). Cho 1,7 gam hỗn hợp gồm kim loại X và Zn tác dụng với lượng dư dung dịch HCl, sinh ra 0,672 lít khí H2 (đktc). Mặt khác, khi cho 1,9 gam X tác dụng với lượng dư dung dịch H2SO4 loãng, thì thể tích khí hiđro sinh ra chưa đến 1,12 lít (ở đktc). Kim loại X là:
$X + 2HCl\xrightarrow{{}}XC{l_2} + {H_2}$
${\text{Z}}n + 2HCl\xrightarrow{{}}ZnC{l_2} + {H_2}$
${n_{{H_2}}} = \dfrac{{0,672}}{{22,4}} = 0,03\,\,mol\,\, \to \,\,{n_X} + {n_{Zn}} = 0,03\,mol$
$ \to \overline M = \dfrac{{1,7}}{{0,03}} = 56,7\,\, \to \,\,{M_X} < 56,7\,\, \to \,$ loại A, C
$X + {H_2}S{O_4}\xrightarrow{{}}X{\text{S}}{O_4} + {H_2}$
${n_{{H_2}}} < \dfrac{{1,12}}{{22,4}} = 0,05\,\,mol\,\,\, \to \,\,{n_X} < 0,05\,\,mol$
${M_X} > \dfrac{{1,9}}{{0,05}} = 38\,\, \to \,\,$ loại D
$ \to \,\,38 < {M_X} < 56,7\,\,\, \to \,\,X$ là Ca
Hỗn hợp X gồm hai kim loại kiềm và một kim loại kiềm thổ. Hòa tan hoàn toàn 1,788 gam X vào nước, thu được dung dịch Y và 537,6 ml khí H2 (đktc). Dung dịch Z gồm H2SO4 và HCl, trong đó số mol của HCl gấp hai lần số mol của H2SO4. Trung hòa dung dịch Y bằng dung dịch Z tạo ra m gam hỗn hợp muối. Giá trị của m là
Bản chất của phan ứng kim loại với nước là: $2{{H}_{2}}O\to 2OH_{{}}^{-}+{{H}_{2}}$
→${n_{O{H^ - }}} = 2.{n_{{H_2}}} = 2.\dfrac{{0,5376}}{{22,4}} = 0,048\,mol$
$O{H^ - } + {H^ + } \to {H_2}O$
0,048 $\to $ 0,048
Vì số mol của HCl gấp hai lần số mol của H2SO4 nên gọi số mol H2SO4 là a(mol) thì số mol HCl là 2a (mol)
$\to {n_{{H^ + }}} = 2{n_{{H_2}S{O_4}}} + {n_{HCl}} = 2a + 2a = 4a\,mol$
$\to 4a = 0,048 \to a = 0,012\,$
$\to \left\{ \begin{gathered}{n_{{H_2}S{O_4}}} = 0,012\,mol \to {n_{SO_4^{2 - }}} = 0,012\,mol \hfill \\{n_{HCl}} = 2.0,012 = 0,024\,mol \to {n_{C{l^ - }}} = 0,024\,mol \hfill \\ \end{gathered} \right.$
$ \to m = {m_{hhX}} + {m_{SO_4^{2 - }}} + {m_{C{l^ - }}} = 1,788 + 0,012.96 + 0,024.35,5 = 3,792\,gam$
Cho 200 ml dung dịch Ba(OH)2 0,1M vào 300 ml dung dịch NaHCO3 0,1M, thu được dung dịch X và kết tủa Y. Cho từ từ dung dịch HCl 0,25M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là
${n_{Ba{{(OH)}_2}}} = 0,2.0,1 = 0,02\,mol \to {n_{O{H^ - }}} = 0,04mol$
${n_{NaHC{O_3}}} = 0,3.0,1 = 0,03\,mol \to {n_{HCO_3^ - }} = 0,03mol$
$\begin{align} & O{{H}^{-}}+HCO_{3}^{-}\to {{H}_{2}}O+CO_{3}^{2-} \\ & 0,04\,\,>\,\,\,0,03\,\,\,\,\,\,\,\,\,\,\,\to \,\,\,\,\,\,\,\,0,03 \\ \end{align}$
$\begin{align} & B{{a}^{2+}}+CO_{3}^{2-}\to BaC{{O}_{3}}\downarrow \\ & 0,02\,\,\,<\,\,0,03\,\,\to \,\,0,02 \\ \end{align}$
Dung dịch X có $\left\{ \begin{gathered}CO_3^{2 - }:0,01\,\,mol \hfill \\O{H^ - }\,\,\,:\,0,01\,\,mol \hfill \\ \end{gathered} \right.$
Khi thêm H+ vào dung dịch X, bắt đầu có khí thì dừng lại:
$\begin{align} & {{H}^{+}}\,\,\,\,+\,\,\,\,O{{H}^{-}}\to {{H}_{2}}O \\ & 0,01\,\leftarrow \,0,01 \\ \end{align}$
$\begin{align} & {{H}^{+}}\,\,\,+\,\,\,CO_{3}^{2-}\to HCO_{3}^{-} \\ & 0,01\leftarrow 0,01 \\ \end{align}$
$ \to \,{n_{{H^ + }}} = 0,01 + 0,01 = 0,02\,\,mol$
$ \to \,{V_{HCl}} = \dfrac{{0,02}}{{0,25}} = 0,08\,(l) = 80\,(ml)$
Nung 12,95 gam muối M(HCO3)2 ở nhiệt độ cao đến khối lượng không đổi, rồi cho toàn bộ khí CO2 thu được vào dung dịch Ca(OH)2 dư thấy có 10 gam kết tủa. M là:
nCaCO3 = 10 : 100 = 0,1 (mol)
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,1 ← 0,1 (mol)
M(HCO3)2 → MO + 2CO2↑ + H2O
0,05 ← 0,1 (mol)
Ta có: mM(HCO3)2 = 0,05. (M + 122) = 12,95
=> M = 137 (Ba)

