Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước, thu được 1,12 lít khí H2 (đktc) và dung dịch Y, trong đó có 20,52 gam Ba(OH)2. Hấp thụ hoàn toàn 6,72 lít khí CO2 (đktc) vào Y, thu được m gam kết tủa. Giá trị của m là
Trả lời bởi giáo viên
Quy đổi hỗn hợp X thành Na, Ba, O.
Gọi số mol Na, Ba, O lần lượt là a, b, c (mol) → 23a + 137b + 16c = 21,9 (1)
${n_{{H_2}}} = 0,05\,mol;\,{n_{Ba{{(OH)}_2}}} = 0,12\,mol$ → b = 0,12 (2)
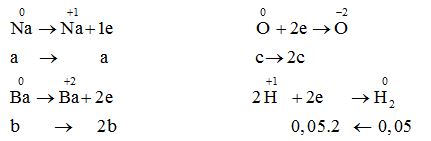
Áp dụng định luật bảo toàn electron a + 2b = 2c + 0,05.2 (3)
Từ (1),(2),(3) → a = 0,14; b = 0,12; c = 0,14
${n_{O{H^ - }}} = {n_{Na}} + 2{n_{Ba}} = 0,14 + 0,12.2 = 0,38\,mol$
${n_{C{O_2}}} = 0,3\,mol$
$T = \dfrac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}} = \dfrac{{0,38}}{{0,3}} \approx 1,23$
$C{O_2} + O{H^ - }\xrightarrow{{}}HCO_3^ - $
$C{O_2} + 2O{H^ - }\xrightarrow{{}}CO_3^{2 - } + {H_2}O$
${n_{CO_3^{2 - }}} = {n_{O{H^ - }}} - {n_{C{O_2}}} = 0,38 - 0,3 = 0,08\,mol < {n_{B{a^{2 + }}}} = 0,12 \to {n_{BaC{O_3}}} = {n_{CO_3^{2 - }}} = 0,08\,mol$
$ \to {m_{BaC{O_3}}} = 0,08.197 = 15,76\,gam$
Hướng dẫn giải:
Quy đổi hỗn hợp X thành Na, Ba, O.
Gọi số mol Na, Ba, O lần lượt là a, b, c (mol)
+) Khối lượng hh X => PT (1)
+) nBa = nBa(OH)2 → b (2)
+) Áp dụng định luật bảo toàn electron => PT (3)
Từ (1),(2),(3) → a; b; c
+) ${n_{O{H^ - }}} = {n_{Na}} + 2{n_{Ba}}$
+) Xét $T = \dfrac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}}$
$ + ){n_{CO_3^{2 - }}} = {n_{O{H^ - }}} - {n_{C{O_2}}}$
+) so sánh ${n_{CO_3^{2 - }}}$ và ${n_{B{a^{2 + }}}}$ => số mol kết tủa

