Từ Thí nghiệm 1, một bạn học sinh đã đưa ra các phát biểu sau:
(1) Sau bước 2, chưa có bọt khí thoát ra tại bề mặt của hai thanh kim loại.
(2) Sau bước 3, kim điện kế quay chứng tỏ xuất hiện dòng điện.
(3) Trong dây dẫn, dòng electron di chuyển từ anot sang catot.
(4) Sau bước 3, bọt khí thoát ra ở cả hai điện cực kẽm và đồng.
(5) Sau bước 3, thanh đồng bị ăn mòn điện hóa đồng thời với sự tạo thành dòng điện.
Số phát biểu đúng là
(1) Sau bước 2, chưa có bọt khí thoát ra tại bề mặt của hai thanh kim loại.
⟹ Sai vì ngay lúc đầu Zn phản ứng với H2SO4 theo phản ứng: Zn + H2SO4 → ZnSO4 + H2
(2) Sau bước 3, kim điện kế quay chứng tỏ xuất hiện dòng điện.
⟹ Đúng do có sự dịch chuyển electron trong dây dẫn
(3) Trong dây dẫn, dòng electron di chuyển từ anot sang catot.
⟹ Đúng
(4) Sau bước 3, bọt khí thoát ra ở cả hai điện cực kẽm và đồng.
⟹ Đúng
(5) Sau bước 3, thanh đồng bị ăn mòn điện hóa đồng thời với sự tạo thành dòng điện.
⟹ Sai, sau bước 3 thanh kẽm bị ăn mòn điện hóa
Vậy có 3 phát biểu đúng.
Cho các ion kim loại: Zn2+, Sn2+, Ni2+, Fe2+, Pb2+. Thứ tự tính oxi hoá giảm dần là
D đúng vì thứ tự cặp oxi hóa – khử là: $\dfrac{{Z{n^{2 + }}}}{{Zn}};\,\dfrac{{F{e^{2 + }}}}{{Fe}};\,\dfrac{{N{i^{2 + }}}}{{Ni}};\,\dfrac{{S{n^{2 + }}}}{{Sn}};\,\dfrac{{P{b^{2 + }}}}{{Pb}}$
→ Thứ tự tính oxi hóa giảm dần: Pb2+ > Sn2+ > Ni2+ > Fe2+ > Zn2+
Cho phương trình hóa học của phản ứng: 2Cr + 3Sn2+ $\xrightarrow{{}}$ 2Cr3+ + 3Sn↓.
Nhận xét nào sau đây về phản ứng trên là đúng?
C đúng vì Cr → Cr3+ + 3e; Sn2+ + 2e → Sn
Cho biết các phản ứng xảy ra sau :
2FeBr2 + Br2 $\xrightarrow{{}}$ 2FeBr3
2NaBr + Cl2 $\xrightarrow{{}}$ 2NaCl + Br2
Phát biểu đúng là:
2FeBr2 + Br2 $\xrightarrow{{}}$ 2FeBr3
→ Fe2+ : chất khử mạnh hơn $B{r^ - }$ , Br2 : chất oxi hóa mạnh hơn Fe3+ (1)
2NaBr + Cl2 $\xrightarrow{{}}$ 2NaCl + Br2
→$B{r^ - }$: chất khử mạnh hơn $C{l^ - }$ , Cl2 : chất oxi hóa mạnh hơn Br2 (2)
Từ (1) và (2) => Cl2 có tính oxi hóa mạnh hơn Fe3+
Cho các cặp oxi hóa - khử được sắp xếp theo thứ tự tăng dần tính oxi hóa của các ion kim loại: Al3+/Al; Fe2+/Fe; Sn2+/Sn; Cu2+/Cu. Tiến hành các thí nghiệm sau:
(a) Cho sắt vào dung dịch đồng(II) sunfat.
(b) Cho đồng vào dung dịch nhôm sunfat.
(c) Cho thiếc vào dung dịch đồng(II) sunfat.
(d) Cho thiếc vào dung dịch sắt(II) sunfat.
Trong các thí nghiệm trên, những thí nghiệm có xảy ra phản ứng là
Vì $\dfrac{{C{u^{2 + }}}}{{Cu}}$ đứng sau $\dfrac{{A{l^{3 + }}}}{{Al}}$ → (b) không phản ứng
Cặp $\dfrac{{S{n^{2 + }}}}{{Sn}}$ đứng sau $\dfrac{{F{e^{2 + }}}}{{Fe}}$→ (d) không phản ứng
→ A, B, D sai
C đúng vì (a) Fe + CuSO4 $\xrightarrow{{}}$ FeSO4 + Cu↓
(c) Sn + CuSO4 $\xrightarrow{{}}$ SnSO4 +Cu↓
Mệnh đề không đúng là:
Ta có dãy điện hóa kim loại
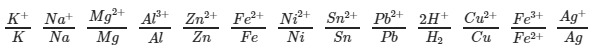
Theo chiều từ trái qua phải tính oxi hóa của ion kim loại tăng dần và tính khử của kim loại giảm dần. Do đó:
A. Đúng
B. Đúng. Theo quy tắc anpha: Fe + Cu2+ → Fe2+ + Cu
C. Sai
D. Đúng. Theo quy tắc anpha: 2Fe3+ + Cu → 2Fe2+ + Cu2+
X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y lần lượt là (biết thứ tự trong dãy thế điện hoá: Fe3+/Fe2+ đứng trước Ag+/Ag
X phản ứng được với dung dịch H2SO4 → X đứng trước H trong dãy điện hóa → Loại đáp án B vì có Cu, loại C vì có Ag
Y tác dụng được với Fe3+ → Loại đáp án D
Đáp án A: X là Fe, Y là Cu
Fe + H2SO4 loãng $\xrightarrow{{}}$ FeSO4 + H2↑
Cu + 2Fe(NO3)3 $\xrightarrow{{}}$ 2Fe(NO3)2 + Cu(NO3)2
Dãy gồm các kim loại đều tác dụng được với dung dịch HCl nhưng không tác dụng với dung dịch HNO3 đặc, nguội là:
A sai vì Cu không phản ứng với HCl, phản ứng với HNO3 đặc, nguội
B đúng vì Fe, Al, Cr đều phản ứng với HCl nhưng bị thụ động hóa trong HNO3 đặc nguội
C sai vì Ag, Cu không phản ứng với HCl và phản ứng với HNO3 đặc, nguội
D sai vì Mg phản ứng với HNO3 đặc, nguội
Cho bột Fe vào dung dịch gồm AgNO3 và Cu(NO3)2. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X gồm hai muối và chất rắn Y gồm hai kim loại. Hai muối trong X và hai kim loại trong Y lần lượt là:
Y gồm hai kim loại có tính khử yếu nhất: Ag, Cu
X gồm hai muối của kim loại có tính khử mạnh nhất: Fe(NO3)2, Cu(NO3)2, không có muối Fe(NO3)3 vì do có Cu
Fe + 2AgNO3 $\xrightarrow{{}}$ Fe(NO3)2 + 2Ag↓
Fe + Cu(NO3)2 dư $\xrightarrow{{}}$ Fe(NO3)2 + Cu↓
Cho hỗn hợp gồm Fe và Mg vào dung dịch AgNO3, khi các phản ứng xảy ra hoàn toàn thu được dung dịch X (gồm hai muối) và chất rắn Y (gồm hai kim loại). Hai muối trong X là
Chất rắn Y gồm hai kim loại có tính khử yếu nhất là: Ag, Fe
Dung dịch X gồm hai muối của kim loại có tính khử mạnh nhất, mà Fe dư
→ Hai muối trong X là Mg(NO3)2 và Fe(NO3)2.
Mg + 2Ag+ $\xrightarrow{{}}$ Mg2+ + 2Ag↓
Fe + 2Ag+ $\xrightarrow{{}}$ Fe2+ + 2Ag ↓
Kim loại M phản ứng được với: dung dịch HCl, dung dịch Cu(NO3)2, dung dịch HNO3 (đặc, nguội). Kim loại M là
M phản ứng với dung dịch HCl → loại D
M không phản ứng với dung dịch HNO3 đặc nguội → loại A và C
→ đáp án B đúng. Kim loại M là Zn
Phương trình phản ứng:
Zn + 2HCl $\xrightarrow{{}}$ ZnCl2 + H2↑
Zn + Cu(NO3)2 $\xrightarrow{{}}$ Zn(NO3)2 + Cu↓
Zn + 4HNO3 (đặc, nguội) $\xrightarrow{{}}$Zn(NO3)2 + 2NO2↑ + 2H2O
Cho hỗn hợp bột Al, Fe vào dung dịch chứa Cu(NO3)2 và AgNO3. Sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn gồm ba kim loại là:
Thứ tự các chất trong dãy điện hóa: $\dfrac{{A{l^{3 + }}}}{{Al}};\,\dfrac{{F{e^{2 + }}}}{{Fe}};\,\dfrac{{C{u^{2 + }}}}{{Cu}};\,\dfrac{{F{e^{3 + }}}}{{F{e^{2 + }}}};\,\dfrac{{A{g^ + }}}{{Ag}}$
Hỗn hợp rắn gồm 3 kim loại là 3 kim loại có tính khử yếu nhất: Ag, Cu, Fe
Cho kim loại M phản ứng với Cl2, thu được muối X. Cho M tác dụng với dung dịch HCl, thu được muối Y. Cho Cl2 tác dụng với dung dịch muối Y thu được muối X. Kim loại M là
Nhận xét: X và Y đều là 2 muối clorua của kim loại M → M có nhiều hóa trị → M là Fe
2Fe + 3Cl2 $\xrightarrow{{{t^ \circ }}}$ 2FeCl3
X
Fe + 2HCl $\xrightarrow{{}}$ FeCl2 + H2↑
Y
Cl2 + 2FeCl2 $\xrightarrow{{}}$ 2FeCl3
Y X
Nguyên tắc chung được dùng để điều chế kim loại là
Nguyên tắc: ${M^{n + }}\,\, + \,\,\,ne\,\,\,\xrightarrow{{}}\,\,\,M$
Phản ứng nào sau đây là phản ứng điều chế kim loại bằng phương pháp nhiệt luyện
A: Phương pháp thuỷ luyện
B: Phương pháp nhiệt luyện
C, D: Phương pháp điện phân
Dãy các kim loại đều có thể được điều chế bằng phương pháp điện phân dung dịch muối của chúng là:
Phương pháp điện phân dung dịch để điều chế các kim loại trung bình, yếu.
→ B sai vì loại Mg.
C sai vì loại Al
D sai vì loại Ba
FeSO4 + H2O $\xrightarrow{{đp{\text{dd}}}}$ Fe + $\dfrac{1}{2}$ O2 ↑+ H2SO4
CuSO4 + H2O $\xrightarrow{{đp{\text{dd}}}}$ Cu + $\dfrac{1}{2}$ O2 ↑+ H2SO4
2AgNO3 + H2O $\xrightarrow{{đp{\text{dd}}}}$ 2Ag + $\dfrac{1}{2}$ O2 ↑ + 2HNO3
Hai kim loại có thể được điều chế bằng phương pháp điện phân dung dịch là
Phương pháp điện phân dung dịch để điều chế các kim loại trung bình, yếu.
CuSO4 + H2O $\xrightarrow{{đp{\text{dd}}}}$ Cu↓ + $\dfrac{1}{2}$ O2 ↑+ H2SO4
2AgNO3 + H2O $\xrightarrow{{đp{\text{dd}}}}$ 2Ag↓ +$\dfrac{1}{2}$ O2 ↑ + 2HNO3
Cho khí CO (dư) đi vào ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm
CO khử được các oxit của kim loại đứng sau Al trong dãy hoạt động hoá học.
CO + Al2O3 → không phản ứng
CO + MgO → không phản ứng
4CO + Fe3O4 $\xrightarrow{{{t^ \circ }}}$ 3Fe + 4CO2
CO + CuO $\xrightarrow{{{t^ \circ }}}$ Cu + CO2
→ Hỗn hợp Y: Al2O3, MgO, Cu, Fe
Al2O3 + 2NaOH $\xrightarrow{{}}$ 2NaAlO2 + H2O
→ Hỗn hợp Z: MgO, Fe, Cu
Dãy gồm các kim loại được điều chế trong công nghiệp bằng phương pháp điện phân hợp chất nóng chảy của chúng là:
Phương pháp điện phân nóng chảy thường dùng để điều chế kim loại nhóm IA, IIA, Al
A sai vì loại Fe
C sai vì loại Cu
D sai vì loại Zn
NaCl $\xrightarrow{{đp{\text{nc}}}}$ Na + $\dfrac{1}{2}$ Cl2 ↑
CaCl2 $\xrightarrow{{đp{\text{nc}}}}$ Ca + Cl2 ↑
Al2O3 $\xrightarrow{{đp{\text{nc}}}}$ 2Al + $\dfrac{3}{2}$ O2 ↑
Dãy gồm các oxit đều bị Al khử ở nhiệt độ cao là:
Al khử được các oxit kim loại đứng sau Al trong dãy hoạt động hoá học: FeO, CuO, Fe3O4, SnO, Cr2O3, PbO
2Al + 3FeO $\xrightarrow{{{t^ \circ }}}$ Al2O3 + 3Fe
2Al + 3CuO $\xrightarrow{{{t^ \circ }}}$ Al2O3 + 3Cu
8Al + 3Fe3O4 $\xrightarrow{{{t^ \circ }}}$ 4Al2O3 + 9Fe
2Al + 3SnO $\xrightarrow{{{t^ \circ }}}$ Al2O3 + 3Sn
2Al + Cr2O3 $\xrightarrow{{{t^ \circ }}}$ Al2O3 + 2Cr

