Đốt môi sắt chứa kim loại M cháy ngoài không khí rồi đưa vào bình đựng khí CO2 như hình vẽ, thấy kim loại M vẫn tiếp tục cháy trong bình đựng CO2
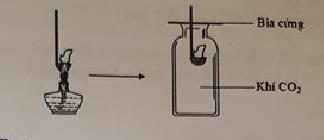
Kim loại M là
Kim loại M là Mg vì 2Mg + O2 \(\xrightarrow{{{t^o}}}\) 2MgO
Mg + CO2 \(\xrightarrow{{{t^o}}}\) MgO + C
Kim loại kiềm thuộc nhóm IA trong bảng tuần hoàn. Kim loại thuộc nhóm IA được gọi là kim loại kiềm vì hiđroxit của chúng có tính chất kiềm mạnh. Các kim loại kiềm có màu trắng bạc và có ánh kim rất mạnh. Ánh kim mất nhanh chóng khi kim loại tiếp xúc với không khí do bị oxi hóa.
Một số hợp chất của kim loại kiềm có nhiều ứng dụng quan trọng như natri hiđrocacbonat dùng trong y học, công nghệ dược phẩm, chế tạo nước giải khát,... Natri cacbonat dùng trong công nghiệp thủy tinh, xà phòng, giấy,... Hợp chất của Na, K rất cần thiết đối với con người, động vật và thực vật. Kali là một trong 3 nguyên tố cần thường xuyên cung cấp cho đất để tăng năng suất vụ mùa. Natri cần thiết cho con người và động vật giống như kali cần thiết cho cây trồng.
Điện phân nóng chảy hoàn toàn 4,25 g muối clorua của một kim loại kiềm thu được 1,568 lít khí tại anot (đo ở 109,2°C và 1 atm). (Biết Li = 7; Na = 23; K = 39; Rb = 85). Kim loại kiềm đó là
Gọi công thức của muối clorua là MCl
Bước 1: Tính số mol Cl2
Ta có: \({n_{C{l_2}}} = \dfrac{{1.1,568}}{{0,082.(109,2 + 273)}} = 0,05\) (mol).
Bước 2: Tính MCl theo PTHH
PTHH: 2MCl \(\xrightarrow{{{t^0}}}\) 2M + Cl2
Theo PTHH ⟹ \({n_{MCl}} = 2{n_{C{l_2}}} = 0,1\) (mol).
Bước 3: Xác định M
⟹ \({M_{MCl}} = \dfrac{{4,25}}{{0,1}} = 42,5\)
⟹ \({M_M} = 42,5 - 35,5 = 7\) (Li).
Vậy M là Li.
Kim loại kiềm thuộc nhóm IA trong bảng tuần hoàn. Kim loại thuộc nhóm IA được gọi là kim loại kiềm vì hiđroxit của chúng có tính chất kiềm mạnh. Các kim loại kiềm có màu trắng bạc và có ánh kim rất mạnh. Ánh kim mất nhanh chóng khi kim loại tiếp xúc với không khí do bị oxi hóa.
Một số hợp chất của kim loại kiềm có nhiều ứng dụng quan trọng như natri hiđrocacbonat dùng trong y học, công nghệ dược phẩm, chế tạo nước giải khát,... Natri cacbonat dùng trong công nghiệp thủy tinh, xà phòng, giấy,... Hợp chất của Na, K rất cần thiết đối với con người, động vật và thực vật. Kali là một trong 3 nguyên tố cần thường xuyên cung cấp cho đất để tăng năng suất vụ mùa. Natri cần thiết cho con người và động vật giống như kali cần thiết cho cây trồng.
Để có được những chiếc bánh to và đẹp, một cơ sở sản xuất bánh bao thường trộn một ít bột natri hiđrocacbonat nhào với bột mì làm thành nhiều chiếc bánh nhỏ, sau đó cho bánh vào lò nung ở nhiệt độ cao. Sau một thời gian, thu được những chiếc bánh bao to, tròn nóng hổi rất thơm ngon. Phương trình hóa học giải thích cho việc làm đó là
Ở nhiệt độ cao, NaHCO3 bị nhiệt phân tạo ra CO2 khiến cho bánh trở nên phồng xốp hơn.
PTHH: 2NaHCO3 \(\xrightarrow{{{t^0}}}\) Na2CO3 + CO2 + H2O.
Kim loại kiềm thuộc nhóm IA trong bảng tuần hoàn. Kim loại thuộc nhóm IA được gọi là kim loại kiềm vì hiđroxit của chúng có tính chất kiềm mạnh. Các kim loại kiềm có màu trắng bạc và có ánh kim rất mạnh. Ánh kim mất nhanh chóng khi kim loại tiếp xúc với không khí do bị oxi hóa.
Một số hợp chất của kim loại kiềm có nhiều ứng dụng quan trọng như natri hiđrocacbonat dùng trong y học, công nghệ dược phẩm, chế tạo nước giải khát,... Natri cacbonat dùng trong công nghiệp thủy tinh, xà phòng, giấy,... Hợp chất của Na, K rất cần thiết đối với con người, động vật và thực vật. Kali là một trong 3 nguyên tố cần thường xuyên cung cấp cho đất để tăng năng suất vụ mùa. Natri cần thiết cho con người và động vật giống như kali cần thiết cho cây trồng.
Nhận định nào sau đây sai?
B sai vì các kim loại kiềm có cấu trúc mạng tinh thể lập phương tâm khối.
Vôi tôi là một dạng tinh thể không màu hay bột màu trắng, và thu được khi cho canxi oxit (vôi sống) tác dụng với nước. Nó cũng có thể kết tủa xuống khi trộn dung dịch chứa canxi clorua với dung dịch natri hiđroxit. Tên gọi dân gian của canxi hiđroxit là vôi tôi hay đơn giản chỉ là vôi. Dung dịch chứa canxi hiđroxit gọi chung là nước vôi và có tính bazơ trung bình – mạnh.
Trong quá trình sản xuất vôi xảy ra phản ứng sau:
CaCO3(r) ⇄ CaO(r) + CO2(k) \(\Delta H > 0\)
Khi bị ong, kiến đốt để đỡ đau, người ta thường bôi vôi vào vết đốt. Phương trình hóa học giải thích cho việc làm đó là
Bước 1: Xác định loại nọc độc của ong là gì?
Trong nọc độc của ong, kiến chứa axit cacboxylic là axit fomic (HCOOH). Để đỡ đau, người ta sẽ bôi vôi (mang tính bazơ) vào vết đốt để trung hòa axit trong nọc độc của ong, kiến.
Bước 2: Viết pt
PTHH: Ca(OH)2 + 2HCOOH → (HCOO)2Ca + 2H2O.
Vôi tôi là một dạng tinh thể không màu hay bột màu trắng, và thu được khi cho canxi oxit (vôi sống) tác dụng với nước. Nó cũng có thể kết tủa xuống khi trộn dung dịch chứa canxi clorua với dung dịch natri hiđroxit. Tên gọi dân gian của canxi hiđroxit là vôi tôi hay đơn giản chỉ là vôi. Dung dịch chứa canxi hiđroxit gọi chung là nước vôi và có tính bazơ trung bình – mạnh.
Trong quá trình sản xuất vôi xảy ra phản ứng sau:
CaCO3(r) ⇄ CaO(r) + CO2(k) \(\Delta H > 0\)
Người ta nung 1 tấn đá vôi chứa 10% tạp chất thì có thể thu được bao nhiêu tấn vôi sống để sản xuất vôi tôi nếu hiệu suất phản ứng là 95% (biết H = 1; C = 12; O = 16; Ca = 40)?
Bước 1: Tính khối lượng thực tế của CaCO3 trong đá vôi
m CaCO3 (trong đá vôi) = mđá vôi . 90% = 0,90 (tấn)
Bước 2: Tính khối lượng CaO thu được theo lý thuyết
PTHH: CaCO3 ⇄ CaO + CO2
Theo PTHH : 100 56 44 (tấn)
Theo đề bài : 0,90 → x (tấn)
⟹ \({m_{CaO(LT)}} = x = \dfrac{{0,90.56}}{{100}} = 0,5040\) (tấn)
Bước 3: Tính khối lượng CaO thực tế thu được
\(H = \dfrac{{{m_{CaO(TT)}}}}{{{m_{CaO(LT)}}}}.100\% \)⟹ \({m_{CaO(TT)}} = \dfrac{{H.{m_{CaO(LT)}}}}{{100\% }} = \dfrac{{95\% .0,5040}}{{100\% }} = 0,4788\) (tấn)
Vậy khối lượng vôi sống thu được là 0,4788 (tấn).
Vôi tôi là một dạng tinh thể không màu hay bột màu trắng, và thu được khi cho canxi oxit (vôi sống) tác dụng với nước. Nó cũng có thể kết tủa xuống khi trộn dung dịch chứa canxi clorua với dung dịch natri hiđroxit. Tên gọi dân gian của canxi hiđroxit là vôi tôi hay đơn giản chỉ là vôi. Dung dịch chứa canxi hiđroxit gọi chung là nước vôi và có tính bazơ trung bình – mạnh.
Trong quá trình sản xuất vôi xảy ra phản ứng sau:
CaCO3(r) ⇄ CaO(r) + CO2(k) \(\Delta H > 0\)
Để tăng hiệu suất tạo thành vôi tôi, người ta có thể
Để tăng hiệu suất của quá trình tạo thành vôi tôi (CaO) thì cân bằng phải chuyển dịch theo chiều tạo ra CaO nhiều hơn, tức là theo chiều thuận.
∆H > 0 nên phản ứng thuận là phản ứng thu nhiệt.
⟹ Muốn cân bằng chuyển dịch theo chiều thuận thì phải tăng nhiệt độ.
Sau phản ứng tạo ra CaO và CO2 (lượng CaO và CO2 sau phản ứng nhiều hơn trước phản ứng).
⟹ Muốn cân bằng chuyển dịch theo chiều thuận thì phải lấy bớt ra lượng khí CO2 hoặc CaO tạo ra sau phản ứng.
Sau phản ứng tạo ra CO2 làm tăng áp suất của hệ.
⟹ Muốn cân bằng chuyển dịch theo chiều thuận thì phải làm giảm áp suất của hệ.
Vậy đáp án đúng là đáp án B.
Mưa axit - hậu quả ô nhiễm khói, bụi được phát hiện lần đầu tiên vào năm 1948 tại Thụy Điển. Ngay từ những năm 50 của thế kỷ 20, hiện tượng này đã bắt đầu được nghiên cứu.
Phát hiện tại Đức năm 1984 cho thấy, hơn một nửa cánh rừng của miền Tây nước này đã và đang ở vào thời kỳ bị phá hủy với những mức độ khác nhau. Hay như ở Thụy Sĩ bị thiệt hại khoảng 12 triệu cây (chiếm 14% diện tích rừng), trong khi đó ở Hà Lan diện tích rừng bị phá hủy lên đến 40%.
Mưa axit gây phá hủy rộng lớn cho rừng cây khắp nơi trên thế giới, đặc biệt là những vùng công nghiệp hóa như châu Âu và Bắc Mỹ. Mưa axit xảy ra chủ yếu do sự phóng thích SO2 từ sự nung chảy quặng sunfua và sự đốt cháy các nhiên liệu. Trong không khí, một phần SO2 chuyển thành SO3 được hấp thụ trong nước mưa chuyển thành axit sunfuric.
Hình ảnh sau đây là những bức tượng Caryalid (tượng hình phụ nữ thay cho cột) được xây dựng ở Acropolis tại Athen hơn 2500 năm trước. Các bức tượng này được tạc từ một loại đá gọi là đá cẩm thạch. Đá cẩm thạch được tạo thành từ canxi cacbonat. Năm 1980, những tượng nguyên bản đã được chuyển vào trong bảo tàng Acropolis và được thay thế bởi bản sao đúng như thật. Những bức tượng nguyên bản đã bị ăn mòn bởi mưa axit.

Phản ứng hóa học nào đã xảy ra trong hiện tượng ăn mòn các bức tượng Caryatid do mưa axit?
Phản ứng hóa học nào đã xảy ra trong hiện tượng ăn mòn các bức tượng Caryatid do mưa axit là
PTHH: CaCO3 + 2H+ ⟶ Ca2+ + CO2 ↑ + H2O.
Mưa axit - hậu quả ô nhiễm khói, bụi được phát hiện lần đầu tiên vào năm 1948 tại Thụy Điển. Ngay từ những năm 50 của thế kỷ 20, hiện tượng này đã bắt đầu được nghiên cứu.
Phát hiện tại Đức năm 1984 cho thấy, hơn một nửa cánh rừng của miền Tây nước này đã và đang ở vào thời kỳ bị phá hủy với những mức độ khác nhau. Hay như ở Thụy Sĩ bị thiệt hại khoảng 12 triệu cây (chiếm 14% diện tích rừng), trong khi đó ở Hà Lan diện tích rừng bị phá hủy lên đến 40%.
Mưa axit gây phá hủy rộng lớn cho rừng cây khắp nơi trên thế giới, đặc biệt là những vùng công nghiệp hóa như châu Âu và Bắc Mỹ. Mưa axit xảy ra chủ yếu do sự phóng thích SO2 từ sự nung chảy quặng sunfua và sự đốt cháy các nhiên liệu. Trong không khí, một phần SO2 chuyển thành SO3 được hấp thụ trong nước mưa chuyển thành axit sunfuric.
Hình ảnh sau đây là những bức tượng Caryalid (tượng hình phụ nữ thay cho cột) được xây dựng ở Acropolis tại Athen hơn 2500 năm trước. Các bức tượng này được tạc từ một loại đá gọi là đá cẩm thạch. Đá cẩm thạch được tạo thành từ canxi cacbonat. Năm 1980, những tượng nguyên bản đã được chuyển vào trong bảo tàng Acropolis và được thay thế bởi bản sao đúng như thật. Những bức tượng nguyên bản đã bị ăn mòn bởi mưa axit.

Giả sử rằng cứ 50000 phân tử nước (chứa trong 4,50.104 lít nước của một trận mưa) hấp thụ một phân tử SO3 và toàn bộ lượng axit sunfuric được tạo ra đều tan hết trong lượng mưa nêu trên. Cho H = 1; O = 16; S = 32; NA = 6,02.1023 và khối lượng riêng của nước là 1,00 g.ml-1. Nồng độ mol/l của axit sunfuric trong nước mưa là
- Ta có: \({m_{{H_2}O}} = V.D = 4,{5.10^4}{.10^3} = 4,{5.10^7}(g) \Rightarrow {n_{{H_2}O}} = \dfrac{{4,{{5.10}^7}}}{{18}} = 2,{5.10^6}(mol)\)
- Cứ 50000 phân tử nước (chứa trong 4,50.104 lít nước của một trận mưa) hấp thụ một phân tử SO3
⟹ \({n_{S{O_3}}} = \dfrac{{{n_{{H_2}O}}}}{{{{5.10}^4}}} = \dfrac{{2,{{5.10}^6}}}{{{{5.10}^4}}} = 50(mol)\)
- Bảo toàn nguyên tố S ⟹ \({n_{{H_2}S{O_4}}} = {n_{S{O_3}}} = 50(mol)\)
Vậy nồng độ mol/l của axit sunfuric trong nước mưa là \({C_{M({H_2}S{O_4})}} = \dfrac{{{n_{{H_2}S{O_4}}}}}{{4,{{5.10}^4}}} = \dfrac{{50}}{{4,{{5.10}^4}}} = 0,0011(mol/l)\)
Mưa axit - hậu quả ô nhiễm khói, bụi được phát hiện lần đầu tiên vào năm 1948 tại Thụy Điển. Ngay từ những năm 50 của thế kỷ 20, hiện tượng này đã bắt đầu được nghiên cứu.
Phát hiện tại Đức năm 1984 cho thấy, hơn một nửa cánh rừng của miền Tây nước này đã và đang ở vào thời kỳ bị phá hủy với những mức độ khác nhau. Hay như ở Thụy Sĩ bị thiệt hại khoảng 12 triệu cây (chiếm 14% diện tích rừng), trong khi đó ở Hà Lan diện tích rừng bị phá hủy lên đến 40%.
Mưa axit gây phá hủy rộng lớn cho rừng cây khắp nơi trên thế giới, đặc biệt là những vùng công nghiệp hóa như châu Âu và Bắc Mỹ. Mưa axit xảy ra chủ yếu do sự phóng thích SO2 từ sự nung chảy quặng sunfua và sự đốt cháy các nhiên liệu. Trong không khí, một phần SO2 chuyển thành SO3 được hấp thụ trong nước mưa chuyển thành axit sunfuric.
Hình ảnh sau đây là những bức tượng Caryalid (tượng hình phụ nữ thay cho cột) được xây dựng ở Acropolis tại Athen hơn 2500 năm trước. Các bức tượng này được tạc từ một loại đá gọi là đá cẩm thạch. Đá cẩm thạch được tạo thành từ canxi cacbonat. Năm 1980, những tượng nguyên bản đã được chuyển vào trong bảo tàng Acropolis và được thay thế bởi bản sao đúng như thật. Những bức tượng nguyên bản đã bị ăn mòn bởi mưa axit.

Để xác định hàm lượng NO3- trong 200 ml nước mưa, người ta dùng Cu và H2SO4 loãng, thấy lượng đồng cần sử dụng là 1,92 mg. Biết nồng độ ion NO3- tối đa cho phép trong nước mưa dùng để ăn uống là 9 ppm (mg/l). Cho H = 1; N = 14; O = 16; S = 32; Cu = 64. Nhận định nào sau đây đúng?
- PTHH: 3Cu + 8H+ + 2NO3- ⟶ 3Cu2+ + 2NO + 4H2O
- Theo PTHH ⟹ \({n_{N{O_3}^ - }} = \dfrac{2}{3}{n_{Cu}} = {2.10^{ - 5}}(mol) \Rightarrow {\rm{[}}N{O_3}^ - {\rm{]}} = \dfrac{{{{2.10}^{ - 5}}{{.62.10}^3}}}{{0,2}} = 6,2(mg/l)\)
- Nhận thấy [NO3-] = 6,2 ppm < 9 ppm ⟹ Lượng nước mưa này có nồng độ ion NO3- trong khoảng cho phép và có thể sử dụng được ⟹ B đúng.
MgCO3 là chất bột mà các vận động viên cử tạ và thể dục dụng cụ thường xoa vào tay trước khi thi đấu để làm thấm bớt mồ hôi tay. CaCO3 có trong đá ở khắp nơi trên thế giới, CaCO3 là thành phần chính của các loài vỏ ốc, vỏ trứng chứa tới 95% khối lượng CaCO3. Đô-lô-mit là quặng chứa cả MgCO3 và CaCO3 có công thức MgCO3.CaCO3. Từ quặng đô-lô-mit người ta điều chế được 2 kim loại Mg và Ca (riêng rẽ) bằng cách sử dụng hai hóa chất X, Y cùng các thiết bị như thiết bị nung và điện phân… Hai chất X, Y thường dùng là:
- Nung quặng đô-lô-mit, thu được MgO và CaO:
$CaC{O_3}\,\xrightarrow{{{t^o}}}\,CaO\, + \,C{O_2} \uparrow $
$MgC{O_3}\,\xrightarrow{{{t^o}}}\,MgO\, + \,C{O_2} \uparrow $
- Hòa tan hỗn hợp MgO, CaO vào nước, CaO tan tạo huyền phù và MgO không tan:
CaO + H2O → Ca(OH)2
- Cho dung Ca(OH)2 và MgO tác dụng với dung dịch HCl, thu được CaCl2, MgCl2:
Ca(OH)2 + 2HCl → CaCl2 + H2O
MgO + 2HCl → MgCl2 + H2O
- Điện phân nóng chảy 2 chất CaCl2 và MgCl2 thu được Ca và Mg:
\[CaC{l_2}\,\xrightarrow{{dpnc}}\,Ca\, + \,C{l_2} \uparrow \]
\[MgC{l_2}\,\xrightarrow{{dpnc}}\,Mg\, + \,C{l_2} \uparrow \]
⟹ Vậy 2 chất X, Y là H2O và HCl.
Cho 3 gam Mg tác dụng hết với dung dịch HNO3 dư, thu được dung dịch X không chứa NH4+ và 1,12 lit khí Y gồm NO và N2O (đktc). Cho Cu dư vào dung dịch X rồi nhỏ từ từ dung dịch H2SO4 1,25M và cho đến khi kết thúc các phản ứng thu được 6,272 lit (đktc) hỗn hợp khí Z gồm NO và NO2. Thể tích H2SO4 đã dùng là 380 ml. Tính tỉ khối hỗn hợp Z so với hỗn hợp Y.
Bước 1: Tính số mol NO, N2O trong Y
Gọi a, b là số mol NO và N2O trong Y
⟹ a + b = 0,05 và 3a + 8b = (2.3)/24
⟹ a = 0,03 và = 0,02
⟹ MY = 35,6
Bước 2: Tính số mol HNO3
Dung dịch X chứa Mg(NO3)2 (0,125 mol) và HNO3 dư (x mol)
Bảo toàn N ⟹ nZ = 0,125.2 + x = 0,28
⟹ x = 0,03
Bước 3: Tính số mol của NO và NO2 trong Z
Gọi u, v là số mol của NO và NO2 trong Z
⟹ u + v = 0,28
Tổng nH+ = 4u + 2v = 0,03 + 0,95
⟹ u = 0,21 và v = 0,07
⟹ MZ = 34 ⟹ dZ/Y = MZ/Y = 85/89
So với kim loại kiềm, độ cứng của các kim loại kiềm thổ
So với kim loại kiềm, độ cứng của các kim loại kiềm thổ cao hơn
Đâu không phải là tính chất vật lý của kim loại kiềm thổ?
Kim loại kiềm thổ có nhiệt độ nóng chảy và nhiệt độ sôi thấp
Phương pháp dùng để điều chế kim loại kiềm thổ là
Phương pháp dùng để điều chế kim loại kiềm thổ là điện phân nóng chảy

