Cho 5,4 gam Al tác dụng với 100 ml dung dịch X chứa Fe(NO3)3 2M và Cu(NO3)2 1M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là :
Xét: ne Al cho tối đa = 0,2.3 = 0,6 mol
ne Fe3+ nhận tạo Fe2+ = 0,2.1 = 0,2 mol
ne Cu2+ nhận tạo Cu = 0,1.2 = 0,2 mol
ne Fe2+ nhận tạo Fe = 0,2.2 = 0,4 mol
Ta thấy :
ne Fe3+ nhận tạo Fe2+ + ne Cu2+ nhận tạo Cu< ne Al cho tối đa< ne Fe3+ nhận tạo Fe2+ + ne Cu2+ nhận tạo Cu +ne Fe2+ nhận tạo Fe
được biểu diễn theo sơ đồ sau:
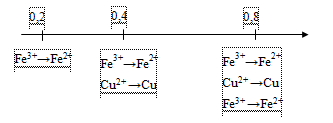
=> Cu(NO3)2 phản ứng hết; Fe(NO3)3 phản ứng tạo thành Fe và Fe(NO3)2
=> ne nhận tạo Fe = 0, 6– 0,2 – 0,2 = 0,2 mol => nFe = 0,2 / 2 = 0,1mol
=> m = 0,1.64 + 0,1.56 = 12gam
Cho 2,8 gam bột sắt vào 100 ml dung dịch gồm AgNO3 1,5M và Cu(NO3)2 0,2M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m là
nFe = 0,05 mol; nAgNO3 = 0,15 mol; nCu(NO3)2 = 0,02 mol
Ta thấy : ne Fe cho tối đa = 0,05.3 = 0,15 mol = ne Ag+ nhận tối đa
=>Fe phản ứng hết với Ag, tạo thành Fe3+ và Ag
=> nAg = nAgNO3 = 0,15 mol => m = 0,15.108 = 16,2 gam
Cho 8,4 gam bột sắt vào 100 ml dung dịch gồm AgNO3 2M và Cu(NO3)2 1M; khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m là
nFe = 0,15 mol; nAgNO3 = 0,2mol; nCu(NO3)2 = 0,1 mol
Nhận xét: 2nFe> nAg => không xảy ra phản ứng Ag+ + Fe2+ → Ag + Fe3+ => Fe tạo muối Fe2+
ne Fe cho tối đa = 0,15.2 = 0,3 mol
ne Ag+ nhận tối đa = 0,2 mol
ne Cu2+ nhận tối đa = 0,1.2 = 0,2 mol
Ta thấy : 0,2 < ne Fe cho tối đa< 0,2 + 0,2
=> Ag+ phản ứng hết, Cu2+ phản ứng 1 phần
=> ne Cu2+ nhận tạo Cu = 0,3 – 0,2 = 0,1 mol => nCu = 0,05 mol
=> m = mAg + mCu = 0,2.108 + 0,05.64 = 24,8gam
Cho a gam Al vào 100 ml dung dịch FeSO4 0,2M và CuSO4 0,4M thu được 1,92 gam chất rắn. Giá trị của a là
nFeSO4 = 0,02 mol; nCuSO4 = 0,04 mol → nFe2+ = 0,02 mol; nCu2+ = 0,04 mol
Mốc 1: phản ứng vừa đủ với Cu2+ => m1 = 0,04.64 = 2,56 gam > 1,92 gam
=> Al phản ứng hết với Cu2+(Cu2+ còn dư và Fe2+ chưa phản ứng với Al)
=> nAl =2/3 nCu = 1,92 / 64 . 2/3 = 0,02 mol => m = 0,54 gam
Cho a gam Al vào 100 ml dung dịch Fe(NO3)2 0,2M và Cu(NO3)2 0,4M thu được 3,12 gam chất rắn. Giá trị của a là?
nFe(NO3)2 = 0,02 mol; nCu(NO3)2 = 0,04 mol
Mốc 1: phản ứng vừa đủ với Cu2+ => m1 = 0,04.64 = 2,56 gam < 3,12 gam
Mốc 2: Phản ứng với Cu2+và Al3+=> m2 = 0,04.64 + 0,02.56 = 3,68 > 3,12
=>Cu2+phản ứng hết, Al3+phản ứng 1 phần; chất rắn sau phản ứng gồm Cu (0,04 mol) và Fe
mFe sinh ra = 3,12 – 0,04.64 = 0,56 gam => nFe = 0,01 mol
Bảo toàn e: 3nAl = 2nCu + 2nFe => nAl = (2.0,04 +0,01.2) / 3 = 1/30 mol
=> m = 0,9 gam
Cho a gam Al vào 100 ml dung dịch FeSO4 0,2M và CuSO4 0,4M thu được 3,95 gam chất rắn. Giá trị của a là
nFe(NO3)2 = 0,02 mol; nCu(NO3)2 = 0,04 mol=> nFe2+ = 0,02 mol; nCu2+ = 0,04 mol
Mốc 1: phản ứng vừa đủ với Cu2+ => m1 = 0,04.64 = 2,56 gam < 3,95 gam
Mốc 2: Phản ứng với Cu2+ và Al3+ => m2 = 0,04.64 + 0,02.56 = 3,68 < 3,95 gam
=> cả Cu2+ và Fe2+ phản ứng hết, Al dư => chất rắn sau phản ứng gồm Cu(0,04 mol), Fe (0,02 mol) và Al
+) mAl dư = mchất rắn – mFe - mCu
Bảo toàn e: 3nAl phản ứng = 2nFe + 2nCu
=> nAlphản ứng = (2.0,02 + 0,04.2) / 3 = 0,04 mol
=> a = mAl dư + mAl phản ứng = 0,04.27 + 0,27 = 1,35
Cho thanh sắt Fe vào dung dịch X chứa 0,15 mol AgNO3 và 0,2 mol Cu(NO3)2. Khi thấy thanh kim loại tăng lên 9,6 gam thì dừng lại. Tính khối lượng sắt tham gia phản ứng
nAg+ = 0,15 mol; nCu2+ = 0,2 mol
Nếu Ag+ phản ứng hết :
Fe + 2Ag+ → Fe2+ + 2Ag
0,075← 0,15 → 0,75 => mtăng = 0,15.108 – 0,075.56 = 12 > 9,6
=> Ag+ chưa phản ứng hết; Cu2+ chưa phản ứng
Gọi nAg+ phản ứng = x mol
mtăng = 108x – 0,5x.56 = 9,6 => x = 0,12 mol
=> khối lượng sắt phản ứng là mFe = 56.0,06 = 3,36 gam
Cho thanh sắt Fe vào dung dịch X chứa 0,15 mol AgNO3 và 0,2 mol Cu(NO3)2. Khi thấy thanh kim loại tăng lên 12,8 gam thì dừng lại. Tính khối lượng kim loại bám vào thanh sắt
nAg+ = 0,1 mol; nCu2+ = 0,2 mol
Nếu Ag+ phản ứng hết :
Fe + 2Ag+ → Fe2+ + 2Ag
0,05 ← 0,1 → 0,1 => mtăng = 0,15.108 – 0,075.56 = 12 < 12,8=> Ag+ phản ứng hết; Cu2+ phản ứng 1 phần
Fe + Cu2+ → Fe2+ + Cu
=> mtăng = 64x – 56x = 8x
+) tổng khối lượng tăng ở 2 phản ứng là: mtăng = 12 + 8x = 12,8 => x = 0,1 mol
=> mkim loại bám vào = mAg+ mCu = 22,6 gam
Dung dịch X gồm 0,015 mol Cu(NO3)2 và 0,16 mol KHSO4. Khối lượng Fe tối đa phản ứng được với dung dịch X là (biết NO là sản phẩm khử duy nhất của N+5)
nCu(NO3)2 = 0,015 mol => nCu2+ = 0,015 mol và nNO3- = 0,03 mol
nKHSO4 = 0,16 mol => nH+ = 0,16 mol
Khi cho lượng Fe tối đa phản ứng với dung dịch X thì tạo muối Fe2+ (HS hiểu là lượng Fe3+ được sinh ra hòa tan thêm được Fe tạo thành Fe2+)
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O (0,16/8 > 0,03/2 => NO3- phản ứng hết)
0,045 ← 0,12dư 0,04 ← 0,03
Fe + Cu2+ → Fe2+ + Cu
0,015 ← 0,015
Fe + 2H+ → Fe2+ + H2
0,02 ← 0,04
=> nFe = 0,045 + 0,015 + 0,02 = 0,08 mol => mFe = 0,08.56 = 4,48 gam
Cho 2,88 gam Mg tác dụng với 100 ml dung dịch FeSO4 1M, sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
\({n_{Mg}} = \dfrac{{2,88}}{{24}} = 0,12\,\,mol\)
\({n_{FeS{O_4}}} = 0,1.1 = 0,1\,\,mol\)
PTHH: Mg + FeSO4 → MgSO4 + Fe
pư: 0,1 ← 0,1 → 0,1 (mol)
\( \to \) Mg dư: 0,12 - 0,1 = 0,02 mol
\( \to \) mrắn = mFe + mMg dư = 0,1.56 + 0,02.24 = 6,08 (g)
Cho 16,8 gam Fe vào 200 ml dung dịch CuSO4 0,75M. Sau một thời gian, lấy thanh sắt ra cân nặng 17,6 gam. Khối lượng đồng bám trên thanh sắt là
nFe = 16,8 : 56 = 0,3 (mol) ; nCuSO4 = 0,2.0,75 = 0,15 (mol)
PTHH: Fe + CuSO4 → FeSO4 + Cu↓
x → x (mol) => khối lượng tăng là 64x-56x = 8x (g)
Theo bài ta có: ∆m tắng = mKl sau – mFe = 17,6 – 16,8 = 0,8 (g)
=> 8x = 0,8
=> x = 0,1 (mol)
=> Khối lượng Cu bám trên thanh sắt là: mCu = 0,1.64 = 6,4 (g)
Cho 9,0 gam Fe vào 300 ml dung dịch AgNO3 1M. Sau khi phản ứng xảy ra hoàn toàn thu được m gam hỗn hợp kim loại. Giá trị của m là
nFe = 0,16 mol nAgNO3 = 0,3 mol
PTHH : 2AgNO3 + Fe → Fe(NO3)2 + 2Ag
Trước PƯ 0,3 0,16
Sau PƯ 0 0,01 0,3
→ mrắn = mFe + mAg = (9 – 0,15.56) + 0,3.108 = 33,0 gam
Cho m gam bột Fe vào dung dịch X chứa 0,1 mol Fe(NO3)3 và 0,4 mol Cu(NO3)2. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch Y và m gam chất rắn Z. Giá trị của m là
PTHH : Fe + 2Fe(NO3)3 → 3Fe(NO3)2
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Vì khối lượng rắn không đổi sau phản ứng nên xảy ra cả 2 phản ứng
Đặt nCu tạo thành = x mol
Ta có mrắn Z = m – mFe phản ứng + mCu = m – 56.(0,05 + x) + 64x = m
→ x = 0,35 mol → phản ứng dư Cu(NO3)2
→ Fe phản ứng hết
→ m = 56.(0,35 + 0,05) = 22,4 g
m gam chất rắn. Giá trị của m là Cho 12 gam Fe vào 100 ml dung dịch chứa CuSO4 1M và Fe2(SO4)3 1M. Sau khi các phản ứng xảy ra hoàn toàn thu được
nFe = 12: 56 ≈ 0,21 (mol)
nCuSO4 = nFe2(SO4)3 = 0,1.1 = 0,1 (mol)
Khi cho Fe vào hh 2 muối xảy ra phản ứng theo thứ tự là:
Fe + Fe3+ → Fe2+
Fe + Cu2+ → Cu↓ + Fe2+
Dung dịch sau phản ứng chứa Fe2+ và SO42-
Mà ∑ nSO42- = 0,1 + 0,1.3 = 0,4 (mol) → nFe2+ = nSO42- = 0,4 (mol)
BTKL kim loại ta có: 12 + 0,1.64 + 0,1.2.56 = 0,4.56 + m
→ m = 7,2 (g)
Khi cho mẫu Zn vào bình đựng dung dịch X, thì thấy khối lượng chất rắn trong bình tăng lên. Dung dịch X là:
Khối lượng chất rắn tăng lên => khối lượng kim loại tạo ra lớn hơn Zn => loại A và D vì Mkim loại < MZn
Loại C vì Zn không đẩy được Ba2+
Ngâm một thanh kẽm trong 100 ml dung dịch AgNO3 0,2M. Giả sử kim loại sinh ra bám hết vào thanh kẽm. Sau khi phản ứng hoàn toàn khối lượng thanh kẽm tăng bao nhiêu gam ?
nAgNO3 = 0,1.0,2 = 0,02 mol
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
0,01 ← 0,02 → 0,02
=> Độ tăng khối lượng = ${{\text{m}}_{\text{B}\downarrow }}$- ${{\text{m}}_{\text{A tan}}}$= 0,02.108 – 0,01.65 = 1,51 gam
Nhúng thanh Fe vào dung dịch CuSO4. Sau một thời gian, khối lượng thanh sắt tăng 0,8 gam so với khối lượng ban đầu. Khối lượng Fe đã phản ứng là:
Fe + Cu2+ → Cu + Fe2+
1 1 => m tăng = 8
a a => m tăng = 0,8
=> a = 0,1 => mFe = 5,6 gam
Ngâm một thanh kẽm trong 200 ml dung dịch FeSO4 xM. Sau khi phản ứng kết thúc lấy thanh kẽm ra khỏi dung dịch rửa nhẹ, làm khô thấy khối lượng thanh kẽm giảm 1,8 gam. Giá trị của x là
Zn + Fe2+ → Zn2+ + Fe
1 1 1 => mgiảm = 9 gam
0,2x ← 0,2x → 0,2x => mgiảm = 1,8 gam
=> 0,2x.9 = 1,8 => x = 1
Cho 2,24 gam bột sắt vào 200 ml dung dịch CuSO4 0,05M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
nFe = 0,04 mol; nCuSO4 = 0,01 mol
Fe + CuSO4 → FeSO4 + Cu
0,01 ← 0,01 → 0,01
=> độ tăng khối lượng = mCu – mFe = 0,01.(64 – 56) = 0,08 gam
=> mchất rắn Y = 2,24 + mtăng = 2,24 + 0,08 = 2,32 gam
Nhúng thanh kim loại M vào 100 ml dung dịch CuCl2 0,2M. Sau khi phản ứng hoàn toàn khối lượng thanh kim loại tăng 0,92 gam. Kim loại M là
nCuCl2 = 0,02 mol
2M + nCuCl2 → 2MCln + nCu
1 → n → 0,5n => khối lượng tăng: 0,5n.64 – M (gam)
$\frac{0,04}{n}$ ← 0,02 → 0,02 => khối lượng tăng: 0,92 gam
=> $\frac{0,04}{n}.(32n-M)=0,92$=> M = 9n => M là Al

