Cho m gam bột Zn vào 100 ml dung dịch Fe2(SO4)3 0,3M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch tăng thêm 2,13 gam so với khối lượng dung dịch ban đầu. Giá trị của m là:
${{n}_{F{{e}_{2}}{{\left( S{{O}_{4}} \right)}_{3}}}}=\text{ }0,03\text{ }mol\,\,\to \,\,{{n}_{F{{e}^{3+}}}}=0,06\,\,mol$
Zn + 2Fe3+ → Zn2+ + 2Fe2+ (1)
Zn + Fe2+ → Zn2+ + Fe (2)
Theo (1): ${{n}_{Zn}}=\frac{1}{2}{{n}_{F{{e}^{3+}}}}$ = 0,03 mol
Đặt nFe sinh ra = x mol => nZn (2) = x mol
mdung dịch tăng = mZn – mFe = 2,13
=> 0,03.65 + 65x – 56x = 2,13 => x = 0,02
=> mZn = mZn (1) + mZn (2) = 65.(0,03 + 0,02) = 3,25 gam
Cho 4,8 gam Mg vào dung dịch chứa 0,2 mol FeCl3, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X, cô cạn dung dịch X được m gam muối khan. Giá trị của m là
nMg = 0,2 mol;
Ta thấy : ne Fe3+ nhận tạo Fe2+ = 0,2 < ne Mg cho tối đa = 0,2.2 = 0,4 < ne Fe3+ nhận tạo Fe = 0,2.3 = 0,6
=> Mg phản ứng hết, FeCl3 phản ứng tạo thành Fe và FeCl2
=> nMgCl2 = nMg = 0,2 mol
Bảo toàn nguyên tố Cl: nFeCl2 = (3nFeCl3 - 2nMgCl2) / 2 = 0,1 mol
=> mmuối = mMgCl2 + mFeCl2 = 31,7
Cách 2: Ta có nCl = 0,2.3 = 0,6 mol
Cl kết hợp với Mg trước để tạo thành muối MgCl2, sau đó nếu còn Cl sẽ kết hợp với Fe tạo FeCl2
=> nMgCl2 = nMg = 0,2 mol và tiêu tốn 1 lượng Cl = 0,2.2 = 0,4 mol
=> 0,2 mol Cl còn lại sẽ kết hợp với Fe tạo FeCl2 => nFeCl2 = 0,2 / 2 = 0,1 mol
Cho 8,40 gam sắt vào 300 ml dung dịch AgNO3 1,3 M. Lắc kĩ cho phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
nFe = 0,15 mol; nAgNO3 = 0,39 mol
Ta thấy ne Fe cho tạo thành Fe2+ = 0,15.2 = 0,3 mol < ne Ag+ nhận = 0,39 < ne Fe cho tạo thành Fe3+ = 0,15.3 = 0,45
=> phản ứng tạo 2 muối Fe(NO3)2 và Fe(NO3)3
=> Ag+ phản ứng tạo hết thành Ag
=> nAg = nAgNO3 = 0,39 mol => m = 42,12 gam
Cho m gam Zn vào dung dịch chứa 0,15 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 3,92 gam chất rắn. Giá trị của m là:
nFeCl3 = 0,15mol => mFe tối đa sinh ra = 0,15 . 56 = 8,4 gam > 3,92 gam
=> chất rắn chỉ có Fe, còn Zn đã phản ứng hết
nFe = 3,92 / 56 = 0,07 mol
FeCl3 phản ứng với Zn tạo thành Fe (0,07 mol) và FeCl2 (0,15 – 0,07 = 0,08 mol)
Bảo toàn e: 2nZn = 3nFe + nFeCl2 => nZn = 0,145 mol
=> m = 9,425 gam
Ngâm bột sắt vào dung dịch gồm Cu(NO3)2 và AgNO3. Kết thúc phản ứng thu được dung dịch X gồm hai muối và chất rắn Y gồm hai kim loại. Kết luận nào sau đây đúng ?
Dãy điện hóa : Fe2+/Fe Cu2+/Cu Ag+/Ag
→ dung dịch X gồm 2 muối có tính oxi hóa yếu hơn là Fe2+ và Cu2+
Chất rắn Y gồm 2 kim loại có tính khử yếu hơn là Ag và Cu
Cho x mol Mg vào dung dịch chứa y mol Cu(NO3)2 và z mol AgNO3, sau khi kết thúc phản ứng thu được dung dịch 2 muối. Mối quan hệ giữa x, y, z là
Mg + 2Ag+ → Mg2+ + 2Ag (1)
Mg + Cu2+ → Mg2+ + Cu (2)
=> dung dịch sau phản ứng thu được 2 muối là Mg2+ và Cu2+
Xảy ra 2 trường hợp:
TH1: Cu2+ chưa phản ứng => Ag+ ở phản ứng (1) thiếu hoặc vừa đủ
=> ne cho = ne nhận = nAg+ = z mol
Mg có thể dư hoặc vừa đủ \({{n}_{Mg}}\ge \dfrac{{{n}_{e\text{ }cho}}}{2}=>\text{ }x\ge 0,5z\)
TH2: Cu2+ phản ứng 1 phần => Ag+ ở (1) đã phản ứng hết và Mg hết
=> ne cho = 2nMg = 2x
ne nhận = nAg+ + nCu2+ phản ứng < 2y + z
=> 2x < 2y + z => x < y + 0,5z
Cho 0,81 gam Al tác dụng với 500 ml dung dịch X chứa Fe(NO3)2 0,1M và Cu(NO3)2 0,09M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là :
nAl = 0,03 mol; nFe(NO3)2 = 0,05 mol; nCu(NO3)2 = 0,045 mol
Nhận thấy : ne Al cho tối đa = 0,03.3 = 0,09 mol = nCu2+ nhận e
=> Al phản ứng vừa đủ với Cu(NO3)2; còn Fe(NO3)2 chưa phản ứng
=> chất rắn thu được chỉ là Cu
nCu = nCu(NO3)2 = 0,045 mol => m = 2,88 gam
Cho 1,44 gam Mg tác dụng với 500 ml dung dịch X chứa Zn(NO3)2 0,1M và Cu(NO3)2 0,02M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là :
nMg = 0,06 mol; nZn(NO3)2 = 0,05 mol; nCu(NO3)2 = 0,01
ne Mg cho tối đa = 0,06.2 = 0,12 mol
ne Cu2+ nhận = 0,01.2 = 0,02 mol; ne Zn2+ nhận = 0,1 mol => ne nhận tối đa = 0,02 + 0,1 = 0,12 mol
Ta thấy ne cho tối đa = ne nhận tối đa = 0,12 mol => Mg phản ứng vừa đủ với Cu2+ và Zn2+
=> chất rắn thu được gồm Cu (0,01 mol) và Zn (0,05 mol)
=> m = 3,89 gam
Cho 0,675 gam Al tác dụng với 150 ml dung dịch X chứa Fe(NO3)3 0,5M và Cu(NO3)2 0,5M. Kết luận nào sau đây sai:
nAl = 0,025 mol; nFe(NO3)3 = 0,075 mol; nCu(NO3)2 = 0,075 mol
Thứ tự dãy điện hóa: $\frac{A{{l}^{3+}}}{Al}\,\,\,\,\frac{F{{e}^{2+}}}{Fe}\,\,\,\,\frac{C{{u}^{2+}}}{Cu}\,\,\,\frac{F{{e}^{3+}}}{F{{e}^{2+}}}$
Ta thấy: ne Al cho tối đa = 0,025.3 = 0,075 = ne Fe3+ nhận tạo Fe2+
=> Al phản ứng vừa đủ với Fe3+ tạo thành Al3+ và Fe2+
=> Sau phản ứng không thu được chất rắn
Cho 2,025 gam Al tác dụng với 150 ml dung dịch X chứa Fe(NO3)3 0,5M và Cu(NO3)2 0,2M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là :
nAl = 0,075 mol; nFe(NO3)3 = 0,075 mol; nCu(NO3)2 = 0,03 mol
Xét: ne Al cho tối đa = 0,075.3 = 0,225 mol
ne Fe3+ nhận tạo Fe2+ = 0,075.1 = 0,075 mol
ne Cu2+ nhận tạo Cu = 0,03.2 = 0,06 mol
ne Fe2+ nhận tạo Fe = 0,075.2 = 0,15 mol
Ta thấy :
ne Fe3+ nhận tạo Fe2+ + ne Cu2+ nhận tạo Cu < ne Al cho tối đa < ne Fe3+ nhận tạo Fe2+ + ne Cu2+ nhận tạo Cu + ne Fe2+ nhận tạo Fe
được biểu diễn theo sơ đồ sau:
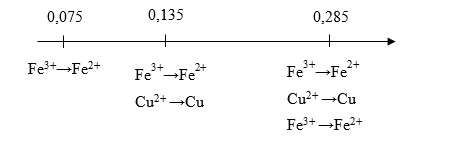
=> Cu(NO3)2 phản ứng hết; Fe(NO3)3 phản ứng tạo thành Fe và Fe(NO3)2
=> ne nhận tạo Fe = 0,225 – 0,075 – 0,06 = 0,09 mol => nFe = 0,09 / 2 = 0,045 mol
=> m = 0,03.64 + 0,045.56 = 4,44 gam
Cho 0,56 gam bột sắt vào 100 ml dung dịch gồm AgNO3 0,3M và Cu(NO3)2 0,5M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m là
nFe = 0,01 mol; nAgNO3 = 0,03 mol; nCu(NO3)2 = 0,05 mol
Ta thấy : ne Fe cho tối đa = 0,01.3 = 0,03 mol = ne Ag+ nhận tối đa
=> Fe phản ứng hết với Ag, tạo thành Fe3+ và Ag
=> nAg = nAgNO3 = 0,03 mol => m = 0,03.108 = 3,24 gam
Cho 4,48 gam bột sắt vào 200 ml dung dịch gồm AgNO3 0,3M và Cu(NO3)2 0,5M; khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m là
nFe = 0,08 mol; nAgNO3 = 0,06 mol; nCu(NO3)2 = 0,1 mol
Nhận xét: 2nFe > nAg => không xảy ra phản ứng Ag+ + Fe2+ → Ag + Fe3+ => Fe tạo muối Fe2+
ne Fe cho tối đa = 0,08.2 = 0,16 mol
ne Ag+ nhận tối đa = 0,06 mol
ne Cu2+ nhận tối đa = 0,1.2 = 0,2 mol
Ta thấy : 0,06 < ne Fe cho tối đa < 0,06 + 0,2
=> Ag+ phản ứng hết, Cu2+ phản ứng 1 phần
=> ne Cu2+ nhận tạo Cu = 0,16 – 0,06 = 0,1 mol => nCu = 0,05 mol
=> m = mAg + mCu = 0,06.108 + 0,05.64 = 9,68 gam
Cho a gam Mg vào 100 ml dung dịch Al2(SO4)3 1M và CuSO4 3M thu được 5,12 gam chất rắn. Giá trị của a là
nAl2(SO4)3 = 0,1 mol; nCuSO4 = 0,3 mol → nAl3+ = 0,2 mol; nCu2+ = 0,3 mol
Mốc 1: phản ứng vừa đủ với Cu2+ => m1 = 0,3.64 = 19,2 gam > 5,12 gam
=> Mg phản ứng hết với Cu2+ (Cu2+ còn dư và chưa phản ứng với Al3+)
=> nMg = nCu = 5,12 / 64 = 0,08 mol => m = 1,92 gam
Cho a gam Mg vào 100 ml dung dịch Al(NO3)3 2M và Cu(NO3)2 3M thu được 21,36 gam chất rắn. Giá trị của a là
nAl(NO3)3 = 0,2 mol; nCu(NO3)2 = 0,3 mol
Mốc 1: phản ứng vừa đủ với Cu2+ => m1 = 0,3.64 = 19,2 gam < 21,36 gam
Mốc 2: Phản ứng với Cu2+ và Al3+ => m2 = 0,3.64 + 0,2.27 = 24,6 > 21,36
=> Cu2+ phản ứng hết, Al3+ phản ứng 1 phần; chất rắn sau phản ứng gồm Cu (0,3 mol) và Al
mAl sinh ra = 21,36 – 0,3.64 = 2,16 gam => nAl = 0,08 mol
Bảo toàn e: 2nMg = 2nCu + 3nAl => nMg = (2.0,3 + 3.0,08) / 2 = 0,42 mol
=> m = 0,42.24 = 10,08 gam
Cho a gam Mg vào 100 ml dung dịch Al2(SO4)3 1M và CuSO4 3M thu được 25,8 gam chất rắn. Giá trị của a là
nAl2(SO4)3 = 0,1 mol; nCuSO4 = 0,3 mol => nAl3+ = 0,2 mol; nCu2+ = 0,3 mol
Mốc 1: phản ứng vừa đủ với Cu2+ => m1 = 0,3.64 = 19,2 gam < 25,8 gam
Mốc 2: Phản ứng với Cu2+ và Al3+ => m2 = 0,3.64 + 0,2.27 = 24,6 < 25,8 gam
=> cả Cu2+ và Al3+ phản ứng hết, Mg dư => chất rắn sau phản ứng gồm Cu (0,3 mol), Al (0,2 mol) và Mg
=> mMg dư = 25,8 – 24,6 = 1,2 gam
Bảo toàn e: 2nMg phản ứng = 3nAl + 2nCu => nMg phản ứng = (3.0,2 + 0,3.2) / 2 = 0,6 mol
=> m = 0,6.24 + 1,2 = 15,6
Cho thanh sắt Fe vào dung dịch X chứa 0,1 mol AgNO3 và 0,2 mol Cu(NO3)2. Khi thấy thanh kim loại tăng lên 4 gam thì dừng lại. Tính khối lượng kim loại bám vào thanh sắt
nAg+ = 0,1 mol; nCu2+ = 0,2 mol
Nếu Ag+ phản ứng hết :
Fe + 2Ag+ → Fe2+ + 2Ag
0,05 ← 0,1 → 0,1 => mtăng = 0,1.108 – 0,05.56 = 8 > 4
=> Ag+ chưa phản ứng hết; Cu2+ chưa phản ứng
Gọi nAg+ phản ứng = x mol
mtăng = 108x – 0,5x.56 = 4 => x = 0,05 mol
=> khối lượng kim loại bám là mAg = 108.0,05 = 5,4 gam
Cho thanh sắt Fe vào dung dịch X chứa 0,1 mol AgNO3 và 0,2 mol Cu(NO3)2. Khi thấy thanh kim loại tăng lên 8,8 gam thì dừng lại. Tính khối lượng kim loại bám vào thanh sắt
nAg+ = 0,1 mol; nCu2+ = 0,2 mol
Nếu Ag+ phản ứng hết :
Fe + 2Ag+ → Fe2+ + 2Ag
0,05 ← 0,1 → 0,1 => mtăng = 0,1.108 – 0,05.56 = 8 < 8,8
=> Ag+ phản ứng hết; Cu2+ phản ứng 1 phần
Fe + Cu2+ → Fe2+ + Cu
x → x → x => mtăng = 64x – 56x = 8x
=> tổng khối lượng tăng ở 2 phản ứng là: mtăng = 8 + 8x = 8,8 => x = 0,1 mol
=> mkim loại bám vào = mAg + mCu = 17,2 gam

