Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây?
Tốc độ phản ứng phụ thuộc vào 5 yếu tố:
- Nồng độ các chất tham gia phản ứng.
- Diện tích bề mặt tiếp xúc.
- Nhiệt độ.
- Áp suất (với phản ứng có chất khí).
- Chất xúc tác.
Do đó tốc độ phản ứng không phụ thuộc yếu tố thời gian xảy ra phản ứng.
Chất độc màu da cam đioxin gây tác hại vô cùng nghiêm trọng đối với môi trường và sức khỏe con người. Nó phân hủy vô cùng chậm trong đất. Nghiên cứu cho thấy phải mất tám năm để lượng đioxin trong đất giảm đi một nửa. Nếu một mảnh đất có chứa 0,232 mg đioxin thì sau bao lâu lượng đioxin còn lại là 3,625.10-6 g đioxin?
Từ 0,232 mg đioxin phân hủy còn lại là 3,625.10-6 g đioxin tức đã giảm 0,232.10−33,625.10−6=64=26 lần
=> Thời gian cần thiết để 0,232 mg đioxin phân hủy còn lại là 3,625.10-6 g là 8.6=48 năm
Cho phương trình A(k) + 2B(k) → C (k) + D (k)
Tốc độ phản ứng được tính bằng công thức v = k[A].[B]2. Nếu nồng độ của B tăng lên 3 lần, nồng độ của A không đổi thì tốc độ phản ứng tăng lên bao nhiêu lần?
Tăng nồng độ B lên 3 lần thì [B’] = [3B] → v’ = k[A].[B’]2 = 32 k[A].[B] = 9v
Vậy tốc độ phản ứng 9 lần
Chất độc màu da cam đioxin gây tác hại vô cùng nghiêm trọng đối với môi trường và sức khỏe con người. Nó phân hủy vô cùng chậm trong đất. Nghiên cứu cho thấy phải mất tám năm để lượng đioxin trong đất giảm đi một nửa. Nếu một mảnh đất có chứa 0,352 mg đioxin thì sau bao lâu lượng đioxin còn lại là 2,2.10-5 g đioxin?
Từ 0,352 mg đioxin phân hủy còn lại là 2,2.10-5 g đioxin tức đã giảm 0,352.10−32,2.10−5=16=24 lần
=> Thời gian cần thiết để 0,352 mg đioxin phân hủy còn lại là 2,2.10-5 g đioxin là 8.4=32 năm
Tốc độ của phản ứng sẽ tăng lên bao nhiêu lần khi tăng nhiệt độ từ 0oC đến 40oC, biết khi tăng nhiệt độ lên 10oC thì tốc độ phản ứng tăng lên gấp đôi.
Cứ tăng lên 100C thì tốc độ phản ứng tăng lên 2 lần
Vậy tăng từ 00C lên 400C thì tốc độ phản ứng tăng lên là: v2=240−010.v1=24v1=16v1
Vậy tốc độ phản ứng tăng lên 16 lần.
Phản ứng phân hủy một loại hoạt chất kháng sinh ở 27oC, sau 10 giờ thì lượng hoạt chất giảm đi một nửa. Sau bao lâu thì hoạt chất kháng sinh này còn lại 12,5% so với ban đầu?
Khi hoạt chất kháng sinh này còn lại 12,5% so với ban đầu tức lượng đã giảm 10012,5=8=23 lần so với ban đầu
=> Thời gian cần để lượng chất kháng sinh giảm đi 8 lần so với ban đầu là 10.3=30 giờ
Trong một thí nghiệm, người ta đo được tốc độ trung bình của phản ứng của zinc (dạng bột) với dung dịch HCl là 0,005 mol/s. Nếu ban đầu cho 0,3 mol zinc dạng bột vào dung dịch HCl ở trên thì sau bao lâu còn lại 0,03 mol zinc?
Số mol zinc đã tan là 0,3 – 0,03 = 0,27 mol
Thời gian để hòa tan hết 0,27 mol zinc là 0,270,005=54 giây
Trong một thí nghiệm, người ta đo được tốc độ trung bình của phản ứng của zinc (dạng bột) với dung dịch HCl là 0,005 mol/s. Nếu ban đầu cho 0,5 mol zinc dạng bột vào dung dịch HCl ở trên thì sau bao lâu còn lại 0,05 mol zinc?
Số mol zinc đã tan là 0,5 – 0,05 = 0,45 mol
Thời gian để hòa tan hết 0,45 mol zinc là 0,450,005=90 giây
Cho phản ứng hóa học: A + B → C
Nồng độ ban đầu của A là 1 mol/l, của B là 0,8 mol/l. Sau 10 phút, nồng độ của B chỉ còn 20% nồng độ ban đầu. Tốc độ trung bình của phản ứng là
Sau 10 phút nồng độ của B còn lại là: CB sau = 20%100%.0,8=0,16(M)
Tốc độ trung bình của phản ứng là: ¯v=ΔCBt=CBdau−CBsaut=0,8−0,1610=0,064mol/l.phut
Thả 1 mảnh magnesium có khối lượng 0,3 gam vào dung dịch HCl loãng. Sau 10 giây thấy mảnh magnesium tan hết. Tốc độ trung bình (mol/s) của phản ứng hòa tan magnesiumm là
Áp dụng công thức: _v=−ΔCΔt=−0−0,32410=1,25.10−3(mol/s)
Đối với phản ứng phân hủy H2O2 trong nước, khi thay đổi yếu tố nào sau đây, tốc độ phản ứng không thay đổi?
PTHH: 2H2O2MnO2,t0→2H2+O2
- Thêm chất xúc tác MnO2; tăng nồng độ H2O2 và đun nóng giúp tốc độ pư xảy ra nhanh hơn
- Tăng áp suất H2 là bên chất sản phẩm nên không làm tăng được tốc độ pư
Cho đồ thị biểu diễn đường cong động học của phản ứng giữa oxygen và hydrogen tạo thành nước như sau:
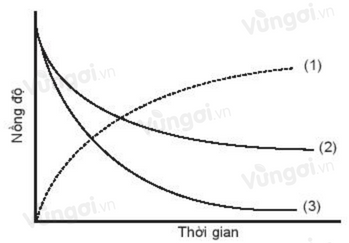
Đường cong nào là của oxygen?
PTHH: O2+2H2→2H2O
Nhận thấy O2 và H2 là các chất tham gia phản ứng nên nồng độ theo thời gian sẽ giảm
Theo PTHH số phân tử O2 tham gia phản ứng ít hơn số phân tử H2 nên số va chạm hiệu quả với H2 để tạo thành H2O ít hơn => Sự giảm nồng độ theo thời gian của O2 chậm hơn so với H2 => Tương ứng với đường cong (2)
Cho phản ứng: 2KMnO3 (rắn) MnO2,t0→ KCl (rắn) + 3O2 (khí)
Yếu tố không ảnh hưởng đến tốc độ của phản ứng trên là :
Vì chất tham gia phản ứng là chất rắn nên áp suất không ảnh hưởng đến tốc độ phản ứng
Cho phản ứng Br2 + HCOOH → 2HBr + CO2
Ban đầu nồng độ Br2 là 0,025 mol/l, sau 60s, nồng độ Br2 là 0,012 mol/l. Tính tốc độ trung bình của phản ứng theo nồng độ của Br2
Áp dụng công thức tính tốc độ trung bình của phản ứng ta có:
vt=[Br2]bd−[Br2]saut=0,025−0,01260=2,17.10−4(mol/l.s)
Hai nhóm học sinh làm thí nghiệm: nghiên cứu tốc độ phản ứng kẽm tan trong dung dịch axit clohydric:
*Nhóm thứ nhất: Cân miếng sắt 1g và thả vào cốc đựng 100ml dung dịch axit HCl 2M.
*Nhóm thứ hai: Cân 1g bột sắt và thả vào cốc đựng 150ml dung dịch axit HCl 2M.
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do:
Diện tích bề mặt bột sắt ở nhóm 2 lớn hơn nhóm 1 nên bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn.
Khối lượng sắt trong 2 thí nghiệm là bằng nhau. Nên yếu tố nồng độ bột sắt không ảnh hường.
Thể tích dung dịch không ảnh hưởng đến tốc độ phản ứng.
Cho 6 gam kẽm hạt vào một cốc đựng dung dịch H2SO4 4M (dư) ở nhiệt độ thường. Nếu giữ nguyên các điều kiện khác, chỉ thay 6 gam kẽm hạt bằng 6 gam kẽm bột thì tốc độ phản ứng sẽ:
Kẽm ở dạng bột => diện tích bề mặt đã tăng lên so với trước nên tốc độ phản ứng sẽ tăng lên
Cho phản ứng A + 2B → C
Nồng độ ban đầu của A là 1M, B là 3M, hằng số tốc độ k = 0,5. Vận tốc của phản ứng khi đã có 20% chất A tham gia phản ứng là:
V = k. [A] . [B]2
20 % chất A tham gia phản ứng => có : 1. 20 : 100 = 0,2 M đã tham gia phản ứng
A + 2B → C
0,2 => 0,4
=> Nồng độ A còn : 1- 0,2 = 0,8
=> Nồng độ B còn : 3- 0,4 = 2,6
V = 0,5 . 0,8 . 2,62 = 2,704
Cho phản ứng: 2 SO2 + O2 ⇄ 2SO3
Tốc độ phản ứng tăng lên 4 lần khi:
V = k . [SO2]2 . [O2]
V tăng lên 4 lần => nồng độ của SO2 tăng lên 2 lần hoặc nồng dộ của O2 tăng lên 4 lần
Cho phương trình hoá học của phản ứng tổng hợp amoniac:
N2(k) + 3H2(k)⇆
Khi tăng nồng độ của H2 lên 2 lần, tốc độ phản ứng thuận:
V = k. [N2 ] . [H2]3
Khi tăng nồng độ H2 lên 2 lần thì Vận tốc tăng lên 23 = 8 lần
Cho phản ứng: Br2 + HCOOH → 2HBr + CO2.Nồng độ ban đầu của Br2 là a mol/lít, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/lít. Tốc độ trung bình của phản ứng trên tính theo Br2 là 4.10-5 mol/(l.s). Giá trị của a là
∆CBr2 = a-0,01 = v.t = 50.4.10-5 => a = 0,012 mol/lít

