Nguyên tử 24Mg có cấu hình electron: 1s22s22p63s2. Hạt nhân của Mg có:
Số p = số e = 2 + 2 + 6 + 2 = 12
Số n = A – số p = 24 – 12 = 12
Nguyên tử của nguyên tố nào sau đây có số electron độc thân là lớn nhất?
Nguyên tắc xắp electron vào obitan : các electron có xu hướng xắp xếp sao cho có nhiều e độc thân nhất
C (Z = 6) : 1s22s22p2 : 2 e độc thân ( phân lớp p có 3 ô obitan mỗi 1 e ở 1 obitan )
Al (Z = 13) : 1s22s22p63s23p1 : 1 e độc thân
Cl (Z = 17) : 1s22s22p63s23p5 : 1 e độc thân ( 2 cặp e ghép đôi , 1 e độc thân )
Ca (Z =20 ) : 1s22s22p63s23p64s2: ko có e độc thân ( phân lớp s có 1 obitan , 2 e đã ghép đôi )
Nguyên tố nào dưới đây là nguyên tố s?
X, Y, Z có electron cuối cùng điền vào phân lớp p nên là nguyên tố p
T có electron cuối cùng điền vào phân lớp s nên là nguyên tố s
Trong 20 nguyên tố đầu của bảng tuần hoàn. Số nguyên tố mà nguyên tử có 6 electron s là?
Gồm các nguyên tố có Z = 12, 13, 14,15, 16,17
Nguyên tố đầu tiên chứa đủ 6e là: 12Mg: 1s22s22p63s2
Các nguyên tố sau có đủ 6e là: 1s22s22p63s23p1→6
=> Có 7 nguyên tố mà nguyên tử chứa 6 electron s
Nguyên tố X là kim loại kiềm nằm ở chu kì 4 (bảng tuần hoàn các nguyên tố hóa học). Cấu hình electron của nguyên tố X là
Bước 1: Xác định số e lớp ngoài cùng
X là kim loại kiềm ⟹ X thuộc nhóm IA ⟹ X có 1 electron lớp ngoài cùng (1)
Bước 2: Xác định số lớp e
- X nằm ở chu kì 4 ⟹ X có 4 lớp electron (2)
Bước 3: Viết cấu hình e
Từ (1) và (2) ta có cấu hình electron của X là 1s22s22p63s23p64s1.
Nguyên tố X có cấu hình e là: 1s22s22p63s23p3. Kết luận không đúng là:
Nguyên tử của nguyên tố X có cấu hình electron là: 1s22s22p63s23p3
→ ZX = 15 → X là photpho (P).
A đúng, vì ZX = 15 nên X có số thứ tự 15 trong BTH.
B đúng, số lớp e = số thứ tự chu kì, X có 3 lớp e nên thuộc chu kì 3 trong BTH.
C sai, số e ngoài cùng của X là 5 (3s23p3) không phải bằng 3.
D đúng, số e ngoài cùng của X là 5 nên có xu hướng nhận thêm 3e để đạt cấu hình 8e lớp ngoài cùng bền vững giống khí hiếm.
Phân lớp có mức năng lượng thấp nhất trong các phân lớp sau là
Thứ tự các mức năng lượng xếp từ thấp lên cao là 1s2s2p3s3p4s3d4p5s4d
=> Trong các phân lớp cho thì phân lớp 4s
Cấu hình electron nguyên tử của một nguyên tố là 1s22s22p5. Số electron độc thân của nguyên tố là
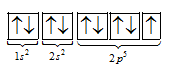
Từ cấu hình suy ra nguyên tố có 1 electron độc thân
Cho nguyên tử R có tổng số hạt cơ bản là 46, số hạt mang điện nhiều hơn số hạt không mang điện là 14. Số electron độc thân của R là
Theo bài có hệ phương trình \(\left\{ {\begin{array}{*{20}{c}}{2p + n = 46}\\{2p - n = 14}\end{array}} \right. \Leftrightarrow \left\{ {\begin{array}{*{20}{c}}{p = 15}\\{n = 16}\end{array}} \right.\)
=> Cấu hình electron của R là 1s22s22p63s23p3
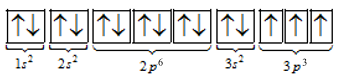
=> R có 3 electron độc thân
Nguyên tố X được sử dụng rộng rãi trong đời sống đúc tiền làm đổ trang sức, làm răng giá,... Muối iodide của X được sử dụng nhằm tụ mây tạo ra mưa nhân tạo. Tổng số hạt cơ bản trong nguyên tử nguyên tố X là 155, số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt. Electron cuối cùng của X được điền vào lớp
Theo bài có hệ phương trình \(\left\{ {\begin{array}{*{20}{c}}{2p + n = 155}\\{2p - n = 33}\end{array}} \right. \Leftrightarrow \left\{ {\begin{array}{*{20}{c}}{p = 47}\\{n = 61}\end{array}} \right.\)
=> Cấu hình electron của R là 1s22s22p63s23p63d104s24p64d105s1
=> Electron cuối cùng được điền vào lớp 4 (lớp N)
Nguyên tố sulfur thuộc nhóm VIA, chu kì 3 trong bảng tuần hoàn, là một nguyên tố thiết yếu cho sự sống, sulfur được dùng rộng rãi trong thuốc súng diêm, thuốc trừ sâu và thuốc diệt nấm.. sulfur được đánh giá là một trong các nguyên tố quan trọng nhất được sử dụng như là nguyên liệu công nghiệp. Electron cuối cùng của sulfur điền vào lớp và phân lớp nào?
Nguyên tố sulfur thuộc nhóm VIA, chu kì 3 trong bảng tuần hoàn
=> Cấu hình electron nguyên tử của sulfur là 1s22s22p63s23p4
=> Electron cuối cùng của sulfur điền vào lớp M và phân lớp 3p
Cấu hình electron của nguyên tử cho biết
Đáp án B

