Hòa tan 50,4 gam hỗn hợp A gồm Fe, FeO, Fe3O4, Cu và CuO bằng dung dịch H2SO4 dư thu được 7,84 lít khí SO2 (đktc, sản phẩm khử duy nhất) và dung dịch B chứa 132 gam hai muối sunfat. Mặt khác khử hoàn toàn hỗn hợp A cần dùng V lít khí CO (đktc). Giá trị của V là
+) Quy đổi hỗn hợp A gồm Fe, Cu và O với số mol lần lượt là x, y, z mol
→ mhỗn hợp A = 56x + 64y + 16z = 50,4 (1)
${n_{S{O_2}}} = \,\,\frac{{7,84}}{{22,4}}\,\, = \,\,0,35\,\,mol$
Xét quá trình cho – nhận e:
$Fe\,\,\,\, \to \,\,\,\,\mathop {Fe}\limits^{ + 3} \,\,\, + \,\,\,3e\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop S\limits^{ + 6} \,\, + \,\,2e\,\,\, \to \,\,\,\,\mathop S\limits^{ + 4} $
$x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,3x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,7\,\, \leftarrow \,0,35$
$Cu\,\,\,\, \to \,\,\,\,\mathop {Cu}\limits^{ + 2} \,\,\, + \,\,\,2e\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop O\limits^0 \,\,\,\, + \,\,\,2e\,\,\, \to \,\,\mathop {\,O}\limits^{ - 2} $
$y\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,2y\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,z\,\,\, \to \,\,\,2z$
+) Áp dụng định luật bảo toàn e: 3x + 2y - 2z = 0,7 (2)
+) 132 gam muối sunfat gồm Fe2(SO4)3 $\frac{x}{2}$ mol và CuSO4 y mol → 400.$\frac{x}{2}$ + 160y = 132 (3)
Từ (1), (2) và (3) → x = 0,5; y = 0,2; z = 0,6
Khử hỗn hợp A bằng CO có phản ứng:
CO + [O] → CO2
0,6 ← 0,6 mol
→ VCO = 0,6.22,4 = 13,44 (L)
Hoà tan hoàn toàn a gam hỗn hợp A gồm Zn và một kim loại M vào dung dịch H2SO4 đặc thu được 4,144 lít hỗn hợp khí X gồm SO2 và H2S có tỉ khối so với hiđro bằng 31,595. Khối lượng axit H2SO4 đặc đã phản ứng là
+) ${n_{S{O_2}}} = a\,mol;\,{n_{{H_2}S}} = b\,mol$
nX = $\frac{{4,144}}{{22,4}}$ = 0,185 mol → a + b = 0,185 (1)
+) ${\overline M _X} = {\kern 1pt} \frac{{64a+ 34b}}{{a+ b}}= 2.31,595$ → 0,81a = 29,19b (2)
Từ (1) và (2) → a = 0,18; b = 0,005
Xét quá trình nhận e
$\mathop S\limits^{ + 6} \,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,2e\,\,\,\,\,\, \to \,\,\,\mathop S\limits^{ + 4} $
$\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,36\,\, \leftarrow \,\,0,18$
$\mathop S\limits^{ + 6} \,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,8e\,\,\,\,\,\, \to \,\,\,\mathop S\limits^{ - 2} $
$\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,04\,\,\,\, \leftarrow \,\,\,0,005$
→ ne nhận = 0,36 + 0,04 = 0,4 mol → ne cho = 0,4 mol
+) ${n_{{H_2}S{O_4}}} = {n_{SO_4^{2 - }}} + {n_{S{O_2}}} + {n_{{H_2}S}} = \frac{{{n_{e\,cho}}}}{2}+ 0,18+ 0,005$= 0,385 mol
→${m_{{H_2}S{O_4}}}$ = 0,385.98 = 37,73 gam
Cho m gam hỗn hợp gồm 2 kim loại tác dụng với H2SO4 đặc nóng dư thu được 3,36 lít khí SO2 ( đktc); 2,88 gam S và dung dịch X. Cô cạn dung dịch X thu được 52,8 gam muối khan. Mặt khác nếu hoà tan hết m gam hỗn hợp kim loại ban đầu với dung dịch HCl dư thu được 8,064 lít khí H2 ở đktc. Hỗn hợp 2 kim loại đầu là
${n_{S{O_2}}} = \,\,\frac{{3,36}}{{22,4}}\,\, = \,\,0,15\,\,mol;\,\,{n_S}\, = \,\,\frac{{2,88}}{{22,4}}\,\, = \,\,0,09\,\,mol$
Xét quá trình nhận e:
$\mathop S\limits^{ + 6} \,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,2e\,\,\,\,\,\, \to \,\,\,\mathop S\limits^{ + 4} $
$\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,3\,\,\, \leftarrow \,\,\,0,15$
$\mathop S\limits^{ + 6} \,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,6e\,\,\,\,\,\, \to \,\,\,\mathop S\limits^0 $
$\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,54\,\,\,\, \leftarrow \,\,\,0,09$
→ ne nhận = 0,3 + 0,54 = 0,84 mol → ne cho = 0,84 mol
→ ${n_{SO_4^{2 - }}}\, = \,\,\frac{{{n_{e\,cho}}}}{2}$ = 0,42 mol
mmuối khan = mkim loại + ${m_{SO_4^{2 - }}}$ → mkim loại = 52,8 – 0,42.96 = 12,48 gam
Hỗn hợp tác dụng với dung dịch HCl
${n_{{H_2}}} = \,\,\frac{{8,064}}{{22,4}}\,\, = \,\,0,36\,\,mol$
→ ne nhận = 0,36.2 = 0,72 mol → ne cho = 0,72 mol
Nhận thấy trong 2 thí nghiệm số mol e cho của kim loại khác nhau → Trong hỗn hợp có 1 kim loại là Fe và kim loại M còn lại có hóa trị n
Gọi nFe = x mol; nM = y mol
Xét quá trình cho e ở TN1:
$Fe{\text{ }} \to \,\,\,\mathop {Fe}\limits^{ + 3} \,\,\,\, + {\text{ }}3e\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,M\,\,\, \to \,\,\,\mathop M\limits^{ + n} \,\,\, + \,\,\,ne$
$x\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,\,\,\,\,\,3x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,y\,\,\,\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,ny$
→ ne cho TN1 = 3x + ny = 0,84 (1)
Xét quá trình cho e ở TN2:
$Fe{\text{ }} \to \,\,\,\mathop {Fe}\limits^{ + 2} \,\,\,\, + {\text{ 2}}e\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,M\,\,\, \to \,\,\,\mathop M\limits^{ + n} \,\,\, + \,\,\,ne$
$x\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,2x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,y\,\,\,\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,\,\,\,\,ny$
→ ne cho TN2 = 2x + ny = 0,72 (2)
Từ (1) và (2) → x = 0,12; ny = 0,48 → y = $\frac{{0,48}}{n}$
mkim loại = mFe + mM → mM = 12,48 – 0,12.56 = 5,76 gam
→ ${M_M}\, = \,\,\frac{{5,76}}{{0,48}}\,n\, = \,\,12n$ → n = 2 và kim loại còn lại là Mg
Cho hỗn hợp X gồm Fe, FeS, FeS2 tác dụng hoàn toàn với H2SO4 đặc vừa đủ, thu được dung dịch Y và 23,52 lít khí SO2 (đktc). Cho dung dịch Y tác dụng với NaOH dư thu được kết tủa Z. Nung kết tủa Z đến khối lượng không đổi thu được 16 gam chất rắn. Khối lượng hỗn hợp X là
Quy đổi hỗn hợp X về Fe và S với số mol lần lượt là x và y mol
$X\,\,\left\{ \begin{gathered}Fe:x\,\,mol \hfill \\S:y\,\,mol \hfill \\ \end{gathered} \right.\,\,\xrightarrow{{ + \,{H_2}S{O_4}}}\,\,Y\,\left\{\begin{gathered}F{e_2}{(S{O_4})_3} \hfill \\S{O_2} \hfill \\ \end{gathered} \right.\,\,\xrightarrow{{ + \,NaOH}}\,\,Z\,\left\{ {Fe{{(OH)}_3} \downarrow \,\,\xrightarrow{{{t^o}}}} \right.\,\,F{e_2}{O_3}$
${n_{S{O_2}}} = \,\,\frac{{23,52}}{{22,4}}\,\, = \,\,1,05\,\,mol$
Xét quá trình cho – nhận e:
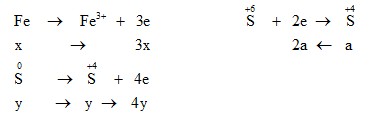
Bảo toàn e : ne cho = ne nhận → 3x + 4y = 2a (1)
${n_{S{O_2}}}$ = ${n_{S{O_2}\,(1)}} + {n_{S{O_2}\,(2)}}$ → y + a = 1,05 (2)
${n_{F{e_2}{O_3}}} = \,\,\frac{{16}}{{160}}\,\, = \,\,0,1\,mol$ → nFe = 2.0,1 = 0,2 mol → x = 0,2 (3)
Từ (1), (2), (3) → x = 0,2; y = 0,25; a = 0,8
→ mhỗn hợp X = mFe + mS = 56.0,2 + 32.0,25 = 19,2gam
Hòa tan hoàn toàn 19,2 gam hỗn hợp X gồm Fe, FeO, Fe3O4 và Fe2O3 trong 50 ml dung dịch H2SO4 18M (đặc, dư, đun nóng), thu được dung dịch Y và V lít khí SO2 (đktc và là sản phẩm khử duy nhất). Cho 450 ml dung dịch NaOH 2M vào dung dịch Y thu được 21,4 gam kết tủa. Giá trị của V là
nH2SO4 = 0,05.18 = 0,9 mol; nFe(OH)3 = 21,4 : 107 = 0,2 mol
Quy đổi hỗn hợp ban đầu thành Fe (x mol) và O (y mol)
mX = 56x + 16y = 19,2 (1)
BTe: 3nFe = 2nO + 2nSO2 => 3x = 2y + 2nSO2 => nSO2 = 1,5x - y (mol)
BTNT "Fe": nFe2(SO4)3 = 0,5nFe = 0,5x (mol)
Khi cho NaOH phản ứng với dd Y:
- Nếu NaOH hết: nNaOH = nH+ + 3nFe3+ = 2.nHS2O4 dư + 3nFe(OH)3
=> 0,9 = 2.nH2SO4 dư + 3.0,2 => nH2SO4 dư = 0,15 mol => nH2SO4 pư = 0,9 - 0,15 = 0,75 mol
BTNT "S": nH2SO4 pư = 3nFe2(SO4)3 + nSO2 => 0,75 = 3.0,5x + 1,5x - y (2)
Giải hệ (1) và (2) được x = 0,3 và y = 0,15
=> nSO2 = 1,5x - y = 0,3 mol => V = 6,72 lít
- Nếu NaOH dư: HS tự xét
Chia hỗn hợp X gồm Fe, Fe3O4, Fe(OH)3 và FeCO3 thành hai phần bằng nhau. Hòa tan hết phần 1 trong dung dịch HCl dư, thu được 0,1 mol hỗn hợp 2 khí có tỉ khối so với He bằng 4,7 và dung dịch Y. Cho phần 2 tác dụng với lượng dư dung dịch H2SO4 đặc nóng, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Z và 0,2075 mol hỗn hợp khí T gồm CO2 và SO2 (sản phẩm khử duy nhất của S+6).
Khối lượng FeCl2 trong dung dịch Y là
*Phần 1: Hòa tan 1 phần hỗn hợp vào HCl dư
Đặt nH2 = a và nCO2 = b (mol)
+ n khí = a + b = 0,1 (1)
+ m khí = n khí.M khí => 2a + 44b = 0,1.4,7.4 (2)
Giải hệ thu được a = 0,06 và b = 0,04
Fe + 2HCl → FeCl2 + H2
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
FeCO3 + 2HCl → FeCl2 + CO2 + H2O
=> nFe = nH2 = 0,06 mol; nFeCO3 = nCO2 = 0,04 mol
*Phần 2: Hòa tan 1 phần vào dung dịch H2SO4 đặc dư
nSO2 = n khí - nCO2 = 0,2075 - 0,04 = 0,1675 mol
Quá trình cho và nhận e:
Fe0 → Fe+3 + 3e S+6 + 2e → S+4
3Fe+8/3 → 3Fe+3 + 1e
Fe+2 → Fe+3 + 1e
Áp dụng định luật bảo toàn electron:
3nFe + nFe3O4 + nFeCO3 = 2nSO2 => 3.0,06 + nFe3O4 + 0,04 = 2.0,1675
=> nFe3O4 = 0,115 mol
Như vậy, dựa theo các PTHH ở phần 1 ta có:
nFeCl2 = nFe + nFe3O4 + nFeCO3 = 0,06 + 0,115 + 0,04 = 0,215 mol
=> mFeCl2 = 0,215.127 = 27,305 gam
Hỗn hợp a gồm Cu và CuO Hòa tan hoàn toàn 20,8 gam hỗn hợp a vào 73,5 gam dung dịch H2SO4 80% chỉ thu được dung dịch x và khí SO2 là sản phẩm khử duy nhất cho x tác dụng hoàn toàn với 900 ml dung dịch NaOH 1M sau đó lọc bỏ kết tủa được dung dịch y cô cạn y thu được chất rắn z nặng 60,8 g nồng độ phần trăm của CuSO4 trong x.
Tóm tắt bài toán:
\(20,8\,(g)\,A\left\{ \begin{array}{l}Cu\\CuO\end{array} \right. + 73,5\,g\,dd\,\underbrace {{H_2}S{O_4}}_{0,6\,(mol)} \to \left\langle \begin{array}{l}S{O_2}:\\\left. {X\left\{ \begin{array}{l}CuS{O_4}:\\{H_2}S{O_4}\,du\end{array} \right.} \right\} + \underbrace {NaOH}_{0,9\,(mol)} \to \left\{ \begin{array}{l} \downarrow Cu{(OH)_2}\\60,8\,(g)\,Z\left\{ \begin{array}{l}N{a_2}S{O_4}:a\,(mol)\\NaOH\,du:\,b(mol)\end{array} \right.\end{array} \right.\end{array} \right.\)
Đặt trong Z số mol Na2SO4 và NaOH dư lần lượt là a và b (mol)
Ta có hệ phương trình: \(\left\{ \begin{array}{l}{m_{N{a_2}S{O_4}}} + {m_{NaOH\,du}} = {m_Z}\\BT:Na = > 2{n_{N{a_2}S{O_4}}} + {n_{NaOHdu}} = {n_{NaOH\,bd}}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}142a + 40b = 60,8\\2a + b = 0,9\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,4\\b = 0,1\end{array} \right.\)
BTNT “S”: nH2SO4 bđ = nSO2 + nNa2SO4
⟹ 0,6 = nSO2 + 0,4
⟹ nSO2 = 0,6 – 0,4 = 0,2 (mol)
BT e ta có: nCu = nSO2 = 0,2 (mol) (Do Cu từ số oxh 0 lên +2, còn S từ số oxi hóa +6 xuống +4)
⟹ mCu = 0,2.64 = 12,8 (g)
⟹ mCuO = mA – mCu = 20,8 – 12,8 = 8 (g)
⟹ nCuO = mCuO : MCuO = 8 : 80 = 0,1 (mol)
BTNT “Cu”: nCuSO4 = nCu + nCuO = 0,2 + 0,1 = 0,3 (mol)
⟹ mCuSO4 = nCuSO4×MCuSO4 = 0,3×160 = 48 (g)
Ta có: mA + mdd H2SO4 = mdd X + mSO2
⟹ mdd X = mA + mdd H2SO4 - mSO2 = 20,8 + 73,5 – 0,2.64 = 81,5 (g)
Phần trăm khối lượng CuSO4 có trong dd X là:
\(C\% = \frac{{{m_{CuS{O_4}}}}}{{{m_{dd\,X}}}}.100\% = \frac{{48}}{{81,5}}.100\% = 58,90\% \)
Cho m gam hỗn hợp X gồm Fe và FeO tác dụng với dung dịch HCl dư, thu được 0,3 mol khí H2. Nếu cho m gam hỗn hợp X trên tác dụng với axit H2SO4 đặc, dư, đun nóng, thu được 11,2 lít khí SO2 (đktc). Biết các phản ứng xảy ra hoàn toàn, SO2 là sản phẩm khử duy nhất của S+6. Giá trị của m và khối lượng axit H2SO4 đã phản ứng lần lượt là
Đặt số mol Fe = a (mol); FeO = b (mol)
Cho hh X tác dụng với HCl dư chỉ có Fe tạo ra khí H2
BT e: 2nFe = 2nH2 ⟹ nFe = nH2 = 0,3 (mol) ⟹ a = 0,3 (mol)
Cho hh X tác dụng với H2SO4 đặc, nóng dư cả Fe và FeO cùng tạo khí
nSO2(đktc) = 11,2/22,4 = 0,5 (mol)
quá trình nhường e
Fe0 → Fe+3 + 3e
Fe+2 (FeO) →Fe+3 + 1e
quá trình nhận e
S+6 + 2e → S+4 (SO2)
bảo toàn e ta có: ne nhường = ne nhận
⟹ 3nFe + nFeO = 2nSO2
⟹ 3a + b = 2.0,5
Thay a = 0,3 vào ⟹ 3.0,3 + b = 2.0,5 ⟹ b = 0,1 (mol)
Vậy hh X gồm: Fe: 0,3 (mol) và FeO: 0,1 (mol)
⟹ m = mFe + mFeO = 0,3.56 + 0,1.72 = 24 (g)
BTNT “Fe”: nFe2(SO4)3 = 1/2(nFe + nFeO) = 1/2.(0,3 + 0,1) = 0,2 (mol)
nH2SO4 pư = nSO42-(muối) + nSO2 = 3.0,2 + 0,5 = 1,1 (mol) ⟹ mH2SO4 = 1,1.98 = 107,8 (g)
Hòa tan hoàn toàn m gam hỗn hợp X gồm Fe và kim loại M (chỉ có hóa trị II) trong dung dịch H2SO4 đặc, nóng thu được 6,72 lít khí SO2 (đktc); 5,76 gam S (không có sản phẩm khử nào khác) và dung dịch X chứa 105,6 gam muối Fe2(SO4); MSO4. Mặt khác, nếu hòa tan hết m gam X ban đầu với dung dịch HCl dư thu được 16,128 lít khí H2(đktc). Kim loại M là
nSO2(đktc) = 6,72/22,4 = 0,3 (mol); nS = 5,76/32 = 0,18 (mol)
Đặt số mol Fe = a (mol) và M = b (mol)
BTNT “Fe”: nFe2(SO4)3 = 1/2 nFe = 0,5a (mol)
BTNT “M”: nMSO4 = nM = b (mol)
Xét hh X tác dụng với H2SO4 đặc, nóng
Hệ phương trình: \(\left\{ \begin{array}{l}BTe:3{n_{Fe}} + 2{n_M} = 2{n_{S{O_2}}} + 6{n_S}\\m\,muoi:{m_{F{e_2}{{(SO4)}_3}}} + {m_{MS{O_4}}} = {m_{\,muoi}}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}3a + 2b = 2.03 + 6.0,18\\400.0,5a + (M + 96)b = 105,6\end{array} \right. \Rightarrow \left\{ \begin{array}{l}3a + 2b = 1,68\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(1)\\200a + (M + 96)b = 105,6\,\,(2)\end{array} \right.\)
Xét hh tác dụng với HCl dư; nH2(đktc) = 16,128/22,4 = 0,72 (mol)
TH1: Chỉ có Fe tác dụng, M đứng sau H trong dãy điện hóa học nên không phản ứng
BTe ta có: 2nFe = 2nH2 ⟹ nFe = nH2 = 0,72 (mol) ⟹ a = 0,72 (mol) ⟹ thay a vào (1) ⟹ b = -0,24 ⟹ loại
TH2: Cả Fe và M cùng tác dụng với dd HCl
BT e ta có: 2nFe + 2nM = 2nH2
⟹ a + b = 0,72 (3)
giải hệ (2) và (3) ta được a = 0,24 và b = 0,48
Thay a, b vào (2) ta có: 200.0,24 + (M+96).0,48 = 105,6 ⟹ M = 24 (g/mol)
Vậy M là Mg
Hòa tan m gam hỗn hợp X gồm Fe và các oxit FeO, Fe2O3, Fe3O4 bằng dung dịch H2SO4 đặc, nóng dư đến phản ứng hoàn toàn, thu được 80 gam muối khan và 2,24 lít SO2 (đktc). Số mol H2SO4 đã tham gia phản ứng là
muối khan thu được là Fe2(SO4)3: 80 (g) → nFe2(SO4)3 = 80/400 = 0,2 (mol)
nSO2(đktc) = V/22,4 = 2,24/22,4 = 0,1 (mol)
BTNT “S” ta có: nH2SO4 = 3nFe2(SO4)3 + nSO2 = 3.0,2 + 0,1 = 0,7 (mol)
Cho m gam nhôm tác dụng với dung dịch H2SO4 (đặc, nóng, dư) sau khi phản ứng kết thúc người ta thu 13,44 lit khí SO2 (đktc). Giá trị m là
\({n_{S{O_2}(dktc)}} = \frac{{13,44}}{{22,4}} = 0,6\,(mol)\)
PTHH: 2Al + 6H2SO4 đặc, nóng → Al2(SO4)3 + 3SO2↑ + 6H2O
Theo PTHH: \({n_{Al}} = \frac{2}{3}{n_{S{O_2}}} = \frac{2}{3}.0,6\, = 0,4(mol) \Rightarrow {m_{Al}} = 0,4.27 = 10,8\,(g)\)
Cách 2: Bảo toàn e ta có: ne (Al nhường) = ne (S+6 nhận)
→ 3nAl = 2nSO2 → nAl = 2. 0,6 : 3 = 0,4 (mol)
→ mAl = 0,4. 27 = 10,8 (g)
Nguyên tắc pha loãng axit sunfuric đặc là:
Axit H2SO4 tan vô hạn trong nước và tỏa nhiều nhiệt. Nếu rót nước vào H2SO4, thì nước sẽ sôi đột ngột và kéo theo các giọt axit bắn ra xung quanh gây nguy hiểm.
Để pha loãng axit H2SO4 đặc cần rót từ từ axit vào, sau đó khuấy nhẹ dung dịch.

