Liên kết hoá học giữa các nguyên tử trong phân tử H2O là liên kết
${\Delta _{\chi {\kern 1pt} (O - H)}} = \left| {3,44 - 2,2} \right| = 1,24$
Ta có 0,1< 1,24 < 1,7
=> liên kết cộng hóa trị phân cực
Liên kết hóa học trong phân tử Br2 thuộc loại liên kết
Liên kết trong Br2 được hình thành bởi sự dùng chung cặp electron giữa 2 nguyên tử của cùng nguyên tố Br
=> liên kết cộng hóa trị không cực
Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H (2,20); Na (0,93). Hợp chất nào sau đây là hợp chất ion?
Ta có:
- ${\Delta _{\chi \,(Na - F)}} = \left| {3,98 - 0,93} \right| = 3,05 > 1,7$
CO2 là hợp chất cộng hóa trị
- ${\Delta _{\chi \,(C - H)}} = \left| {2,55 - 2,20} \right| = 0,35 < 1,7$
→ CH4 là hợp chất cộng hóa trị
- ${\Delta _{\chi \,(H - O)}} = \left| {3,44 - 2,20} \right| = 1,24 < 1,7$
→ H2O là hợp chất cộng hóa trị
Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
Bước 1: Xác định X, Y
X: 1s22s22p63s23p64s1 → X là K (nhóm IA) dễ cho 1 e tạo thành ion X+
Y: 1s22s22p5 → Y là F (nhóm VIIA) dễ nhận 1e tạo thành ion Y-
Bước 2: Xác định liên kết hình thành giữa X và Y
=> Liên kết gữa X và Y thuộc loại liên kết ion.
Khi so sánh NH3 với $NH_4^ + $, phát biểu không đúng là:
A đúng vì liên kết giữa N-H là liên kết cộng hóa trị
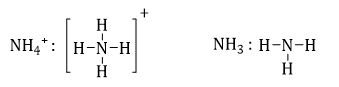
B đúng vì $\mathop N\limits^{ - 3} {H_3},\,\mathop N\limits^{ - 3} H_4^ + $ → N đều có số oxi hóa là -3
C đúng vì
NH3 + H2O $\overset {} \leftrightarrows \,\,NH_4^ + \,\, + \,\,O{H^ - }$
$NH_4^ + \,\,\,\,\,\overset {} \leftrightarrows \,\,\,N{H_3}\,\, + \,\,{H^ + }$
D sai vì
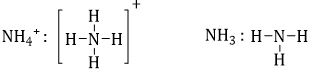
→ Trong NH3: N có cộng hóa trị = 3, $NH_4^ + $có cộng hóa trị = 4
Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X ở nhóm IIA, nguyên tố Y ở nhóm VA. Công thức của hợp chất tạo thành từ 2 nguyên tố trên có dạng là
X thuộc nhóm IIA => X là kim loại
Y thuộc nhóm VA => Y là phi kim
Trong hợp chất tạo thành từ X và Y:
+ X dễ dàng nhường 2 electron để đạt cấu hình bền vững => X có số oxi hóa là +2
+ Y dễ dàng nhận 3 electron để đạt cấu hình bền vững => Y có số oxi hóa là -3
=> công thức hợp chất phù hợp là X3Y2
Trong hợp chất ion XY (X là kim loại, Y là phi kim), tổng số electron trong XY là 20. Biết trong mọi hợp chất, Y chỉ có một mức oxi hóa duy nhất. Công thức XY là
A sai vì : AlN →$A{l^{{3^ + }}}$ : 1s22s22p6 ; ${N^{3 - }}$: 1s22s22p6 nhưng N có nhiều số oxi hóa (-3, +1, +2, +3, +4, +5)
B sai vì: MgO → $M{g^{{2^ + }}}$ :1s22s22p6 ; ${O^{2 - }}$: 1s22s22p6 nhưng O có nhiều số oxi hóa (-1, -2)
C sai vì: LiF →$L{i^{1 + }}$ : 1s2, ${F^ - }$ : 1s22s22p6 → tổng số electron = 12 ≠ 20
NaF →$N{a^ + }$:1s22s22p6 , ${F^ - }$ : 1s22s22p6
F chỉ có 1 mức oxi hóa duy nhất là -1 trong hợp chất, tổng số electron trong NaF = 20 (thỏa mãn)
Nguyên tử X có 20 proton và nguyên tử Y có 17 electron. Công thức phân tử và bản chất liên kết của hợp chất hình thành giữa X và Y có thể là
- Cấu hình e của X: 1s22s22p63s23p64s2
=> X có xu hướng nhường 2e để đạt cấu hình bền của khí hiếm => X hóa trị 2+ => X là kim loại.
- Cấu hình e của Y: 1s22s22p63s23p5
=> Y có xu hướng nhận thêm 1e để đạt cấu hình bền của khí hiếm => X hóa trị 1- => X là phi kim.
Vậy công thức phân tử là XY2 và liên kết ion (vì là liên kết giữa kim loại điển hình nhóm IIA và phi kim điển hình nhóm VIIA).
Cho các nhận định sau:
(1) Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
(2) Các hợp chất cộng hóa trị phân cực thường tan nhiều trong nước.
(3) Hóa trị của các nguyên tố trong hợp chất cộng hóa trị được gọi là điện hóa trị của nguyên tố đó.
(4) Liên kết trong phân tử H2, N2, F2 thuộc loại liên kết cộng hóa trị không phân cực.
(5) Khi hình thành liên kết cộng hóa trị, các nguyên tử có thể góp chung 1, 2 hoặc 3 electron để hình thành 1,2 hoặc 3 cặp electron dùng chung.
Số nhận định đúng là
(1) đúng vì liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
(2) đúng vì các hợp chất cộng hóa trị phân cực thường tan nhiều trong nước (dung môi phân cực).
(3) sai vì hóa trị của các nguyên tố trong hợp chất cộng hóa trị được gọi là cộng hóa trị của nguyên tố đó.
(4) đúng vì hiệu độ âm điện của 2 nguyên tử giống nhau bằng 0 nên liên kết trong phân tử H2, N2, F2 thuộc loại liên kết cộng hóa trị không phân cực.
(5) đúng vì khi hình thành liên kết cộng hóa trị, các nguyên tử có thể góp chung 1, 2 hoặc 3 electron để hình thành 1,2 hoặc 3 cặp electron dùng chung.
Vậy có 4 phát biểu đúng.
Phát biểu nào sau đây đúng khi so sánh hai chất C2H5OH và CH3-O-CH3?
Do C2H5OH tạo được liên kết hydrogen với nhau
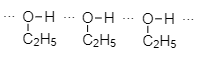
Do đó cần năng lượng khá cao dưới dạng nhiệt để phá vỡ các liên kết hydrogen trước khi chuyển C2H5OH từ lỏng sang hơi.
⇒ Độ sôi của C2H5OH lớn hơn CH3-O-CH3.
Gọi độ dài liên kết đơn, liên kết đôi, liên kết ba giữa N với N lần lượt là a, b, c. Thứ tự tăng dần độ dài liên kết là
Năng lượng liên kết càng lớn thì độ dài liên kết càng ngắn
Năng lượng liên kết của nối đơn < nối đôi < nối ba
=> Độ dài liên kết của nối ba < nối đôi < nối đơn
Người ta biết rằng tinh thể C3N4 có thể có độ cứng lớn hơn kim cương và các nguyên tử đều liên kết với nhau bằng liên kết đơn. Phát biểu nào sau đây đúng?
Do N thuộc nhóm VA, C thuộc nhóm IVA và cả 2 nguyên tố đều cùng thuộc một chu kì nên liên kết giữa C-N ngắn hơn liên kết giữa C-C => C sai
Theo bài có:
- Các nguyên tử trong C3N4 đều liên kết với nhau bằng liên kết đơn => D sai
- Tinh thể C3N4 có thể có độ cứng lớn hơn kim cương => B sai
Cho các sự hình thành sau:
\(Cl + Cl \to C{l_2}\) toả nhiệt 247 kJ
\(O + O \to {O_2}\) toả nhiệt 493 kJ
\(N + N \to {N_2}\) toả nhiệt 946 kJ
Phát biểu nào sau đây đúng?
Năng lượng càng lớn thì độ bền càng lớn
Nhận thấy quá trình tạo N2 có năng lượng lớn nhất
=> Nitrogen bền nhất
Kích thước của năng lượng liên kết có thể đo độ bền của liên kết hoá học cho trong bảng sau đây:

Phát biểu nào sau đây không đúng?
Do Si-Cl có năng lượng liên kết lớn hơn Si-C nên hợp chất SiCl4 bền hơn hợp chất SiC => Điểm nóng chảy của SiCl4 cao hơn của SiC => D sai

