Nung m gam hỗn hợp gồm Mg và Cu(NO3)2 trong điều kiện không có không khí, sau một thời gian thu được rắn X và 6,384 lít (đktc) hỗn hợp khí Y. Hòa tan hoàn toàn X bằng 500 ml; dung dịch HCl 2M, thu được dung dịch Z chỉ chứa 54,42 gam muối và 0,05 mol hỗn hợp khí T gồm hai khí trong đó có N2. Tỉ khối của T so với He bằng 5,7.
Cho các phát biểu sau:
(a) Giá trị của m là 39,64.
(b) Trong Y có chứa 0,045 mol O2.
(c) Nếu tiếp tục nung X đến khối lượng không đổi thì thu được 2 chất rắn.
(d) Dung dịch Z chỉ chứa 1 anion.
(e) Dung dịch Z chứa 2 cation.(d) Số phát biểu đúng là:
Bước 1: Viết sơ đồ tóm tắt đề bài
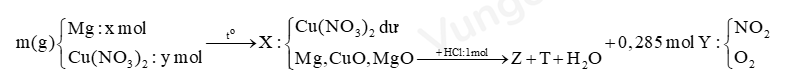
Bước 2: Xác định thành phần của Z, tính số mol các chất trong Z- 54,42 gam Z: Mg2+ x (mol) ; Cu2+ y (mol) ; Cl- 1 (mol) ; NH4+ z (mol).
- Lập hệ phương trình tính x, y, z:
+ mmuối = 24x + 4y + 18z + 1.35,5 = 54, 42
+ BTĐT: 2x + 2y + z = 1
+ BTNT O: nH2O = y - 0,285.2 = y - 0,57
+ 0,05 mol T: N2 0,04 mol ; H2 0,01 mol (dựa vào tỉ khối so với He $\overline M $= 22,8, áp dụng sơ đồ đường chéo tính nN2, nH2).
BTNT H: 2(y - 0,57) + 4z + 0,01.2 = 1
⟹ x = 0,32 ; y = 0,17 ; z = 0,02
Bước 3: Xét các phát biểu, xác định phát biểu đúng(a) Đúng, m = mMg + mCu(NO3)2 = 39,4 g
(b) Đúng
BTNT N ⟹ nNO2 = 2y - x - 2nN2 = 0,24 mol
⟹ nO2 = nY - nNO2 = 0,045 mol
(c) Sai
Thu được 3 chất rắn MgO, Cu, CuO dư:
PTHH: Mg + Cu(NO3)2 → CuO + MgO + 2NO2
nCu(NO3)2 = 0,17 mol ⟹ nMg = nCuO = nMgO = 0,17 mol
Mg + CuO → MgO + Cu
nMg = 0,32 - 0,17 = 0,15 mol ⟹ nCuO = nMgO = 0,15 mol
⟹ nCuO dư = 0,02 mol
(d) Đúng, do có chứa H2 nên NO3- hết, Z chỉ chứa 1 anion là Cl-
(e) Sai, Z chứa 3 cation Mg2+, Cu2+, NH4+
- Vậy có 3 phát biểu đúng
Nung 5,54 gam hỗn hợp X gồm Fe3O4, CuO và Al đến phản ứng hoàn toàn được hỗn hợp rắn Y. Hòa tan hết Y trong dung dịch HCl dư thì lượng H2 sinh ra tối đa là 0,06 mol. Nếu cho Y vào dung dịch NaOH dư thì thấy còn 2,96 gam chất rắn không tan. Phần trăm khối lượng của Al trong X là:
Bước 1: Xác định thành phần hỗn hợp Y và các oxit có phản ứng hết hay không.
Nếu chỉ có H2 sinh ra từ Fe ta có nFe = nH2 = 0,06 mol
⟹ mFe = 3,36g > 2,96g (vô lý)
⟹ Al dư, các oxit phản ứng hết
Bước 2: Tính số mol Al, CuO, Fe3O4
- Đặt a, b, c là số mol của Al, CuO, Fe3O4
⟹ mX = 27a + 80b + 232c = 5,54 (1)
- Bảo toàn e ta có: 3nAl = 2nCu + 2nFe3O4 + 2nH2
⟹ 3a = 2b + 2c + 0,06 . 2 (2)
- Chất rắn Y chứa Cu, Fe, Al dư, sau khi hào tan Y vào NaOH dư thu được 2,96 gam chất rắn không tan:
mchất rắn = 64b + 56.3c = 2,96 (3)
- Giải (1), (2), (3): a = 0,06, b = 0,02 và c = 0,01
Bước 3: Tính %mAl trong X
%mAl trong X = 29,24%
Thực hiện các thí nghiệm sau:
(a) Cho hỗn hợp Na2O và Al2O3 (tỉ lệ mol 1 : 1) vào nước (dư).
(b) Cho hỗn hợp Cu và Fe3O4 (tỉ lệ mol tương ứng 2 : 1) vào dung dịch HCl (dư).
(c) Cho hỗn hợp Ba và NaHCO3 (tỉ lệ mol tương ứng 1 : 2) vào dung dịch HCl (dư).
(d) Cho hỗn hợp Cu và NaNO3 (tỉ lệ mol tương ứng 1 : 2) vào dung dịch HCl (dư).
(e) Cho hỗn hợp BaCO3 và KHSO4 vào nước (dư).
Khi phản ứng trong các thí nghiệm trên kết thúc, có bao nhiêu thí nghiệm không thu được chất rắn?
(a) Na2O + H2O → 2NaOH
1 mol 2 mol
Al2O3 + 2NaOH → 2NaAlO2 + H2O
1 mol 2 mol
Vậy phản ứng vừa đủ, không thu được chất rắn.
(b) Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
1 mol → 2 mol
Cu + 2FeCl3 → CuCl2 + 2FeCl2
2 mol 2 mol
Ta thấy: 2/1 > 2/2 ⟹ Cu dư, FeCl2 nên sau phản ứng thu được chất rắn Cu.
(c) Ba + 2H2O → Ba(OH)2 + H2 ↑
1 mol → 1 mol
Ba(OH)2 + NaHCO3 → BaCO3 ↓ + NaOH + H2O
1 mol 1 mol
Thu được chất rắn là BaCO3.
(d) 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
1 mol 2 mol
Ta thấy NO3-, H+ dư nên Cu tan hết ⟹ không thu được chất rắn.
(e) BaCO3 + 2KHSO4 → BaSO4 ↓ + K2SO4 + H2O + CO2 ↑
Thu được chất rắn là BaSO4.
Vậy có tất cả 2 thí nghiệm không thu được chất rắn là (a), (d).

