Nước cứng không gây ra tác hại nào dưới đây?
Nước cứng không gây ngộ độc nước uống
Một loại nước cứng có chứa Ca2+ 0,004M; Mg2+ 0,004M; Cl- và . Cần lấy bao nhiêu ml dung dịch Na2CO3 0,2M để biến 1 lít nước cứng trên thành nước mềm? (coi như các chất kết tủa hoàn toàn)
${n_{C{a^{2 + }}}} = 0,004\,\,mol;\,\,{n_{M{g^{2 + }}}} = 0,004\,\,mol$
Ta có : nNa2CO3 phản ứng với Ca = nCaCO3 = nCa2+ = 0,004 mol
nNa2CO3 phản ứng với Mg = nMgCO3 = nMg2+ = 0,004 mol
=>$\sum {{n_{N{a_2}C{O_3}}}} $ = 0,004 + 0,004 = 0,008 mol => V = 0,008 / 0,2 = 0,04 lít = 40 ml
Một dung dịch chứa các ion: 0,01 mol Ca2+; 0,02 mol Mg2+; 0,04 mol K+; 0,065 mol HCO3-; 0,015 mol Cl- và 0,02 mol NO3-. Cần dùng bao nhiêu mol Ca(OH)2 để làm mất hoàn toàn tính cứng ?
Gọi nCa(OH)2 cần dùng = x mol
=> trong dung dịch chứa x + 0,01 mol Ca2+ và 0,02 mol Mg2+
=> cần dùng (x + 0,03) mol CO32- để kết tủa hoàn toàn ion Ca2+ và Mg2+
$HCO_3^ - \,\,\,\, + \,\,\,\,O{H^ - }\,\, \to \,\,\,CO_3^{2 - }\,\, + \,\,{H_2}O$
x + 0,03 ← x + 0,03 ← x + 0,03
=> nOH- cần dùng = 2nCa(OH)2 => x + 0,03 = 2x => x = 0,03 mol
Một cốc nước có chứa các ion Na+ (0,02 mol), Mg2+ (0,02 mol), Ca2+ (0,04 mol), Cl- (0,02 mol), $HCO_3^ - $(0,1 mol), SO42- (0,01 mol). Đun sôi cốc trên đến khi các phản ứng xảy ra hoàn toàn thì nước còn lại trong cốc
Đun sôi nước xảy ra phản ứng:
$2HCO_3^ - \xrightarrow{{{t^o}}}CO_3^{2 - } + {H_2}O$
$0,1\;\;\;\;\; \to \;\;\;0,05$
$C{a^{2 + }} + CO_3^{2 - } \to CaC{{\text{O}}_3}$
$0,04 \to \,0,04$
$M{g^{2 + }} + CO_3^{2 - } \to MgC{{\text{O}}_3}$
$0,01 \leftarrow 0,01$
=> dung dịch sau đun nóng gồm Na+ (0,02 mol), Mg2+ (0,01 mol), Cl- (0,02 mol), SO42- (0,01 mol)
=> nước còn lại trong cốc có tính cứng vĩnh cửu
Để làm sạch lớp cặn trong các dụng cụ đun và chứa nước nóng, người ta dùng
Cặn trong ấm nước là các muối kết tủa CaCO3, MgCO3
Để làm sạch lớp cặn trong các dụng cụ đun và chứa nước nóng, người ta dùng giấm ăn, vì giấm ăn có khả năng hòa tan được các muối kết tủa CaCO3, MgCO3 theo pư
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
2CH3COOH + MgCO3 → (CH3COO)2Mg + H2O + CO2
Chất có thể làm mềm cả nước có tính cứng tạm thời và nước có tính cứng vĩnh cửu là
A. CaCl2 không làm kết tủa bất cứ ion nào trong dung dịch ⟹ không thỏa mãn
B. Ca(OH)2 không kết tủa được Ca2+, Mg2+ của nước cứng vĩnh cửu ⟹ không thỏa mãn
C. Na2CO3 có gốc CO32- kết tủa với Mg2+ và Ca2+ ⟹ làm mềm được cả 2 loại nước cứng
D. NaOH không kết tủa được Ca2+, Mg2+ của nước cứng vĩnh cửu ⟹ không thỏa mãn
Nước trong tự nhiên được phân loại thành nước cứng hoặc nước mềm tùy thuộc vào loại và lượng khoáng và muối tự nhiên hòa tan trong đó. Nước cứng có hàm lượng các chất khoáng hòa tan tương đối cao đến rất cao trong khi nước mềm có hàm lượng hòa tan thấp.
Nước cứng là loại nước tự nhiên chứa trên 3 mili đương lượng gam cation canxi (Ca2+) và magie (Mg2+) trong một lít nước. Nước chứa nhiều Mg2+ có vị đắng. Tổng hàm lượng ion Ca2+ và Mg2+ đặc trưng cho tính chất cứng của nước. Độ cứng của nước thiên nhiên dao động rất nhiều và đặc trưng ở nước ngầm.
Hai loại độ cứng phổ biến trong nước là độ cứng tạm thời và độ cứng vĩnh cửu. Độ cứng tạm thời của nước có thể loại trừ bằng việc bổ sung vôi hoặc bằng cách đun sôi, trong khi đó không thể loại bỏ độ cứng vĩnh cửu của nước bằng cách đun sôi, chúng có xu hướng hòa tan hơn khi nhiệt độ tăng và chỉ có thể loại bỏ bằng cách sử dụng hóa chất hoặc các thiết bị khác.
Một loại mẫu nước cứng có chứa các ion Ca2+, Mg2+, HCO3-, Cl-, SO42-. Chất được dùng để làm mềm mẫu nước cứng trên là
Để làm mềm mẫu nước cứng trên ta có thể dùng Na3PO4 vì PO43- kết tủa hết Ca2+ và Mg2+:
3Ca2+ + 2PO43- → Ca3(PO4)2 ↓
3Mg2+ + 2PO43- → Mg3(PO4)2 ↓
Nước trong tự nhiên được phân loại thành nước cứng hoặc nước mềm tùy thuộc vào loại và lượng khoáng và muối tự nhiên hòa tan trong đó. Nước cứng có hàm lượng các chất khoáng hòa tan tương đối cao đến rất cao trong khi nước mềm có hàm lượng hòa tan thấp.
Nước cứng là loại nước tự nhiên chứa trên 3 mili đương lượng gam cation canxi (Ca2+) và magie (Mg2+) trong một lít nước. Nước chứa nhiều Mg2+ có vị đắng. Tổng hàm lượng ion Ca2+ và Mg2+ đặc trưng cho tính chất cứng của nước. Độ cứng của nước thiên nhiên dao động rất nhiều và đặc trưng ở nước ngầm.
Hai loại độ cứng phổ biến trong nước là độ cứng tạm thời và độ cứng vĩnh cửu. Độ cứng tạm thời của nước có thể loại trừ bằng việc bổ sung vôi hoặc bằng cách đun sôi, trong khi đó không thể loại bỏ độ cứng vĩnh cửu của nước bằng cách đun sôi, chúng có xu hướng hòa tan hơn khi nhiệt độ tăng và chỉ có thể loại bỏ bằng cách sử dụng hóa chất hoặc các thiết bị khác.
Trong một cốc nước có chứa 0,01 mol K+, 0,02 mol Ca2+; 0,01 mol Mg2+; 0,05 mol HCO3- và anion X-. Đun nóng cốc đến khối lượng không đổi thu được 3,64 gam chất rắn. Nước trong cốc thuộc loại
- Trong một cốc nước có chứa 0,01 mol K+, 0,02 mol Ca2+; 0,01 mol Mg2+; 0,05 mol HCO3- và anion X-.
- Áp dụng định luật bảo toàn điện tích ⟹ nX- = 0,01.1 + 0,02.2 + 0,01.2 – 0,05.1 = 0,02 mol.
- Xét khi đun nóng cốc nước:
Theo PTHH: 2HCO3-\(\xrightarrow{{{t^0}}}\) CO32- + CO2 ↑ + H2O
⟹ \({n_{C{O_3}^{2 - }}} = \dfrac{{{n_{HC{O_3}^ - }}}}{2} = 0,025(mol)\)
- Sau đun nóng đến khối lượng không đổi trong cốc còn lại các ion 0,01 mol K+, 0,02 mol Ca2+; 0,01 mol Mg2+; 0,025 mol CO32- và 0,02 mol X-.
Ta có: mc/rắn = 0,01.39 + 0,02.40 + 0,01.24 + 0,025.60 + 0,02.MX = 3,64 ⟹ MX = 35,5 (anion là Cl-).
Vậy nước trong cốc chứa các ion Ca2+, Mg2+, Cl- thuộc loại nước cứng toàn phần.
Nước trong tự nhiên được phân loại thành nước cứng hoặc nước mềm tùy thuộc vào loại và lượng khoáng và muối tự nhiên hòa tan trong đó. Nước cứng có hàm lượng các chất khoáng hòa tan tương đối cao đến rất cao trong khi nước mềm có hàm lượng hòa tan thấp.
Nước cứng là loại nước tự nhiên chứa trên 3 mili đương lượng gam cation canxi (Ca2+) và magie (Mg2+) trong một lít nước. Nước chứa nhiều Mg2+ có vị đắng. Tổng hàm lượng ion Ca2+ và Mg2+ đặc trưng cho tính chất cứng của nước. Độ cứng của nước thiên nhiên dao động rất nhiều và đặc trưng ở nước ngầm.
Hai loại độ cứng phổ biến trong nước là độ cứng tạm thời và độ cứng vĩnh cửu. Độ cứng tạm thời của nước có thể loại trừ bằng việc bổ sung vôi hoặc bằng cách đun sôi, trong khi đó không thể loại bỏ độ cứng vĩnh cửu của nước bằng cách đun sôi, chúng có xu hướng hòa tan hơn khi nhiệt độ tăng và chỉ có thể loại bỏ bằng cách sử dụng hóa chất hoặc các thiết bị khác.
Trong một bể nước gia đình, người ta xử lí nước cứng vĩnh cửu bằng cách cho Ca(OH)2 vào bể nước. Biết rằng khi trích mẫu thử nghiên cứu thì người ta phân tích được trong nước có nồng độ các ion Ca2+ 0,004M; Mg2+ 0,003M và HCO3-. Thể tích dung dịch Ca(OH)2 0,02M vừa đủ để xử lí bể nước có thể tích 1000 lít nước cứng thành nước mềm là V lít. Coi như các phản ứng xảy ra hoàn toàn và kết tủa thu được gồm CaCO3 và Mg(OH)2. Giá trị của V là
- Xét 1 lít nước cứng cần xử lí ta có: nCa2+ = 0,004 mol và nMg2+ = 0,003 mol.
- Giả sử số mol Ca(OH)2 cần dùng vừa đủ để xử lí 1 lít nước cứng là x (mol).
Ta có: \({n_{C{a^{2 + }}}} = x + 0,004;{n_{O{H^ - }}} = 2x;{n_{M{g^{2 + }}}} = 0,003\)
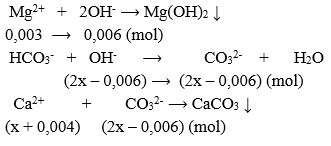
- Lượng Ca(OH)2 cần dùng vừa đủ
⟹ \({n_{C{a^{2 + }}}} = {n_{C{O_3}^{2 - }}} \Rightarrow x + 0,004 = 2x - 0,006 \Rightarrow x = 0,01(mol)\)
- Ta có thể tích dung dịch Ca(OH)2 cần dùng vừa đủ để xử lí 1 lít nước cứng là V(1) = 0,01/0,02 = 0,5 lít.
Vậy thể tích dung dịch Ca(OH)2 cần dùng vừa đủ để xử lí 1000 lít nước cứng là V = 0,5.1000 = 500 lít.

