Có 3 mẫu hợp kim Fe – Al, K – Na, Cu – Mg. Có thể dùng dung dịch nào dưới đây có thể phân biệt 3 mẫu hợp kim trên ?
- dùng dung dịch NaOH
|
|
Fe - Al |
K - Na |
Cu – Mg |
|
NaOH |
Tan 1 phần, sủi bọt khí |
Tan hoàn toàn, sủi bọt khí |
Không tan |
Cho Al đến dư vào dung dịch gồm NO3-, Cu2+, Fe3+, Ag+. Số phản ứng xảy ra (không kể phản ứng của Al với H2O) là
Al + 3Ag+ → Al3+ + Ag
Al + 3Fe3+ → Al3+ + 3Fe2+
2Al + 3Cu2+ → 2Al3+ + 3Cu
2Al + 3Fe2+ → 2Al3+ + 3Fe
Kim loại Al không phản ứng được với dung dịch
Al không phản ứng được với H2SO4 (đặc, nguội).
Quặng nào sau đây có thành phần chính là Al2O3 ?
Quặng hematit đỏ là Fe2O3
Quặng manhetit là Fe3O4
Quặng boxit là Al2O3.2H2O
Quặng criolit là Na3AlF6
Hall và Héroult đã phát minh ra phương pháp sản xuất nhôm bằng cách điện phân nóng chảy Al2O3 trong criolit (Na3AlF6) với điện cực than chì (C). Trong một quá trình điện phân, khí O2 sinh ra ở nhiệt độ cao đã đốt cháy C tạo thành hỗn hợp khí (gồm CO2 và CO) có tỉ khối so với H2 bằng 16. Khối lượng C bị đốt cháy khi sản xuất 8,1 tấn nhôm là:
Bước 1: Tính tỉ lệ nCO2 : nCO
Hỗn hợp khí CO2 (M = 44) và CO (M = 28) có tỉ khối so với H2 bằng 16 ⟹ $\overline M $= 32
Áp dụng sơ đồ đường chéo có: $\dfrac{{{n_{C{O_2}}}}}{{{n_{CO}}}} = \dfrac{{44 - 32}}{{32 - 28}} = \dfrac{3}{1}$
⟹ nCO2 = 3x mol; nCO = x mol
Bước 2: Tính x
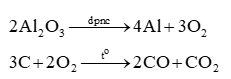
- nAl = 0,3.106 mol ⟹ nO2 = 0,225.106 mol
- BTNT O ta có: nOxi = nCO2 + 2nCO = 3x + 2x = 0,225.106 mol
⟹ x = 0,09.106 mol
Bước 3: Tính mC
BTNT C ta có: nC = nCO2 + nCO = 3x + x = 0,36.106 mol
⟹ mC = 4,32 tấn

