Hall và Héroult đã phát minh ra phương pháp sản xuất nhôm bằng cách điện phân nóng chảy Al2O3 trong criolit (Na3AlF6) với điện cực than chì (C). Trong một quá trình điện phân, khí O2 sinh ra ở nhiệt độ cao đã đốt cháy C tạo thành hỗn hợp khí (gồm CO2 và CO) có tỉ khối so với H2 bằng 16. Khối lượng C bị đốt cháy khi sản xuất 8,1 tấn nhôm là:
Trả lời bởi giáo viên
Bước 1: Tính tỉ lệ nCO2 : nCO
Hỗn hợp khí CO2 (M = 44) và CO (M = 28) có tỉ khối so với H2 bằng 16 ⟹ $\overline M $= 32
Áp dụng sơ đồ đường chéo có: $\dfrac{{{n_{C{O_2}}}}}{{{n_{CO}}}} = \dfrac{{44 - 32}}{{32 - 28}} = \dfrac{3}{1}$
⟹ nCO2 = 3x mol; nCO = x mol
Bước 2: Tính x
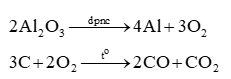
- nAl = 0,3.106 mol ⟹ nO2 = 0,225.106 mol
- BTNT O ta có: nOxi = nCO2 + 2nCO = 3x + 2x = 0,225.106 mol
⟹ x = 0,09.106 mol
Bước 3: Tính mC
BTNT C ta có: nC = nCO2 + nCO = 3x + x = 0,36.106 mol
⟹ mC = 4,32 tấn
Hướng dẫn giải:
Bước 1: Tính tỉ lệ nCO2 : nCO
- Dựa vào tỉ khối hỗn hợp khí CO2 và CO có tỉ khối so với H2 bằng 16.
⟹ Áp dụng sơ đồ đường chéo tính nCO2 : nCO
- Đặt nCO = x mol ⟹ nCO2
Bước 2: Tính x
- Viết các PTHH xảy ra khi sản xuất nhôm.
- Tính nO2 theo nAl.
- BTNT O: nOxi = nCO2 + 2nCO ⟹ x
Bước 3: Tính mC
BTNT C: nC = nCO2 + nCO ⟹ mC

