Chỉ dùng CO2 và nước có thể phân biệt được dãy các chất nào?
Na, K, Ba đều hòa tan trong nước tạo dung dịch kiềm, nếu sục CO2 vào thì sẽ tạo kết tủa với dung dịch Ba(OH)2 => Không nhận biết được Na và K
Tương tự với K, Na, Ca.
Ca, Fe; Cu cho vào nước thì chỉ Ca tan thành Ca(OH)2 và sục CO2 vào thì tạo kết tủa còn Fe và Cu không hiện tượng => Không nhận biết được

Cho các dung dịch sau: NaOH, NaHSO4, K2CO3, Ca(HCO3)2. Đổ lần lượt các dung dịch vào nhau. Số phản ứng xảy ra là
+) NaOH phản ứng với NaHSO4, Ca(HCO3)2
+) NaHSO4 phản ứng với Ca(HCO3)2, K2CO3
+) K2CO3 phản ứng với Ca(HCO3)2
=> có tất cả 5 phản ứng
Chỉ dùng thêm thuốc thử nào dưới đây có thể nhận biết được 3 lọ mất nhãn chứa các dung dịch: H2SO4 , BaCl2, NaCl ?
- dùng quỳ tím
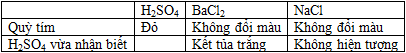
- dùng NaOH thì chỉ có H2SO4 phản ứng dung dịch tạo thành không màu => Không nhận biết được.
- dùng Na2CO3

Cho dãy các chất: NaOH, Ca(NO3)2, SO2 ,Ca(HCO3)2, NaHSO4, Na2SO3. Số chất trong dãy tạo thành kết tủa khi phản ứng với dung dịch BaCl2 là
BaCl2 + 2NaHSO4 → BaSO4↓ + 2HCl + Na2SO4
BaCl2 + Na2SO3 → 2NaCl + BaSO3↓
Cho các cặp chất sau: Mg(HCO3)2 và Ca(OH)2, Ca(OH)2 và NaHCO3,Ca(OH)2 và NH4Cl, CaCl2 và NaHCO3 Số cặp chất xảy ra phản ứng ở điều kiện thường là?
Mg(HCO3)2 + 2Ca(OH)2 → Mg(OH)2 + 2CaCO3 + 2H2O
Ca(OH)2 + NaHCO3 → CaCO3 + NaOH + H2O
Ca(OH)2 + 2NH4Cl → CaCl2 + 2NH3 + 2H2O
=> Số cặp chất xảy ra phản ứng là 3.
Kim loại nào sau đây là kim loại kiềm thổ?
Kim loại kiềm thổ là kim loại thuộc nhóm IIA trong bảng HTTH gồm các nguyên tố: Be, Mg, Ca, Sr,Ba, Ra.
Đun nóng đến khối lượng không đổi hỗn hợp X gồm NaOH, Ca(NO3)2, BaCO3 thu được hỗn hợp chất rắn Y. Thành phần của hỗn hợp Y là
Đun nóng hỗn hợp X có 2 chất bị phân hủy
NaOH không bị phân hủy
Ca(NO3)2 \(\buildrel {{t^0}} \over
\longrightarrow \) Ca(NO2)2 + O2
BaCO3 \(\buildrel {{t^0}} \over
\longrightarrow \)BaO + CO2
Cho dd Ba(OH)2 lần lượt tác dụng với các dd sau: CaCl2, Ca(NO3)2, Ba(HSO4)2 , NaHSO4, Ca(HCO3)2, H2SO4, HCl. Số phản ứng tạo ra kết tủa là
Ba(OH)2 phản ứng với các chất sinh ra kết tủa là: NaHSO4, Ba(HSO4)2, Ca(HCO3)2, H2SO4
Ba(OH)2 + 2NaHSO4 → BaSO4 ↓ + Na2SO4 + 2H2O
Ba(OH)2 + Ba(HSO4)2→ 2BaSO4 ↓ + 2H2O
Ba(OH)2 + H2SO4 → BaSO4 ↓ + 2CO2 + 2H2O
Ba(OH)2 + Ca(HCO3)2 → BaCO3 ↓ + CaCO3 + 2H2O
Cho sơ đồ biến hóa: Ca → X → Y→ Ca(HCO3)2 → T → Ca. Hãy chọn thứ tự đúng của các chất Y, T có thể là
Từ CaCO3 không thể điều chế được Ca từ 1 phương trình => loại C
Từ Ca(OH)2 không thể điều chế trực tiếp ra Ca(HCO3)2 loại A
Sơ đồ biến hóa đúng là : Ca → CaO → CaCO3 → Ca(HCO3)2 → CaCl2 → Ca
PTHH: 2Ca + O2 → 2CaO
CaO + CO2 → CaCO3
CaCO3 + CO2 + H2O → Ca(HCO3)2
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
CaCl2 ![]() Ca + Cl2
Ca + Cl2
Cho các sơ đồ chuyển hóa: X+ BaO → BaCl2 ; BaCl2 + Y → Ba(NO3)2; Ba(NO3)2 + Z → BaCO3. Công thức của chất X, Y, Z lần lượt là
PTHH:
BaO + 2HCl → BaCl2 + H2O
BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓
Ba(NO3)2 + (NH4)2CO3 → BaCO3 + 2NH4NO3
Loại A và D vì Cl2 không tác dụng với BaO
Loại C vì HNO3 không tác dụng với BaCl2
Thạch cao nung có công thức hóa học là:
Thạch cao nung có công thức hóa học là CaSO4.H2O hoặc CaSO4.0,5H2O
Để xác định hàm lượng NO3- trong 200 ml nước mưa, người ta dùng Cu và H2SO4 loãng, thấy lượng đồng cần sử dụng là 1,92 mg. Biết nồng độ ion NO3- tối đa cho phép trong nước mưa dùng để ăn uống là 9 ppm (mg/l). Cho H = 1; N = 14; O = 16; S = 32; Cu = 64. Nhận định nào sau đây đúng?
- PTHH: 3Cu + 8H+ + 2NO3- ⟶ 3Cu2+ + 2NO + 4H2O
- Theo PTHH ⟹ \({n_{N{O_3}^ - }} = \dfrac{2}{3}{n_{Cu}} = {2.10^{ - 5}}(mol) \Rightarrow {\rm{[}}N{O_3}^ - {\rm{]}} = \dfrac{{{{2.10}^{ - 5}}{{.62.10}^3}}}{{0,2}} = 6,2(mg/l)\)
- Nhận thấy [NO3-] = 6,2 ppm < 9 ppm ⟹ Lượng nước mưa này có nồng độ ion NO3- trong khoảng cho phép và có thể sử dụng được ⟹ B đúng.
Giả sử rằng cứ 50000 phân tử nước (chứa trong 4,50.104 lít nước của một trận mưa) hấp thụ một phân tử SO3 và toàn bộ lượng axit sunfuric được tạo ra đều tan hết trong lượng mưa nêu trên. Cho H = 1; O = 16; S = 32; NA = 6,02.1023 và khối lượng riêng của nước là 1,00 g.ml-1. Nồng độ mol/l của axit sunfuric trong nước mưa là
- Ta có: \({m_{{H_2}O}} = V.D = 4,{5.10^4}{.10^3} = 4,{5.10^7}(g) \Rightarrow {n_{{H_2}O}} = \dfrac{{4,{{5.10}^7}}}{{18}} = 2,{5.10^6}(mol)\)
- Cứ 50000 phân tử nước (chứa trong 4,50.104 lít nước của một trận mưa) hấp thụ một phân tử SO3
⟹ \({n_{S{O_3}}} = \dfrac{{{n_{{H_2}O}}}}{{{{5.10}^4}}} = \dfrac{{2,{{5.10}^6}}}{{{{5.10}^4}}} = 50(mol)\)
- Bảo toàn nguyên tố S ⟹ \({n_{{H_2}S{O_4}}} = {n_{S{O_3}}} = 50(mol)\)
Vậy nồng độ mol/l của axit sunfuric trong nước mưa là \({C_{M({H_2}S{O_4})}} = \dfrac{{{n_{{H_2}S{O_4}}}}}{{4,{{5.10}^4}}} = \dfrac{{50}}{{4,{{5.10}^4}}} = 0,0011(mol/l)\)
Phản ứng hóa học nào đã xảy ra trong hiện tượng ăn mòn các bức tượng Caryatid do mưa axit?
Phản ứng hóa học nào đã xảy ra trong hiện tượng ăn mòn các bức tượng Caryatid do mưa axit là
PTHH: CaCO3 + 2H+ ⟶ Ca2+ + CO2 ↑ + H2O.
Từ hai muối X và Y thực hiện các phản ứng sau:
X → X1 + CO2
X1 + H2O → X2
X2 + Y → X3 + Y1 + H 2O
X2 + 2Y → X3 + Y2 + 2H2O
Hai muối X, Y tương ứng là
X phân hủy tạo CO2 => X là CaCO3 hoặc BaCO3
=> X1 là oxit bazơ : MO => X2 là bazơ M(OH)2 tan => loại D
X2 tác dụng với Y theo 2 tỉ lệ tạo 2 chất khác nhau => loại B
X2 tác dụng với Y tạo sản phẩm X2 không phải X => loại C
BaCO3 \(\buildrel {{t^0}} \over
\longrightarrow \)BaO + CO2↑
X X1
BaO + H2O → Ba(OH)2
X2
Ba(OH)2 + NaHSO4 →BaSO4 + NaOH + H2O
Y X3 Y1
Ba(OH)2 + 2NaHSO4 → BaSO4 + Na2SO4 + 2H2O
X3 Y2
Kim loại nào sau đây thuộc nhóm IIA?
Na là kim loại thuộc nhóm IA
Al là kim loại thuộc nhóm IIIA
Fe là kim loại thuộc nhóm VIIIB
Ca là kim loại thuộc nhóm IIA
Kim loại nào sau đây là kim loại kiềm thổ?
Kim loại Ca là kim loại kiềm thổ
Thạch cao nung được dùng để bó bột, đúc tượng do có hiện tượng giãn nở thể tích khi động cứng. Thành phần chính của thạch cao nung chứa.
CaSO4 là thạch cao khan
CaSO4.H2O hoặc CaSO4.0,5H2O là thạch cao nung
CaSO4.2H2O là thạch cao sống
Trong các kim loại sau, kim loại nào không phải là kim loại kiềm thổ?
Na là kim loại kiềm chứ không phải kim loại kiềm thổ
Dãy gồm các chất đều là kim loại kiềm thổ là
Dãy gồm các chất đều là kim loại kiềm thổ là Be, Ca, Sr, Ba

