Cho PTHH : aCuFeS2 + bHNO3 cCu(NO3)2 + dFe(NO3)3 + eH2SO4 + fNO + gH2O
Tổng hệ số của cân bằng là
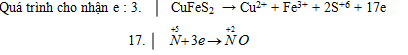
Ta có cân bằng :
3CuFeS2 + 32HNO3 → 3Cu(NO3)2 + 3Fe(NO3)3 + 6H2SO4 + 17NO + 10H2O
→ Hệ số cân bằng là 3+ 32+ 3+ 3+ 6+ 17 + 10= 74
Cho hỗn hợp X gồm Cu, Zn, Fe, Mg tác dụng với oxi dư khi đun nóng thu được chất rắn Y. Cho Y vào dung dịch HCl dư, khuấy kĩ sau đó lấy dung dịch thu được cho tác dụng với dung dịch NaOH loãng dư. Lọc lấy kết tủa tạo thành đem nung trong không khí đến khối lượng không đổi thu được chất rắn Z. Biết các phản ứng xảy ra hoàn toàn. Thành phần của Z gồm
\(\begin{gathered} hhX\left\{ \begin{gathered}Cu \hfill \\ Zn \hfill \\Fe \hfill \\ Mg \hfill \\ \end{gathered} \right.\xrightarrow{{ + {O_2},{t^o}}}\left\{ \begin{gathered} CuO \hfill \\ ZnO \hfill \\ F{e_3}{O_4} \hfill \\ MgO \hfill \\ \end{gathered} \right.\xrightarrow{{ + HCl}}\left\{ \begin{gathered} CuC{l_2} \hfill \\ ZnC{l_2} \hfill \\ FeC{l_2} \hfill \\ FeC{l_3} \hfill \\ MgC{l_2} \hfill \\ \end{gathered} \right. \hfill \\ \xrightarrow{{ + NaOH}}\left\{ \begin{gathered} Cu{(OH)_2} \hfill \\ Fe{(OH)_2} \hfill \\ Fe{(OH)_3} \hfill \\ Mg{(OH)_2} \hfill \\ \end{gathered} \right.\xrightarrow{{ + {O_2},{t^o}}}\left\{ \begin{gathered} CuO \hfill \\ F{e_2}{O_3} \hfill \\ MgO \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} \)
Cho hỗn hợp X gồm Cu, Zn, Fe, Mg tác dụng với oxi dư khi đun nóng thu được chất rắn Y. Cho Y vào dung dịch HCl dư, khuấy kĩ sau đó lấy dung dịch thu được cho tác dụng với dung dịch NaOH loãng dư. Lọc lấy kết tủa tạo thành đem nung trong không khí đến khối lượng không đổi thu được chất rắn Z. Biết các phản ứng xảy ra hoàn toàn. Thành phần của Z gồm
\(hhX\left\{ \matrix{
Cu \hfill \cr
Zn \hfill \cr
Fe \hfill \cr
Mg \hfill \cr} \right.\buildrel { + {O_2},{t^0}} \over
\longrightarrow \left\{ \matrix{
CuO \hfill \cr
ZnO \hfill \cr
F{e_3}{O_4} \hfill \cr
MgO \hfill \cr} \right.\buildrel { + HCl} \over
\longrightarrow \left\{ \matrix{
CuC{l_2} \hfill \cr
Fe{(OH)_2} \hfill \cr
Fe{(OH)_3} \hfill \cr
Mg{(OH)_2} \hfill \cr} \right.\buildrel { + {O_2},{t^0}} \over
\longrightarrow \left\{ \matrix{
CuO \hfill \cr
F{e_2}{O_3} \hfill \cr
MgO \hfill \cr} \right.\)
Cho sơ đồ sau : Cu → X1 → X2 → X3 → X4 → Cu. Dãy chất nào sau đây có thể tương ứng với X1, X2, X3, X4 ?
CuS không thể điều chế CuCl2 bằng 1 phản ứng => B sai
CuCl2 không thể điều chế CuO bằng 1 phản ứng => C, D sai
Cu → CuSO4 → CuCl2 → CuS → CuO → Cu
Cho 3,2 gam bột Cu tác dụng với 100 ml dung dịch hỗn hợp gồm HNO3 0,8M và H2SO4 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được V lít khí NO (sản phẩm khử duy nhất, đktc). Tính V.
Ta có:
\({n_{Cu}} = \frac{{3,2}}{{64}} = 0,05\left( {mol} \right)\)
\({n_{{H^ + }}} = {n_{HN{O_3}}} + 2{n_{{H_2}S{O_4}}} = 0,08 + 2.0,02 = 0,12\left( {mol} \right)\)
\({n_{N{O_3}^ - }} = {n_{HN{O_3}}} = 0,08\left( {mol} \right)\)
PT ion thu gọn:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Ban đầu: 0,05 0,12 0,08
Ta thấy: \(\frac{{0,05}}{3} > \frac{{0,12}}{8} < \frac{{0,08}}{2}\) → H+ hết, phản ứng tính theo H+
Theo PTHH: nNO = 1/4.nH+ = 1/4.0,12 = 0,03 mol
⟹ VNO = 0,03.22,4 = 0,672 (lít)
Cho hỗn hợp X gồm 2,8 gam Fe và 3,6 gam Mg vào 200 ml dung dịch CuSO4 x (mol/lít). Sau khi các phản ứng xảy ra hoàn toàn thu được 12,4 gam chất rắn. Giá trị của x là
nFe = 2,8 : 56 = 0,05 (mol)
nMg = 3,6 : 24 = 0,15 (mol)
Nếu chỉ có Mg phản ứng thì m rắn thu được = mCu + mFe = 0,15.64 + 2,8 = 12,4 (g)
Nếu cả Mg và Fe cùng phản ứng hết thì mrắn = mCu = (0,05 + 0,15)64 = 12,8 (g)
Theo đề bài ta thấy mrắn thu được = 12,4 đúng với trường hợp chỉ có Mg phản ứng, Fe chưa phản ứng
PTHH: Mg + CuSO4 → MgSO4 + Cu↓
0,15 → 0,15 (mol)
→ nCuSO4 = nMg = 0,15 (mol) → CM = 0,15 : 0,2 = 0,75 (M)
Kim loại Cu tan được trong dung dịch nào sau đây?
Cu tan được trong dd HNO3
VD: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng ?
Kim loại không tác dụng với dung dịch H2SO4 loãng là Cu
Để nhận biết ba axit đặc nguội HCl, H2SO4, HNO3 đựng riêng biệt trong ba lọ bị mất nhãn, ta dùng thuốc thử
A, C sai vì Fe và Al bị thụ động hóa trong H2SO4 đặc nguội và HNO3 đặc nguội.
B sai vì CuO tác dụng với 3 axit đều tạo dung dịch màu xanh và không có khí thoát ra
D đúng vì
Cu + HCl → không phản ứng
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
Khí mùi hắc
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
Khí màu nâu
Cho Cu lần lượt tác dụng hết với mỗi chất oxi hóa dưới đây có cùng số mol. Trường hợp nào thu được số mol Cu(II) nhỏ nhất ?
PTHH :
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O
0,25 ← 1 → 0,25
2Cu + O2 $\xrightarrow{{{t}^{o}}}$ 2CuO
1 → 2
Cu + Cl2 $\xrightarrow{{{t}^{o}}}$ CuCl2
1 → 1
Cu + 2H2SO4 đặc → CuSO4 + SO2 + 2H2O
1 → 0,5
Cu bị hòa tan trong nước cường toan (tỉ lệ mol của HCl và HNO3 là 3 : 1) và giải phóng khí NO. Tổng hệ số cân bằng (khi tối giản) là
Phương trình hóa học : 3Cu + 6HCl + 2HNO3 → 3CuCl2 + 2NO + 4H2O
→ tổng hệ số cân bằng : 3 + 6 + 2 + 3 + 2 + 4 = 20
Cho các dung dịch loãng : (1) FeCl3, (2) FeCl2, (3) H2SO4, (4) HNO3, (5) hỗn hợp gồm HCl và NaNO3. Những dung dịch phản ứng được với Cu là
Những dung dịch phản ứng được với Cu là (1) FeCl3; (4) HNO3; (5) hỗn hợp HCl và NaNO3
Để khử ion trong dung dịch CuSO4 có thể dùng kim loại nào sau đây ?
Để khử ion trong dung dịch CuSO4 có thể dùng kim loại Fe
Vì Na, Ba khi tan vào nước tạo kết tủa với CuSO4
Ag không khử được ion Cu2+
Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sunfuric loãng đun nóng là vì
Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sunfuric loãng đun nóng là vì phản ứng tạo dung dịch có màu xanh và khí không màu hóa nâu trong không khí.
Cho các phản ứng chuyển hóa quặng thành Cu:
CuFeS2 + O2 $\xrightarrow{{{t}^{o}}}$ X X + O2 $\xrightarrow{{{t}^{o}}}$Y Y + X $\xrightarrow{{{t}^{o}}}$ Cu
Hai chất X và Y lần lượt là
Ta có: 2Cu2O + Cu2S → 6Cu + SO2
=> X là Cu2S; Y là Cu2O
Có thể phát hiện ra dấu vết của nước trong ancol etylic bằng cách dùng
Có thể phát hiện ra dấu vết của nước trong ancol etylic bằng cách dùng CuSO4 khan vì
CuSO4 + nH2O → CuSO4.nH2O
Trắng xanh
Trong không khí ẩm, kim loại đồng bị bao phủ bởi lớp màng
Trong không khí ẩm, kim loại đồng bị bao phủ bởi lớp màng CuCO3.Cu(OH)2 (màu xanh).
Thêm NH3 đến dư vào dung dịch hỗn hợp chứa MgCl2, AlCl3, FeCl3 và CuCl2 thu được kết tủa X. Cho X vào dung dịch NaOH dư, còn lại chất rắn không tan Z. Chất rắn Z là
$\left\{ \begin{gathered}MgC{l_2} \hfill \\AlC{l_3} \hfill \\FeC{l_3} \hfill \\CuC{l_2} \hfill \\ \end{gathered} \right.\xrightarrow{{N{H_3}}}\left\{ \begin{gathered}Mg{(OH)_2} \hfill \\Al{(OH)_3} \hfill \\Fe{(OH)_3} \hfill \\Cu{(OH)_2} \hfill \\ \end{gathered} \right.\xrightarrow{{N{H_3}}}\left\{ \begin{gathered}Mg{(OH)_2} \hfill \\Al{(OH)_3} \hfill \\Fe{(OH)_3} \hfill \\ \end{gathered} \right.\xrightarrow{{NaOH}}\left\{ \begin{gathered}Mg{(OH)_2} \hfill \\Fe{(OH)_3} \hfill \\ \end{gathered} \right.$
Cho các chất sau: CuO, Cu2O, CuSO4, Cu(NO3)2, [Cu(NH3)4](OH)2, Cu. Số chất có thể điều chế trực tiếp từ Cu(OH)2 là
Các chất có thể điều chế trực tiếp từ Cu(OH)2 là CuO, Cu2O, CuSO4, Cu(NO3)2, [Cu(NH3)4](OH)2
Cho các hợp chất: CuS, CuO, Cu2O, CuCO3, Cu2S lần lượt phản ứng với dung dịch H2SO4 đặc, nóng, dư. Số phản ứng oxi hóa khử xảy ra là
Các chất tác dụng với H2SO4 đặc nóng xảy ra phản ứng oxi hóa khử là: CuS, Cu2O, Cu2S.

