Hòa tan hết 14,8 gam hỗn hợp Fe và Cu vào 126 gam dung dịch HNO3 48% thu được dung dịch X (không chứa muối amoni ). Cho X phản ứng với 400 ml dung dịch NaOH 1M và KOH 0,5M thu được kết tủa Y và dung dịch Z. Nung Y trong không khí đến khối lượng không đổi thu được 20 gam CuO và Fe2O3. Cô cạn dung dịch Z, thu được chất rắn khan T. Nung T trong không khí đến khối lượng không đổi thu được 42,86 gam hỗn hợp chất rắn. Nồng độ phần trăm của Fe(NO3)3 trong X có giá trị gần nhất với giá trị nào sau đây ?
nHNO3 = 0,96 mol và nNaOH = 0,4 mol, nKOH = 0,2
đặt nFe = x mol và nCu = y mol
Bảo toàn nguyên tố có nFe2O3 = ½ . nFe = ½ .x
nCuO = nCu = y
Ta có hệ phương trình sau 56x + 64 y = 14,8 gam và 80x + 80y = 20
→ x = 0,15 mol và y = 0,1 mol
Nếu dung dịch Z chỉ chứa 2 muối NaNO3 và KNO3 thì khi đun nóng thu được KNO2 và NaNO2
Bảo toàn nguyên tố có nNaNO2 = nNaOH = 0,4 và nKOH = 0,2 = nKNO2
→ mrắn = 0,4.69 +0,2. 85 = 44,6 gam > 42,86 nên Z còn chứa cả NaOH và KOH
Z chứa : Na+ : 0,4 mol; K+ : 0,2 mol; OH- : a mol và NO3- : b mol
Bảo toàn điện tích có 0,4 + 0,2 = a + b (*)
Đun nóng Z có 0,4 mol Na ; K+ : 0,2 mol; OH- : a mol và NO2- : b mol
→ 17a + 46b + 0,2.39 + 0,4.23 = 42,86 (**)
Từ (*) và (**) → a = 0,06 và b = 0,54
→ dd X chứa Fe2+ : c mol; Fe3+ : d mol và Cu2+ : 0,1 mol; NO3- : 0,54 mol (cùng bằng lượng NO3- trong Z )
Bảo toàn điện tích có 2c + 3d + 0,1.2 = 0,54 (***)
Bảo toàn Fe có c + d =0,15 (****)
Từ (***) và (****) → c = 0,11 và d =0,04 mol
Bảo toàn nguyên tố có nN (sp khử) = nHNO3 – nNO3(Y) = 0,96 – 0,54 =0,42 mol
Quy đổi khí sản phẩm khử là N : 0,42 mol và O : e mol
Bảo toàn e có 2nFe(2+) + 3nFe(3+) + 2nCu(2+) -2nO = 5nN
→ 5.0,42 = 2.0,11 +3.0,04 + 0,1.2 +2e
→ e =0,78 mol
Bảo toàn khối lượng mdd X =mKL +mHNO3 – mN – mO
= 14,8 + 126 – 0,42.14 – 0,78.16 =122,44 g
Nồng độ % của Fe(NO3)3 là : \(\dfrac{{0,04.242}}{{122,44}}.100\% = 7,9\% \)
Cho các thí nghiệm sau:
(a) Sục khí CO2 vào dung dịch natri aluminat
(b) Cho dung dịch NH3 dư vào dung dịch AlCl3
(c) Sục khí H2S vào dung dịch AgNO3 loãng dư
(d) Cho dung dịch NaOH dư vào dung dịch AlCl3
(e) Cho dung dịch NaOH dư vào dung dịch Ba(HCO3)2
(g) Cho stiren dung dịch KMnO4
(h) Cho dung dịch NaI vào dung dịch H2SO4 đậm đặc
Số thí nghiệm thu được kết tủa sau phản ứng là
(a) CO2 +NaAlO2 + 2H2O → NaHCO3 + Al(OH)3↓→ kết tủa Al(OH)3
(b) 3NH3 + AlCl3 + 3H2O → NH4Cl + Al(OH)3↓→ kết tủa Al(OH)3
(c) không xảy ra
(d) 4NaOH + AlCl3 → NaAlO2 + 3NaCl + 2H2O → Không tạo kết tủa
(e) 2NaOH + Ba(HCO3)2 → BaCO3↓ + Na2CO3 + 2H2O → tạo kết tủa BaCO3
(g) 3C6H5CH=CH2 + 10KMnO4 → 3C6H5COOK + 3K2CO3 + 10MnO2↓ + 4KOH + 4H2O → kết tủa MnO2
(h) 8NaI + 5H2SO4 đậm đặc → 4Na2SO4 + 4H2O + H2S + 4 I2↓ → kết tủa I2
Số thí nghiệm thu được kết tủa sau phản ứng là 5
Thực hiện thí nghiệm điều chế khí X, khí X thu được vào bình tam giác theo hình vẽ bên.
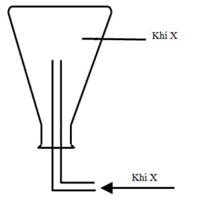
Thí nghiệm đó là
Ta thấy khí X thu bằng cách úp bình => khí X có phân tử khối nhẹ hơn không khí
A. H2SO4 + Zn → ZnSO4 + H2↑
B. 2HCl + CaCO3↓ → CaCl2 + CO2↑ + H2O
C. 14HCl đặc + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O
D. 2H2SO4 đặc + Cu → CuSO4 + SO2↑ + 2H2O
Trong tất cả các khí trên, chỉ có H2 là khí thỏa mãn nhẹ hơn không khí
Cho 5 chất: NaOH, HCl, AgNO3, HNO3, Cl2. Số chất tác dụng được với dung dịch Fe(NO3)2 là
Tất cả 5 chất đều có pư với Fe(NO3)2
2NaOH + Fe(NO3)2 → Fe(OH)2↓ + NaNO3
12HCl + 9Fe(NO3)2 → 5Fe(NO3)3 + 4FeCl3 + 3NO + 6H2O
AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
4HNO3 + 3Fe(NO3)2 → 3Fe(NO3)3 + NO + H2O
3Cl2 + 6Fe(NO3)2 → 2Fe(NO3)3 + 2FeCl3
Dung dịch nào sau đây tác dụng với dung dịch Ba(HCO3)2 vừa thu được kết tủa, vừa có khí thoát ra
A. sai vì chỉ tạo khí CO2.
2HCl + Ba(HCO3)2 → BaCl2 + 2CO2↑ + 2H2O
B. sai vì chỉ tạo kết tủa BaCO3
2NaOH + Ba(HCO3)2 → BaCO3↓ + Na2CO3 + 2H2O
C. đúng vì Ba(HCO3)2 + H2SO4 → BaSO4↓ + 2H2O + 2CO2↑
D. sai vì chỉ có kết tủa là CaCO3 và BaCO3
Ca(OH)2 + Ba(HCO3)2 → BaCO3↓ + CaCO3↓ + 2H2O
Thực hiện các thí nghiệm sau
(a) Sục khí CO2 dư vào dung dịch BaCl2
(b) Cho dung dịch NH3 dư vào dung dịch AlCl3
(c) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3
(d) Cho hỗn hợp Na2O và Al2O3 (tỉ lệ mol 1:1) vào nước dư
(e) Cho dung dịch Ba(OH)2 dư vào dung dịch Cr2(SO4)3
(f) Cho hỗn hợp bột Cu và Fe3O4 (tỉ lệ mol 1:1) vào dung dịch HCl dư
Sau khi các phản ứng xảy ra, số thí nghiệm thu được kết tủa là
(a) Phản ứng không xảy ra
(b) Phản ứng tạo kết tủa Al(OH)3 do 3NH3 + AlCl3 +H2O → 3NH4Cl + Al(OH)3
(c) Phản ứng tạo kết tủa là Ag do Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
(d) Phản ứng không tạo kết tủa do : Na2O + H2O → 2NaOH và Al2O3 +2NaOH → 2NaAlO2 + H2O
(e) Phản ứng tạo kết tủa : 4Ba(OH)2 + Cr2(SO4)3 → 3BaSO4 + Ba(CrO2)2 + 4H2O
(f) Phản ứng không tạo kết tủa do : Fe3O4 + 8HCl → 2FeCl3 + FeCl2 +4H2O; 2FeCl3 + Cu → 2FeCl2 + CuCl2
Số thí nghiệm thu được kết tủa là 3
Cho dung dịch NaOH vào dung dịch X, thu được kết tủa màu nâu đỏ. Chất X là
X là FeCl3 vì FeCl3 + 3NaOH → 3NaCl + Fe(OH)3 là kết tủa màu nâu đỏ
Kết quả thí nghiệm của chất vô cơ X với thuốc thử được ghi ở bảng sau:

Kết luận nào sau đây không chính xác?
X làm dd phenolphtalein chuyển sang màu hồng => X là chất có môi trường bazo
X phản ứng với Cl2 tạo khói trắng => X + HCl tạo ra chất có dạng RNH3Cl (khói trắng)
=> X là NH3
A. đúng vì phân đạm cung cấp nguyên tố dinh dưỡng nito cho cây trồng.
B. đúng
C. đúng, từ NH3 có thể sản xuất ra NH4HCO3 dùng làm bột nở trong công nghiệp sản xuất bánh kẹo.
D. Sai vì Al(OH)3 không tan khi cho dd NH3 dư
3NH3 + AlCl3 + 3H2O → 3NH4Cl + Al(OH)3↓
Ba dung dịch X, Y, Z thỏa mãn:
- X tác dụng với Y thì có kết tủa xuất hiện:
- Y tác dụng với Z thì có kết tủa xuất hiện:
- X tác dụng với Z thì có khí bay ra
X, Y, Z lần lượt là
A. Loại vì X + Z không có khí bay ra
B. Thỏa mãn
X+ Y có kết tủa: NaHSO4 + BaCl2 → BaSO4↓trắng + NaCl + HCl
Y + Z có kết tủa: BaCl2 + Na2CO3 → BaCO3↓ trắng + 2NaCl
X + Z có khí bay ra: 2NaHSO4 + Na2CO3 → 2Na2SO4 + CO2↑ + H2O
C. Loại vì X + Z không có khí bay ra
D. Loại vì Y + Z không có kết tủa.
Cho các phát biểu sau:
(a) Các oxit của kim loại kiềm, kim loại kiềm thổ phản ứng với CO tạo thành kim loại.
(b) Nhúng thanh Cu vào dung dịch Zn(NO3)2 xảy ra ăn mòn điện hóa.
(c) Các kim loại Mg, K và Fe đều khử được ion Ag+ trong dung dịch thành Ag.
(d) Cho Mg dư vào dung dịch FeCl3 thu được Fe.
(e) Để bảo vệ tàu biển bằng thép, người ta thường gắn vào vỏ tàu (phần ngâm dưới nước) những tấm Zn
(g) Các kim loại Ca, Fe, Al và K chỉ điều chế được bằng phương pháp điện phân nóng chảy.
Số phát biểu đúng là
(a) sai, chỉ có các oxit sau Al trong dãy điện hóa học của kim loại mới có phản ứng với CO tạo ra kim loại.
(b) sai, không có xảy ra ăn mòn điện hóa vì Cu không có phản ứng với dd Zn(NO3)2
(c) sai, K không khử được ion Ag+ trong dung dịch thành Ag.
(d) đúng
(e) đúng
(g) sai, Fe còn điều chế được bằng pp nhiệt luyện hoặc thủy luyện hoặc điện phân dung dịch.
=> có 2 phát biểu đúng
Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư;
(b) Sục khí Cl2 vào dung dịch FeCl2;
(c) Dẫn khí H2 dư qua bột CuO nung nóng;
(d) Cho Na vào dung dịch MgSO4 dư;
(e) Nhiệt phân Cu(NO3)2;
(g) Đốt FeS2 trong không khí;
(h) Điện phân dung dịch AgNO3 với điện cực trơ;
(i) Cho AgNO3 vào dung dịch Fe(NO3)2 dư;
(k) Sục khí CO2 dư vào dung dịch muối natri aluminat.
Sau khi kết thúc phản ứng, số thí nghiệm thu được kim loại là
(a) 3Mg + 3Fe2(SO4)3 dư → 3MgSO4 + 6FeSO4 => không thu được kim loại
(b) Cl2 + FeCl2 → FeCl3 => không thu được kim loại
(c) H2 + CuO \(\xrightarrow{{{t}^{o}}}\) Cu + H2O => thu được kim loại Cu
(d) 2Na + 2H2O → 2NaOH + H2; 2NaOH + MgSO4 dư → Mg(OH)2 + Na2SO4 => không thu được kim loại
(e) 2Cu(NO3)2 \(\xrightarrow{{{t}^{o}}}\) 2CuO + 4NO2 + O2 => không thu được kim loại
(g) 4FeS2 + 11O2 \(\xrightarrow{{{t}^{o}}}\) 2Fe2O3 + 8SO2 => không thu được kim loại
(h) 4AgNO3 + 2H2O \(\xrightarrow{dp\text{dd}}\) 4Ag + 4HNO3 + O2 => thu được kim loại Ag
(i) AgNO3 + Fe(NO3)2 dư → Fe(NO3)3 + Ag => thu được kim loại Ag
(k) CO2 dư + NaAlO2 + 2H2O → Al(OH)3 + NaHCO3 => không thu được kim loại
Vậy có 3 thí nghiệm thu được kim loại sau phản ứng.
Cho các dung dịch sau: Na2CO3; Na2S,CuS, Na2SO4, Fe(NO3)2, FeSO4, Fe(NO3)3 , CH3NH3HCO3, CH3COONa lần lượt vào dung dịch HCl. Số trường hợp có khí thoát ra là
PTHH: 2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
2HCl + Na2S → NaCl + H2S↑
12HCl + 9Fe(NO3)2 → 4FeCl3 + 6H2O +3NO↑ + 5Fe(NO3)3
CH3NH3HCO3 + HCl → CH3NH3Cl + H2O + CO2↑
=> có 4 thí nghiệm
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch Ba(OH)2 tới dư vào dung dịch FeCl2.
(b) Cho dung dịch KHSO4 vào dung dịch BaCl2
(c) Cho dung dịch Na2S vào dung dịch Fe2(SO4)3.
(d) Sục khí CO2 tới dư vào dung dịch NaAlO2.
(e) Cho kim loại Zn vào lượng dư dung dịch FeCl3.
(f) Sục khí SO2 vào lượng dư dung dịch Ba(OH)2.
(g) Sục khí NH3 dư vào dung dịch CuSO4.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là
(a) Ba(OH)2 + FeCl2 → Fe(OH)2↓ + BaCl2
(b) 2KHSO4 + BaCl2 → BaSO4↓ + K2SO4 + 2HCl
(c) 3Na2S + Fe2(SO4)3 + 6H2O → 2Fe(OH)3↓ + 3Na2SO4 + 3H2S↑
(d) CO2 dư + H2O + NaAlO2 → Al(OH)3↓ + NaHCO3
(e) Zn + 2FeCl3 → ZnCl2 + 2FeCl2
(f) SO2 + Ba(OH)2 dư → BaSO3↓ + H2O
(g) 6NH3 dư + CuSO4 + 2H2O → [Cu(NH3)4](OH)2 + (NH4)2SO4
→ có 5 thí nghiệm thu được kết tủa là (a), (b), (c), (d), (f)
Nhỏ dung dịch NH3 dư vào dung dịch chứa AlCl3, FeCl2 và CuCl2 thu được kết tủa X. Nung X trong không khí đến phản ứng hoàn toàn được chất rắn Y. Y là
\(N{H_3} + \left\{ \matrix{
AlC{l_3} \hfill \cr
FeC{l_2} \hfill \cr
CuC{l_2} \hfill \cr} \right.\buildrel {} \over
\longrightarrow X\left\{ \matrix{
Al{(OH)_3} \hfill \cr
Fe{(OH)_2} \hfill \cr} \right.\buildrel {{t^0}} \over
\longrightarrow Y\left\{ \matrix{
A{l_2}{O_3} \hfill \cr
F{e_2}{O_3} \hfill \cr} \right.\)
Thực hiện các thí nghiệm sau
(a) Đun nóng hỗn hợp bột Fe dư và H2SO4 loãng
(b) Cho Fe vào dung dịch KCl
(c) Cho Fe(OH)2 vào dung dịch HNO3 loãng dư
(d) Đốt dây sắt trong Cl2
(e) Cho Fe3O4 vào dung dịch H2SO4 loãng dư
Số thí nghiệm có tạo ra muối sắt II là
(a) Fe dư + H2SO4 loãng → FeSO4 + H2 => tạo muối FeSO4
(b) không phản ứng
(c) 3Fe(OH)2 + 10HNO3 → 3Fe(NO3)3 + NO + 8H2O => tạo muối Fe(NO3)3
(d) Fe + Cl2 \(\xrightarrow{{{t^0}}}\) FeCl3 => tạo muối FeCl3
(e) Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O => tạo 2 muối FeSO4 và Fe2(SO4)3
Số thí nghiệm có tạo ra muối sắt II là 2
Chất nào sau đây không bị nhiệt phân?
A. CaCO3 \(\xrightarrow{{{t^0}}}\) CaO + CO2↑
B. Cu(NO3)2 \(\xrightarrow{{{t^0}}}\) CuO + NO2 + O2↑
C. Na2CO3 không bị nhiệt phân
D. NH4HCO3 \(\xrightarrow{{{t^0}}}\) NH3 + CO2 + H2O
Cho các phát biểu sau:
(a) Điện phân dung dịch NaCl (điện cực trơ), thu được H2 ở catot.
(b) Cho CO dư qua hỗn hợp Al2O3 và CuO đun nóng, thu được Al và Cu.
(c) Nhúng thanh Zn vào dung dịch chứa CuSO4 và H2SO4, có thể xuất hiện ăn mòn điện hóa.
(d) Kim loại có nhiệt độ nóng chảy thấp nhất là Hg, kim loại dẫn điện tốt nhất là Ag.
(e) Cho dung dịch AgNO3 dư vào dung dịch FeCl2, thu được chất rắn gồm Ag và AgCl.
Số phát biểu đúng là
(a) đúng \(2NaCl + 2{H_2}O\buildrel {} \over\longrightarrow 2NaOH + C{l_2}(anot) + {H_2}(catot)\)
(b) Sai vì CO không khử được Al2O3
(c) đúng vì khi đó hình thành 2 cặp oxi hóa khử khác nhau là Zn2+/Zn và Cu2+/Cu cùng nhúng trong 1 dung dịch chất điện li là H2SO4 => hình thành ăn mòn điện hóa.
(d) đúng
(e) đúng, 3AgNO3 + FeCl2 → Fe(NO3)3 + 2AgCl↓ + Ag↓
=> có 4 phát biểu đúng
Cho các phát biểu sau:
(a) Trong không khí ẩm, bề mặt của gang bị ăn mòn điện hóa.
(b) Ở điều kiện thường, tất cả các kim loại đều tồn tại ở trạng thái rắn.
(c) Nguyên tắc điều chế kim loại là khử ion kim loại thành nguyên tử.
(d) Bán kính của nguyên tử kim loại luôn lớn hơn bán kính của nguyên tử phi kim.
Số phát biểu đúng là
(a) Đúng vì hình thành cặp điện cực Fe - C nên bề mặt gang bị ăn mòn điện hóa.
(b) Sai, Hg là kim loại duy nhất tồn tại ở trạng thái lỏng ở điều kiện thường.
(c) Đúng.
(d) Sai, còn phụ thuộc vào điện tích hạt nhân, số lớp e...
→ Có 2 phát biểu đúng.
Hình vẽ sau mô tả thí nghiệm điều chế khí Z:
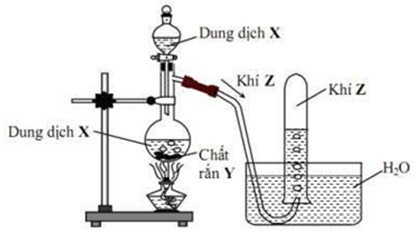
Phương trình hóa học điều chế khí Z là
NH3, SO2, Cl2 tan được trong nước và tác dụng với nước. Do đó ta không thể sử dụng phương pháp đẩy nước để thu các khí này.
Thực hiện các thí nghiệm sau:
(a) Nhiệt phân tinh thể KNO3.
(b) Đun nóng nước cứng vĩnh cửu.
(c) Cho kim loại K vào dung dịch AlCl3.
(d) Hòa tan hỗn hợp gồm Na2O và Al vào nước.
(e) Nhỏ dung dịch NaHSO4 vào dung dịch NaHS.
Số thí nghiệm có tạo ra chất khí là
(a) KNO3 \(\xrightarrow{{{t^0}}}\) KNO2 + 1/2O2↑
(b) Không có phản ứng xảy ra.
(c) K + H2O → KOH + 1/2H2↑
3KOH + AlCl3 → Al(OH)3↓ + KCl
có thể xảy ra thêm phản ứng: KOH + Al(OH)3 → KAlO2 + 2H2O
(d) Na2O + H2O → 2NaOH
Al + NaOH + H2O → NaAlO2 + 3/2H2↑
(e) NaHSO4 + NaHS → Na2SO4 + H2S↑
→ Có 4 thí nghiệm có khí thoát ra là (a), (c), (d), (e)

