Đốt cháy hoàn toàn một amin no, đơn chức, mạch hở, bậc 2 thu được CO2 và H2O với tỷ lệ mol tương ứng là 2 : 3. Tên gọi của amin đó là:
Đặt công thức của amin no, đơn chức, mạch hở là: CnH2n+1NH2
Đặt mol CO2 = 2(mol) → mol H2O = 3 (mol)
2CnH2n+3N → 2nCO2 + 2(n+1,5)H2O + N2
Ta có: nAmin = (nH2O - nCO2)/1,5 = (3 - 2)/1,5 = 2/3 (mol)
=> n = nCO2/ namin = 2/ (2/3) = 3
→ CTPT amin là C3H9N
Amin bậc 2 nên CTCT của amin là: CH3-NH-C2H5: etylmetylamin
Đốt cháy hoàn toàn một amin no, đơn chức, mạch hở thu được 4,48 lít CO2 và 4,95 gam nước. CÔng thức phân tử của amin X là:
nCO2(đktc) = 4,48 : 22,4 = 0,2 (mol)
nH2O = 4,95 : 18 = 0,275 (mol)
Đặt công thức amin no đơn chức mạch hở là CnH2n+3N: a (mol)
CnH2n+3N → nCO2 + (n+1,5)H2O
a a a(n+1,5) (mol)
\(\begin{gathered}{n_{a\min }} = \dfrac{{{n_{{H_2}O}} - {n_{C{O_2}}}}}{{1,5}} = \frac{{0,275 - 0,2}}{{1,5}} = 0,05\,(mol) \hfill \\ \to n = \dfrac{{{n_{C{O_2}}}}}{{{n_{a\min }}}} = \frac{{0,2}}{{0,05}} = 4 \hfill \\ \end{gathered} \)
Vậy công thức amin là C4H11N
Đốt cháy hòa toàn hỗn hợp hai amin no, đơn chức, kế tiếp nhau trong dãy đồng đẳng, thu được 1,568 lít khí CO2 (đktc) và 1,8 gam H2O. Số đồng phân cấu tạo thuộc loại amin bậc hai của hai amin đó là:
Đặt công thức của hh 2 amin no, đơn chức, kế tiếp nhau trong dãy đồng đẳng là: \({C_{\overline n }}{H_{2\overline n + 3}}N\)
PTHH: \({C_{\overline n }}{H_{2\overline n + 3}}N + {O_2}\xrightarrow{{{t^0}}}\overline n C{O_2} + (\overline n + 1,5){H_2}O\)
nCO2(đktc) = 1,568/22,4 = 0,07 (mol)
nH2O = 1,8/18 = 0,1 (mol)
Ta có: namin = (nH2O – nCO2)/1,5 = (0,1- 0,07)/1,5 = 0,02 (mol)
\(\overline n = \frac{{{n_{C{O_2}}}}}{{n\,a\min }} = \frac{{0,07}}{{0,02}} = 3,5\)
Vì 2 amin đồng đẳng kế tiếp nên CTPT 2 amin là C3H9N và C4H11N
CTCT amin bậc 2 của C3H9N: CH3CH2-NH-CH3
CTCT amin bậc 2 của C4H11N: CH3-CH2-CH2-NH-CH3; CH3-CH(CH3)-NH-CH3; C2H5-NH-C2H5
→ Tổng có 4 CTCT thỏa mãn.
Đốt cháy hoàn toàn hỗn hợp M gồm hai amin no, đơn chức, mạch hở X và Y (có số mol bằng nhau, MX < MY) cần lượng vừa đủ 13,44 lít O2, thu được H2O, N2 và 6,72 lít CO2. Chất Y là:
Ta có: nO2 = 0,6 mol; nCO2 = 0,3 mol
Bảo toàn nguyên tố O ta có 2nO2 = 2nCO2 + nH2O → nH2O = 0,6 mol
Đặt công thức chung của 2 amin no, đơn chức, mạch hở X và Y là CnH2n+3N
CnH2n+3N + (3n/2+3/4) O2 → nCO2 + (2n+3)/2 H2O
Suy ra nM = (nH2O - nCO2)/1,5 = 0,2 mol
Suy ra số nguyên tử C = nCO2/nM =0,3: 0,2 = 1,5
Do hai chất có cùng số mol nên X là CH5N và Y là C2H7N (etylamin).
Đáp án A
Đốt cháy hoàn toàn amin đơn chức X, thu được 16,8 lít CO2; 2,8 lít N2 (đktc) và 20,25 gam H2O. Công thức phân tử của X là:
Ta có: nCO2 = 0,75 mol; nN2 = 0,125 mol; nH2O = 1,125 mol
Bảo toàn nguyên tố N ta có: nN (X) = 2.nN2 = 0,25 mol
Bảo toàn nguyên tố C ta có: nC (X) = nCO2 = 0,75 mol
Bảo toàn nguyên tố H ta có: nH (X) = 2.nH2O = 2.1,125 = 2,25 mol
Gọi công thức phân tử của amin X là CxHyNz (x, y, z là số nguyên).
Ta có: x : y : z = nC : nH : nN = 0,75 : 2,25 : 0,25 = 3 : 9 : 1
Do amin đơn chức nên công thức phân tử của amin X là C3H9N.
Đốt cháy hoàn toàn amin X no, đơn chức, mạch hở, thu được 0,2 mol CO2 và 0,05 mol N2. Công thức phân tử của X là
Vì X là amin đơn chức nên \(n_X=2n_{N_2}=2\times0,5=0,1\) mol
X là amin no đơn chức mạch hở nên X có CTPT là CnH2n+3N : 0,1 mol
\(n=\dfrac{{n_{CO_2}}}{{n_{amin}}} = \dfrac{{0,2}} {{0,1}}= 2 \)→ X là C2H7N
Amin X có công thức phân tử trùng với công thức đơn giản nhất. Đốt cháy hoàn toàn 1 lượng X cần dùng vừa đủ 0,475 mol O2, thu được 0,05 mol N2 và 19,5 gam hỗn hợp gồm CO2 và H2O. Công thức phân tử của X là
Đặt nCO2 = a (mol) và nH2O = b (mol)
Ta có hệ phương trình:
\(\left\{ \begin{gathered}{m_{hh}} = {m_{C{O_2}}} + {m_{{H_2}O}} = 19,5 \hfill \\ \xrightarrow{{BT\,:O}}2{n_{C{O_2}}} + {n_{{H_2}O}} = 2{n_{{O_2}}} \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered} 44a + 18b = 19,5 \hfill \\ 2a + b = 2.0,475 \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered} a = 0,3 \hfill \\ b = 0,35 \hfill \\ \end{gathered} \right.\)
=> nC = nCO2 = 0,3(mol)
nH = 2nH2O = 2.0,35 = 0,7 (mol)
nN = 2nN2 = 2.0,05 = 0,1 (mol)
Đặt công thức của amin là CxHyNt
Ta có: nC : nH : nN = 0,3 : 0,7 : 0,1
= 3 : 7 : 1
=> Công thức phân tử của amin là C3H7N
Khi đốt cháy a mol amin X no, mạch hở ta thu được x mol CO2; y mol H2O; z mol N2. Biểu thức đúng là
Amin X no, mạch hở có CTPT dạng CnH2n+2+kNk (k là số chức amin)
Bảo toàn nguyên tố ta có :
\({n_{C{O_2}}} = {n_C}\,\, \to \,\,x = \,na (mol)\)
\({n_{{H_2}O}} = \dfrac{{{n_H}}}{2}\,\, \to \,\,y = \,na + a + a. \dfrac{k}{2}\,\,\,mol;\,\)
\({n_{{N_2}}} = \dfrac{{{n_N}}}{2} \to \,\,\,z = a. \dfrac{k}{2}\,\,mol\)
→ y = x + a + z hay a = y – x – z
Đốt cháy hoàn toàn 1 amin no, mạch hở, đơn chức X bằng một lượng khí oxi vừa đủ, thu được 8,96 lít khí CO2 và 9,9 gam H2O. CTPT của X là
Cách 1: lập tỉ lệ nc : nH
Theo giả thiết ta có
\({n_C} = {n_{C{O_2}}} = \dfrac{{8,96}}{{22,4}} = 0,4\,\,mol;\,\,{n_H} = 2.{n_{{H_2}O}} = 2.\dfrac{{9,9}}{{18}} = 1,1\,\,mol;\,\,\)
→ nC : nH = 0,4 : 1,1 = 4 : 11
Dựa vào đáp án → CTPT của amin là C4H11N
Cách 2:
Vì amin no, mạch hở, đơn chức nên \({n_{{H_2}O}} - {n_{C{O_2}}} = 1,5{n_{a\min }}\)
\( \to {n_{a\min }} = \dfrac{{{n_{{H_2}O}} - {n_{C{O_2}}}}}{{1,5}} = \dfrac{{0,55 - 0,4}}{{1,5}} = 0,1\,\,mol\)
→ Số C trong amin =\(\dfrac{{{n_{C{O_2}}}}}{{{n_X}}} = \dfrac{{0,4}}{{0,1}} = 4\)
Số H trong amin = \(\frac{{2{n_{{H_2}O}}}}{{{n_X}}} = \dfrac{{0,55.2}}{{0,1}} = 11\).
Vậy CTPT của X là C4H11N
Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 16,8 lít khí CO2; 2,8 lít khí N2 (các thể tích khí đo ở điều kiện tiêu chuẩn) và 20,25 gam H2O. CTPT của X là
Cách 1 : lập tỉ lệ mol nC : nH : nN
Theo giả thiết ta có :
\(\begin{array}{l}{n_C} = {n_{C{O_2}}} = \dfrac{{16,8}}{{22,4}} = 0,75\,\,mol;\,\,{n_H} = 2.{n_{{H_2}O}} = 2.\dfrac{{20,25}}{{18}} = 2,25\,\,mol;\,\,\\{n_N} = 2.{n_{{N_2}}} = 2.\dfrac{{2,8}}{{22,4}} = 0,25\,\,mol.\end{array}\)
\( \Rightarrow {n_C}:{n_H}:{n_N} = 0,75:2,25:0,25 = 3:9:1\)
Vậy CTPT của X là C3H9N.
Cách 2 : bảo toàn nguyên tố N : \({n_X} = {n_N} = 2{n_{{N_2}}}\)
Đối với các amin đơn chức thì phân tử có một nguyên tử N :
Bảo toàn nguyên tử N : \({n_X} = {n_N} = 2{n_{{N_2}}} = 0,25\,\,mol\)
→ Số C trong amin =\(\dfrac{{{n_{C{O_2}}}}}{{{n_X}}} = \dfrac{{0,75}}{{0,25}} = 3\);
Số H trong amin = \(\dfrac{{2{n_{{H_2}O}}}}{{{n_X}}} = \dfrac{{2,25}}{{0,25}} = 9\)
Vậy CTPT của X là C3H9N
Đốt cháy một hỗn hợp amin A cần V lít O2 (đktc) thu được N2 và 31,68 gam CO2 và 7,56 gam H2O. Giá trị V là
\({n_{C{O_2}}} = \dfrac{{31,68}}{{44}} = 0,72\,\,mol;\,\,\,{n_{{H_2}O}} = \dfrac{{7,56}}{{18}}\)= 0,42 mol
Bảo toàn nguyên tử oxi ta có :\(2{n_{{O_2}}} = 2{n_{C{O_2}}} + {n_{{H_2}O}} \to \,\,{n_{{O_2}}} = \dfrac{{2{n_{C{O_2}}} + {n_{{H_2}O}}}}{2} = \dfrac{{2.0,72 + 0,42}}{2} = 0,93\,\,mol\)
\(\to \,\,{V_{{O_2}}} = 22,4.0,93 = 20,832\) lít
Đốt cháy hoàn toàn m gam một amin X bằng lượng không khí vừa đủ thu được 17,6 gam CO2, 12,6 gam H2O và 69,44 lít N2 (đktc). Giả thiết không khí chỉ gồm N2 và O2 trong đó oxi chiếm 20% thể tích không khí. X có công thức là :
\({n_C} = {n_{C{O_2}}} = \dfrac{{17,6}}{{44}} = 0,4\,\,mol;\,\,{n_H} = 2.{n_{{H_2}O}} = 2.\dfrac{{12,6}}{{18}} = 1,4\,\,mol\).
Áp dụng định luật bảo toàn nguyên tố đối với oxi suy ra :
\({n_{{O_2}\,(kk)}} = \dfrac{{2.{n_{C{O_2}}} + {n_{{H_2}O}}}}{2} = 0,75\,\,mol \Rightarrow {n_{{N_2}\,(kk)}} = 0,75.4 = 3\,\,mol.\,\)\( \to \,\,{n_{N\,(hchc)}} = 2.(\dfrac{{69,44}}{{22,4}} - 3) = 0,2\,mol\, \Rightarrow {n_C}:{n_H}:{n_N} = 0,4:1,4:0,2 = 2:7:1.\)
Căn cứ vào các phương án ta thấy công thức của X là C2H5NH2.
Đốt cháy hoàn toàn amin X bằng oxi vừa đủ, dẫn toàn bộ sản phẩm qua bình chứa dungdịch Ca(OH)2 dư thấy có 4 gam kết tủa và khối lượng bình tăng 3,2 gam và có 0,448 lít khí (đktc) thoát ra khỏi bình. X có CTPT là
Nito không bị hấp thụ bởi Ca(OH)2 => khí thoát ra khỏi bình là khí N2
Bảo toàn nguyên tử N : \({n_{N\,\,(trong\,\,X)}} = 2{n_{{N_2}}} = \frac{{0,448}}{{22,4}}\, = 0,02\,mol\)
mkết tủa = \({m_{CaC{{\rm{O}}_3}}} = \dfrac{4}{{100}} = 0,04\,\,mol\,\, \to \,\,{n_{C{O_2}}} = 0,04\,\,mol\)
mbình tăng = \({m_{C{O_2}}} + {m_{{H_2}O}} = 3,2\,\,gam\,\, \to \,\,{m_{{H_2}O}} = 3,2 - 0,04.44 = 1,44\,\,gam\,\, \to \,\,{n_{{H_2}O}} = 0,08\,\,mol\)
→ nC : nH : nN = 0,04 : 0,16 : 0,04 = 1 : 4 : 1
=> CTĐGN của X là CH4N
=> CTPT của X là C2H8N2
Đốt cháy hoàn toàn 6,2 gam một amin no, mạch hở đơn chức cần dùng 10,08 lít khí O2 (đktc). CTPT của amin là
\({n_{{O_2}}} = \dfrac{{10,08}}{{22,4}} = 0,45\,\,mol\)
Gọi số mol của CO2, H2O và N2 lần lượt là a, b, c mol
Bảo toàn nguyên tố oxi : \(2{n_{C{O_2}}} + {n_{{H_2}O}} = 2{n_{{O_2}}}\)→ 2a + b = 0,9 (1)
Bảo toàn khối lượng : mamin = mC + mH + mN → 12a + 2b + 28c = 6,2 (2)
Vì đốt cháy amin no, mạch hở, đơn chức nên ta có :
\({n_{{H_2}O}} - {n_{C{O_2}}} = 1,5{n_{a\min }}\)và \({n_{{N_2}}} = \dfrac{1}{2}{n_{a\min }}\)→ \({n_{{H_2}O}} - {n_{C{O_2}}} = 3{n_{{N_2}}}\)
→ b – a = 3c (3)
Từ (1), (2) và (3) → \(\left\{ \begin{array}{l}a = 0,2\\b = 0,5\\c = 0,1\end{array} \right.\)
→ nC : nH : nN = 0,2 : 0,5.2 : 0,1.2 = 1 : 5 : 1
→ công thức phân tử của amin là CH3NH2
Đốt cháy hoàn toàn hỗn hợp hai amin no, đơn chức, là đồng đẳng liên tiếp, thu được 2,24 lít khí CO2 (đktc) và 3,6 gam H2O. Công thức phân tử của 2 amin là :
Sơ đồ phản ứng :
\(\begin{align}&\,\,\,\,\,\,\,\,\,\,\,\,\,{{C}_{\overline{n}}}{{H}_{2\overline{n}\,+\,3}}N\,\,\xrightarrow{{{O}_{2}},\,{{t}^{o}}}\,\,\overline{n}C{{O}_{2}}\,\,\,+\,\,\,\,\dfrac{2\overline{n}\,+3}{2}\,{{H}_{2}}O\,\,\,\,+\,\,\,\,\,\dfrac{1}{2}\,{{N}_{2}} \\ & mol:\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,2\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \\ \end{align}\)
Ta có: \(0,2\overline{n}\,=\,0,1.\dfrac{2\overline{n}\,+\,3}{2}\,\Rightarrow \,\overline{n}\,=\,1,5.\)
Vậy công thức phân tử của 2 amin là CH5N và C2H7N.
Có hai amin bậc một gồm A (đồng đẳng của anilin) và B (đồng đẳng của metylamin). Đốt cháy hoàn toàn 3,21 gam amin A sinh ra khí CO2, hơi H2O và 336 cm3 khí N2 (đktc). Khi đốt cháy amin B thấy ${{V}_{C{{O}_{2}}}}:{{V}_{{{H}_{2}}O}}=2:3$. Biết rằng tên của A có tiếp đầu ngữ “para”. Công thức cấu tạo của A, B lần lượt là :
A là đồng đẳng của anilin nên công thức của A là CnH2n-7NH2, (n ≥ 7, nguyên)
B là đồng đẳng của metylamin nên công thức của B là CmH2m+1NH2, (m ≥ 2, nguyên).
Ta có: \({{n}_{A}}=2.{{n}_{{{N}_{2}}}}=2.0,015=0,03\,mol\Rightarrow {{M}_{A}}=14n+9=\dfrac{3,21}{0,03}=107\,gam/mol\,\Rightarrow n=7.\)
Sơ đồ phản ứng :
\({{C}_{m}}{{H}_{2m+1}}N{{H}_{2}}\,\xrightarrow{{{O}_{2}},\,{{t}^{o}}}\,mC{{O}_{2}}+\dfrac{2m+3}{2}{{H}_{2}}O+\dfrac{1}{2}{{N}_{2}}\)
\({{V}_{C{{O}_{2}}}}:{{V}_{{{H}_{2}}O}}=2:3\Rightarrow m=3\)
CTCT phù hợp của A, B lần lượt là :
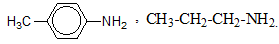
Hỗn hợp X gồm ba amin đơn chức là đồng đẳng kế tiếp nhau. Đốt cháy hoàn toàn 11,8 gam X thu được 16,2 gam H2O, 13,44 lít CO2 (đktc) và V lít khí N2 (đktc). Ba amin trên có công thức phân tử lần lượt là :
Theo giả thiết ta có:
$\begin{array}{l}{n_{{H_2}O}} = 0,9\,\,mol\,\,;\,\,{n_{C{O_2}}} = 0,6\,\,mol\,\,;\,\,{n_N} = \frac{{11,8 - 0,9.2 - 0,6.12}}{{14}} = 0,2\,\,mol\\ \Rightarrow {n_C}:{n_H}:{n_N} = 0,6:1,8:0,2 = 3:9:1.\end{array}$
Vậy công thức phân tử trung bình của ba amin là C3H9N thuộc dạng CnH2n+3N, suy ra ba amin thuộc loại amin no đơn chức và phải có ít nhất một amin có số C lớn hơn 3.
Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 là 22. Hỗn hợp khí Y gồm metylamin và etylamin có tỉ khối so với H2 là 17,833. Để đốt cháy hoàn toàn V1 lít Y cần vừa đủ V2 lít X (biết sản phẩm cháy gồm CO2, H2O và N2, các chất khí khi đo ở cùng điều kiện nhiệt độ, áp suất). Tỉ lệ V1 : V2 là :
Đặt CTPT trung bình của 2 amin là \({C_{\bar n}}{H_{2\bar n + 3}}N\).
Theo giả thiết suy ra : \(14\bar n + 17 = 2.17,833 \Rightarrow \bar n = \frac{4}{3}\).
Quy đổi hỗn hợp O3, O2 thành O, theo định luật bảo toàn khối lượng ta có .
Sơ đồ phản ứng :
\(2{{C}_{{\bar{n}}}}{{H}_{2\bar{n}+3}}N\xrightarrow{{{t}^{o}}}2\bar{n}C{{O}_{2}}+(2\bar{n}+3){{H}_{2}}O+{{N}_{2}}\,\,\,\,(1)\)
mol : 1 \(\bar{n}\) \(\dfrac{2\bar{n}+3}{2}\)
Theo (1) ta có :
\({n_{O\,\,pu }} = 2\overline n + \dfrac{{2\overline n + 3}}{2} = 5,5\,\,mol \Rightarrow {m_{\left( {{{\rm{O}}_{\rm{3}}},{\rm{ }}{{\rm{O}}_{\rm{2}}}} \right)}} = {m_O} = 5,5.16 = 88\,\,gam \Rightarrow {n_{\left( {{{\rm{O}}_{\rm{3}}},{\rm{ }}{{\rm{O}}_{\rm{2}}}} \right)}} = \frac{{88}}{{2.22}} = 2\,\,mol.\)
Vậy VY : VX = 1 : 2.
Đốt cháy hoàn toàn hỗn hợp 2 amin no, đơn chức, bậc 1, là đồng đẳng kế tiếp nhau, thu được CO2 và H2O với tỉ lệ số mol là: ${n_{C{O_2}}}:{n_{{H_2}O}}$= 7 : 10. Hai amin trên là:
Gọi CTPT trung bình cho 2 amin là \({C_{\bar n}}{H_{2\bar n + 3}}N\)
Giả sử lấy 1 mol amin
Bảo toàn nguyên tố C : \({n_{C{O_2}}} = \bar n\)
Bảo toàn nguyên tố H : \({n_{{H_2}O}} = \dfrac{{2\bar n + 3}}{2}\)
Vì \({n_{C{O_2}}}:{n_{{H_2}O}}\)= 7 : 10 → \(10\bar{n}~=\text{ 7}\text{.}\dfrac{2\bar{n}+3}{2}\Rightarrow \bar{n}=3,5\)
→ 2 amin là C3H7NH2 và C4H9NH2
Đốt cháy hết 6,72 lít hỗn hợp khí (đktc) X gồm 2 amin đơn chức, bậc một A và B là đồng đẳng kế tiếp. Cho hỗn hợp khí và hơi sau khi đốt cháy lần lượt qua bình 1 đựng H2SO4 đặc, bình 2 đựng KOH dư, thấy khối lượng bình 2 tăng 21,12 gam. Tên gọi của 2 amin là :
Khối lượng bình 2 tăng 21,12 gam \(\to {m_{C{O_2}}} = 21,12gam\,\, \to \,\,{n_{C{O_2}}} = 0,48\,\,mol\)
namin = 0,3 mol
\( \to \,\,\bar C = \dfrac{{{n_{C{O_2}}}}}{{{n_{a\min }}}} = \dfrac{{0,48}}{{0,3}} = 1,6\)
Vậy 2 amin là CH3NH2 và C2H5NH2

