Hợp chất hữu cơ X có thành phần C, H, O và chỉ chứa 1 nhóm chức trong phân tử. Đun nóng X với NaOH thì được X1 có thành phần C, H, O, Na và X2 có thành phần C, H, O; ${M_{{X_1}}} = 82\% {M_{{X}}}$. X2 không tác dụng Na, không cho phản ứng tráng gương. Đốt 1 thể tích X2 thu được 3 thể tích CO2 cùng điều kiện. Tìm CTCT X
- Đun nóng X với NaOH thì được X1 có thành phần C, H, O, Na và X2 có thành phần C, H, O
=> X là este
- Số nguyên tử C trong X2 = $\dfrac{{{V_{C{O_2}}}}}{{{V_{{X_2}}}}} = 3$
X2 chứa C, H, O và không phản ứng với Na, không tráng gương => X2 là xeton.
X2 chứa 3 C => X2 là CH3 – CO – CH3
- X1 chứa C, H, O, Na => X1 là muối của axit cacboxylic.
Gọi X: RCOOC(CH3)=CH2 => X1 là RCOONa
\(\begin{array}{l}{M_{{X_1}}} = 82\% {M_{{X}}}\\ = > \dfrac{{{M_{RCOONa}}}}{{{M_{RCOOC(C{H_3}) = C{H_2}}}}} = \dfrac{{82}}{{100}} < = > \dfrac{{R + 67}}{{R + 85}} = 0,82 = > R = 15( - C{H_3})\\ = > X:C{H_3}COOC(C{H_3}) = C{H_2}\end{array}\)
Este X mạch hở có tỉ khối hơi so với CH4 là 6,25. Cho 10g X tác dụng với 200 ml dung dịch KOH 1M (đun nóng). Cô cạn dung dịch sau phản ứng, thu được 16,8g chất rắn Y. Phát biểu nào sau đây là đúng?
MX = 100g => C5H8O2 = > este đơn chức
Bảo toàn khối lượng : mX + mKOH = mrắn + msản phẩm khác
=> msản phẩm khác = 4,4g.
Có nsản phẩm khác = neste = 0,1 mol => Msp khác = 44g (CH3CHO)
=> X là C2H5COOCH=CH2
Khi thủy phân HCOOC6H5 trong môi trường kiềm dư thì thu được:
Este có dạng: R – COO –C6H4– R’ (este của phenol) khi thủy phân thu được 2 muối + H2O
Este X khi tác dụng với dung dịch NaOH thu được 2 muối: natri phenolat và natri propionat. X có công thức là:
Este đơn chức + NaOH → 2 muối + H2O→ Este có dạng: R – COO –C6H4– R’ (este của phenol)
Natri phenolat: C6H5ONa; Natri propionat:CH3CH2COONa
=> R: CH3CH2- và R’:H
=> Este: CH3CH2COOC6H5
Chất nào sau đây tác dụng với dung dịch NaOH theo tỉ lệ mol tương ứng là 1:3?
Este có dạng: R – COO –C6H4– R’ (este của phenol) khi thủy phân cho nNaOH: n este = 2:1.
Để tỉ lệ nNaOH: n este = 3:1=> Este là este đa chức của phenol.
Pt: CH3OOC-COOC6H5+ 3NaOH → NaOOC-COONa + C6H5ONa + H2O + CH3OH
Xà phòng hóa hoàn toàn 0,1 mol CH3COOC6H5 bằng NaOH vừa đủ thu được sản phẩm chứa m gam muối. Giá trị của m là :
\( C{H_3}COO{C_6}{H_5}:0,1mol\xrightarrow{{ + {\text{ }}NaOH}}\left\{ \begin{gathered} C{H_3}COONa:0,1mol \hfill \\ {C_6}{H_5}ONa:0,1mol \hfill \\ \end{gathered} \right.{\text{ }}\)
m = 0,1 . 82 + 0,1 . 116 = 19,8g
Cho 13,6g phenyl axetat tác dụng với 200 ml dung dịch NaOH 1,5M. Sau phản ứng xảy ra hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được a gam chất rắn khan. Tính a ?
neste = 0,1 mol
nNaOH = 0,3 mol > 2neste => NaOH dư
$ \mathop {C{H_3}COO{C_6}{H_5}}\limits_{0,1mol} \xrightarrow{{ + NaOH:0,3mol}}X\left\{ \begin{gathered} C{H_3}COONa:0,1mol \hfill \\ {C_6}{H_5}ONa:0,1mol \hfill \\ NaOH\,du:0,1mol \hfill \\ \end{gathered} \right.{\text{ }} + {\text{ }}{H_2}O$
=> a = mNaOH dư + mCH3COONa + mC6H5ONa = 23,8g
Hỗn hợp X gồm phenyl axetat và axit axetic có tỉ lệ mol tương ứng là 1: 2. Cho 0,3 mol hỗn hợp X phản ứng vừa đủ với dung dịch hỗn hợp KOH 1,5M, NaOH 2,5M thu được x gam hỗn hợp muối. Giá trị của x là:
nCH3COOC6H5 : 0,1 và nCH3COOH : 0,2 mol
Gọi số mol của KOH = 1,5x và NaOH = 2,5x
∑ nOH- = 2n CH3COOC6H5 + n CH3COOH = 0,4 (mol)
=> 4x = 0,4 <=> x = 0,1
=> nKOH = 0,15 (mol); nNaOH = 0,25 (mol)
BTKL: mX + mhh kiềm = mmuối + mH2O
=> mmuối = 0,1.136 + 0,2.60 + 1,5.0,1.56 + 2,5.0,1.40 – (0,1 + 0,2).18 = 38,6 (g)
Este X có CTPT là C8H8O2. Cho 0,1 mol X tác dụng với vừa đủ 0,2 mol NaOH, sau phản ứng thu được 19,8 gam muối. Xác định số CTCT của X
\( \dfrac{{{n_{NaOH}}}}{{{n_{Este}}}} = 2\)
Mặt khác X đơn chức => X là este của phenol R – COO – C6H4 – R’
\(\underset{0,1}{\mathop{R\text{ }\text{ }COO\text{ }\text{ }{{C}_{6}}{{H}_{4}}\text{}R}}\,\xrightarrow{+NaOH:0,2mol}X\left\{ \begin{align}& RCOONa:0,1mol \\ & R'ONa:0,1mol \\ \end{align} \right.\text{ }\)
=> 0,1.(R + 67) + 0,1.(R’ + 76 + 39) = 19,8
<=> R + 67 + R’ + 115 = 198
<=> R + R’ = 16
|
R |
1 |
15 |
|
R’ |
15 |
1 |
HCOO – C6H5- CH3 (m, o, p)
CH3COO – C6H5
Cho 27,6 gam hợp chất thơm X có CT C7H6O3 tác dụng với 800 ml dd NaOH 1M được dd Y. Trung hòa Y cần 100 ml dd H2SO4 1M được dd Z. Khối lượng chất rắn thu được khi cô cạn dd Z là
$X\xrightarrow{{ + NaOH}}Y\left\{ \begin{gathered}muoi \hfill \\NaOH\,du \hfill \\\end{gathered}\right.\xrightarrow{{ + {H_2}S{O_4}}}\left\{ \begin{gathered}muoi \hfill \\ {Na_2}S{O_4} \hfill\\\end{gathered} \right.$
$\begin{gathered}{n_{NaOH}} = 0,8mol \hfill \\{n_{{H_2}S{O_4}(trung\,\,hoa)}} = 0,1mol \hfill \\\end{gathered} $
$\begin{array}{l}{n_x} = \frac{{27,6}}{{138}} = 0,2mol\\ = > {n_{NaOH(p/u\,\,voi\,\,X)}} = 0,8 - 0,1.2 = 0,6mol\end{array}$
$NX:{n_{NaOH}} = 3{n_X} = > CTCT\,\,X:HCOO - {C_6}{H_4} - OH$
$HCOO - {C_6}{H_4} - OH\xrightarrow{{ + NaOH}}Y\left\{ \begin{gathered}HCOONa \hfill \\{C_6}{H_4}{(ONa)_2} \hfill \\NaOH\,du \hfill \\\end{gathered} \right.\xrightarrow{{ + {H_2}S{O_4}}}\left\{\begin{gathered}HCOONa \hfill \\{C_6}{H_4}{(ONa)_2} \hfill \\N{a_2}S{O_4} \hfill \\\end{gathered} \right.$
$C.ran\left\{ \begin{array}{l}N{a_2}S{O_4}:0,1mol\\HCOONa:0,2mol\\{C_6}{H_4}{(ONa)_2}:0,2mol\end{array} \right\} = > m = 58,6gam$
Đốt cháy 1,7 gam este X cần 2,52 lít oxi (đktc), chỉ sinh ra CO2 và H2O với tỉ lệ số mol 2 : 1. Đun nóng 0,01 mol X với dung dịch NaOH thấy 0,02 mol NaOH tham gia phản ứng. X không có chức ete, không phản ứng với Na trong điều kiện bình thường và không khử được AgNO3/NH3 ngay cả khi đun nóng. Biết Mx< 140 đvC. Hãy xác định công thức cấu tạo của X?
\(\begin{array}{l}{\rm{Es}}te:{C_x}{H_y}{O_z}\\{n_{{O_2}}} = \dfrac{{2,52}}{{22,4}} = 0,1125mol\\{m_{{O_2}}} = 0,1125.32 = 3,6gam\end{array}\)
\(\left\{ \begin{gathered}\underrightarrow {BTKL}{m_x} + {m_{{O_2}}} = {m_{C{O_2}}} + {m_{{H_2}O}}\hfill \\\frac{{{n_{C{O_2}}}}}{{{n_{{H_2}O}}}} = \dfrac{a}{b} = \frac{2}{1} \hfill \\ \end{gathered} \right. \Leftrightarrow \left\{ \begin{gathered}1,7 + 3,6 = 44a + 18b \hfill \\a - 2b = 0 \hfill \\ \end{gathered} \right. \Leftrightarrow \left\{ \begin{gathered}= 0,1mol \hfill \\b = 0,05mol \hfill \\ \end{gathered} \right.\)
\(\begin{array}{l}{n_{{C_{este}}}} = {n_{C{O_2}}} = 0,1mol\\{n_{{H_{este}}}} = 2{n_{{H_2}O}} = 0,1mol\\{n_{O(este)}} = \dfrac{{{m_{este}} - {m_C} - {m_H}}}{{16}} = \dfrac{{1,7 - 0,1.12 - 0,1.1}}{{16}} = 0,025mol\\ \to x:y:z = 0,1:0,1:0,025 = 4:4:1\\ \to CTeste:{({C_4}{H_4}O)_n}\\Do{M_X} < 140 \to n = 2 \to X:{C_8}{H_8}{O_2}\end{array}\)
\( {\rm{ }}\dfrac{{{n_{NaOH}}}}{{{n_{este}}}} = {\rm{ }}2:1\) => X là este của phenol
X không có chức ete, không phản ứng với Na trong điều kiện bình thường và không khử được AgNO3, trong amoniac ngay cả khi đun nóng => X có CTCT là: CH3COOC6H5
Hỗn hợp X gồm 2 este đơn chức. Cho 0,3 mol hỗn hợp X tác dụng vừa đủ với dung dịch NaOH, Thu được dung dịch Y. Cô cạn dung dịch Y thu được hỗn hợp Z gồm hai muối khan. Đốt cháy hoàn toàn Z thu được 55 gam CO2; 26,5 gam Na2CO3 và m gam H2O. Giá trị của m là:
$ 0,3mol:\,hh\,{\text{es}}te\,X\xrightarrow{{ +NaOH}}Y\xrightarrow{{{t^0}}}hh\,muoi\,Z\xrightarrow{{{t^0}}}\left\{ \begin{gathered}55gC{O_2} \hfill \\ 26,5gN{a_2}C{O_3} \hfill \\ m\,g\,{H_2}O \hfill \\ \end{gathered} \right.$
$ {n_{N{a_2}C{O_3}}} = {\text{ }}0,25{\text{ }} = > {n_{NaOH}} = 0,5mol$
=> X gồm este của ancol (a mol) và este của phenol (b mol)
$\left\{ \begin{gathered} {n_X} = a + b = 0,3 \hfill \\ {n_{NaOH}} = a + 2b = 0,5 \hfill \\ \end{gathered} \right.= > \left\{ \begin{gathered} a = 0,1 \hfill \\ b = 0,2 \hfill \\ \end{gathered} \right.$
=> nRCOONa = 0,3 mol ; nR’-C6H5ONa = 0,2 mol
- Gọi số C trong muối axit và muối phenol lần lượt là u và v (v ≥ 6)
Bảo toàn C : 0,3u + 0,2v = 0,25 + 1,25
=> 3u + 2v = 15
Chỉ có v = 6 và u = 1 thỏa mãn
=> HCOONa (0,3 mol) và C6H5ONa (0,2 mol)
- Bảo toàn H : ${n_{{H_2}O}} = \frac{1}{2}{n_{H(Z)}} = {\text{ }}0,65{\text{ }}mol$
=> m = 11,7g
Cho 0,3 mol hỗn hợp X gồm 2 este đơn chức tác dụng vừa đủ với 200 ml dung dịch NaOH 2M đun nóng, thu được hợp chất hữu cơ no mạch hở Y có phản ứng tráng bạc và 37,6 gam hỗn hợp muối hữu cơ. Đốt cháy hoàn toàn Y rồi cho sản phẩm hấp thụ hết vào bình chứa dung dịch nước vôi trong dư, thấy khối lượng bình tăng 24,8 gam. Khối lượng của X là
- Nhận thấy: nX = 0,3 < nNaOH = 0,4 Þ trong X có chứa 1 este của phenol (A) và este còn lại là (B)
Với \(\left\{ \begin{array}{l}(A):\;RCOO{C_6}{H_4}R'\\(B):{R_1}COOCH = CH{R_2}\end{array} \right. \to \left\{ \begin{array}{l}{n_A} + {n_B} = 0,3\\2{n_A} + {n_B} = 0,4\end{array} \right. \to \left\{ \begin{array}{l}{n_A} = 0,1\\{n_B} = 0,2\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{n_{{H_2}O}} = {n_A} = 0,1\\{n_Y} = {n_B} = 0,2\end{array} \right.\)
- Khi đốt cháy chất Y no, đơn chức, mạch hở (R2CH2CHO: 0,2 mol) luôn thu được
- Khi đốt cháy chất Y no, đơn chức, mạch hở (R2CH2CHO: 0,2 mol) luôn thu được
$44{n_{C{O_2}}} + 18{n_{{H_2}O}} = 24,8 \to {n_{C{O_2}}} = 0,4\;mol$
mà ${C_Y} = \dfrac{{{n_{C{O_2}}}}}{{0,2}} = 2$
=> Y là CH3CHO
$\xrightarrow{{BTKL}}{m_X} = $mmuối + mY + ${m_{{H_2}O}}$– mNaOH = $\boxed{32,2\;(g)}$
Cho 1 mol chất X (C7HyO3, chứa vòng benzen) tác dụng hết với NaOH dư, thu được 1 mol chất Y, 1 mol chất Z và 2 mol H2O (trong đó MY < MZ; có 3 mol NaOH tham gia phản ứng). Chất Z tác dụng với dung dịch H2SO4 loãng dư thu được T (Y, Z, T là các hợp chất hữu cơ). Phát biểu nào sau đây sai?
Cho 1 mol chất X (C7HyO3, chứa vòng benzen) tác dụng hết với NaOH dư, thu được 1 mol chất Y, 1 mol chất Z và 2 mol H2O (trong đó MY < MZ; có 3 mol NaOH tham gia phản ứng)
=> X có chứa 2 chức COO gắn trực tiếp với vòng benzen và 1 chức phenol.
CTCT thỏa mãn của X:
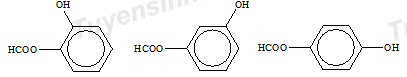
=> Y là HCOONa
Z là C6H4(ONa)2 => T là C6H4(OH)2
A đúng vì HCOONa có chứa cấu trúc -CH=O nên vừa làm mất màu Br2 và có phản ứng tráng bạc
B sai vì HCOONa không phản ứng được với NaOH (xt CaO)
C đúng vì X và T đều có chứa 6 nguyên tử H
D đúng
Thủy phân hoàn toàn 3,96 gam vinyl fomat trong dung dịch H2SO4 loãng. Trung hòa hoàn toàn dung dịch sau phản ứng rồi cho tác dụng tiếp với dung dịch AgNO3/NH3 dư, đun nóng, phản ứng hoàn toàn, thu được m gam Ag. Giá trị của m là:
nHCOOCH=CH2 = 3,96 :72 = 0,055 (mol)
HCOOCH=CH2 + H2O \(\buildrel {{H_2}S{O_4}} \over\longrightarrow \) HCOOH + CH3CH=O
HCOOH → 2Ag
CH3CHO → 2Ag
=> nAg = 2nHCOOH + 2nCH3CH=O = 2.0,055 + 2.0,055 = 0,22 (mol)
=> mAg = 0,22.108 = 23,76 (g)

