Cho một lượng hỗn hợp X gồm Ba và Na vào 200 ml dung dịch Y gồm HCl 0,1M và CuCl2 0,1M. Sau phản ứng thu được 0,448 lít khí (đktc) và m gam kết tủa. Giá trị của m là
nHCl = 0,2.0,1 = 0,02 mol; nCuCl2 = 0,2.0,1 = 0,02 mol
nH2 = 0,02 mol
Khi cho Na, Ba vào dung dịch chứa H+ thì H+ bị khử trước, hết H+ thì H2O mới bị khử
2H+ + 2e → H2
0,02 → 0,02 → 0,01
=> nH2 do khử H2O = 0,02 – 0,01 = 0,01 mol
nOH- = 2nH2 = 0,01.2 = 0,02 mol
Cu2+ + 2OH- → Cu(OH)2
0,01 0,02 0,01 (mol)
=> mkết tủa = 0,01.98 = 0,98 gam
Cho sơ đồ biến hóa: Ca → X → Y → Z → T → Ca. Hãy chọn thứ tự đúng của các chất X, Y, Z, T là
Sơ đồ biến hóa đúng là : Ca → CaO → CaCO3 → Ca(HCO3)2 → CaCl2 → Ca
PTHH: 2Ca + O2 → 2CaO
CaO + CO2 → CaCO3
CaCO3 + CO2 + H2O → Ca(HCO3)2
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
CaCl2 $\xrightarrow{{đpnc}}$ Ca + Cl2
Cho hỗn hợp X gồm 0,2 mol Ba và 0,5 mol K tác dụng hết với 500 ml dung dịch Y gồm HCl 1,2M và CuSO4 0,4M, sau phản ứng thu được V lít khí H2 (đktc) và m gam kết tủa. Giá trị của V và m là
nHCl = 0,6 mol; nCuSO4 = 0,2 mol
2K + 2HCl → 2KCl + H2
Ba + 2HCl → BaCl2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Bảo toàn e: 2nBa + nK = 2nH2 => nH2 = (0,2.2 + 0,5) / 2 = 0,45 mol
=> V = 10,08 lít
Kết tủa thu được gồm BaSO4 và Cu(OH)2
Ta thấy: nBaSO4 = nBa = nCuSO4 = 0,2 mol
Bảo toàn Ba: nBa(OH)2 = nBa ban đầu – nBaCl2 = 0,2 – 0,05 = 0,15 mol
Vì nBa(OH)2 = 0,15 mol < nCuSO4 = 0,2 mol => số mol Cu(OH)2 tính theo Ba(OH)2 là 0,15 mol
=> mkết tủa = mBaSO4 + mCuSO4 = 61,3 gam
Từ hai muối X và Y thực hiện các phản ứng sau:
X → X1 + CO2 X1 + H2O → X2
X2 + Y → X + Y1 + H2O X2 + 2Y → X + Y2 + H2O
Hai muối X và Y tương ướng là
X phân hủy tạo CO2 => X là CaCO3 hoặc BaCO3
=> X1 là oxit bazơ : MO => X2 là bazơ M(OH)2
Ta thấy X2 + Y -> X => Y phải là hợp chất cacbonat ( CO3 hoặc HCO3) mà X2 tác dụng với Y theo 2 tỉ lệ tạo 2 chất khác nhau
=> Y là NaHCO3
=> X là CaCO3
PTHH: Ca(OH)2 + NaHCO3 → CaCO3 + NaOH + H2O
Ca(OH)2 + 2NaHCO3 → CaCO3 + Na2CO3 + H2O
Cho hỗn hợp gồm Na và Ba vào dung dịch chứa HCl 1M và H2SO4 0,6M. Sau khi kết thúc phản ứng thấy thoát ra 3,36 lít khí H2 (đktc) đồng thời thu được 13,98 gam kết tủa và dung dịch X có khối lượng giảm 0,1 gam so với dung dịch ban đầu. Cô cạn dung dịch X thu được m gam chất rắn. Giá trị của m là
Đặt a và b là số mol của Na, Ba
=> a + 2b = 0,15.2 (1)
mdung dịch giảm = 23a + 137b – 13,98 – 0,15.2 = - 0,1 (2)
Từ (1) và (2) => a = 0,14; b = 0,08
nBaSO4 = 0,06 mol => Ba2+ còn dư 0,08 – 0,06 = 0,02 mol
=> nH2SO4 = 0,06 mol => nHCl = 0,06.1/0,6 = 0,1
Dung dịch X chứa Ba2+ (0,02), Na+ (0,14 mol); Cl- (0,1 mol) và OH-
Bảo toàn điện tích => nOH- = 0,08 mol
=> mrắn = 10,87 gam
Cho các sơ đồ chuyển hóa: CaO + X → CaCl2; CaCl2 + Y → Ca(NO3)2; Ca(NO3)2 + Z → CaCO3. Công thức của chất X, Y, Z lần lượt là
PTHH:
CaO + 2HCl → CaCl2 + H2O
CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl↓
Ca(NO3)2 + (NH4)2CO3 → CaCO3 + 2NH4NO3
Loại A và D vì Cl2 không tác dụng với CaO
Loại C vì HNO3 không tác dụng với CaCl2
Hòa tan hoàn toàn m gam hỗn hợp X chứa Ba, Al, BaO, Al2O3 vào nước dư thu được 0,896 lít khí đktc và dung dịch Y. Hấp thụ hoàn toàn 1,2096 lít khí CO2 vào dung dịch Y thấy xuất hiện 4,302 gam kết tủa. Lọc kết tủa thu được dung dịch Z chỉ chứa một chất tan. Mặt khác nếu dẫn từ từ CO2 đến dư vào dung dịch Y thì thu được 3,12 gam kết tủa. Giá trị của m là
Quy đổi X thành Ba: x mol; Al: y mol và O : z mol
Ba → Ba+2 +2e Al → Al+3 +3e O + 2e → O-2
2H+ +2e → H2
→ 2x + 3y – 2z =2.0,04=0,08 (1)
Y +CO2 thì Ba(AlO2)2 + CO2 +3H2O → BaCO3 + 2Al(OH)3
Ba(OH)2 + CO2 → BaCO3 + H2O
BaCO3 + CO2 + H2O → Ba(HCO3)2
Nếu CO2 dư thì nkết tủa = nAl(OH)3 = 3,12 : 78 = 0,04 mol → nBa(AlO2)2 = 0,02 mol
Bảo toàn Al : y = 0,04 mol( = nAl(OH)3) (2)
Khi CO2 : 0,054 mol thì nAl(OH)3 = 0,04 mol → nBaCO3 = 0,006 mol < ½ nAl(OH)3
→ phản ứng tạo tối đa BaCO3 rồi tan
Bảo toàn C có nCO2 = nBaCO3 + 2nBa(HCO3)2 → 0,054 = 0,006 + 2nBa(HCO3)2 → nBa(HCO3)2 = 0,024 mol
Bảo toàn Ba có x = nBaCO3 + nBa(HCO3)2 = 0,006 + 0,024 =0,03 mol(3)
Từ (1) (2) và (3) → z = 0,05 mol
→ m = 5,99 g
Cho m gam hỗn hợp gồm Na, Na2O, K2O vào H2O dư, thu được 50 ml dung dịch X và 0,02 mol H2. Cho 50 ml dung dịch HCl 3M vào X, thu được 100 ml dung dịch Y có pH = 1. Cô cạn Y thu được 9,15 gam chất rắn khan. Giá trị của m gần nhất với giá trị nào sau đây?
Bước 1: Tính số mol các chất trong hỗn hợp
Quy đổi hỗn hợp thành Na (a), K (b), O (c).
- BTe: nNa + nK = 2nO + 2nH2 → a + b = 2c + 2.0,02 (1)
- nOH- = nNaOH + nKOH = a + b (mol)
⟹ nH+dư = nH+ (bđ) - nOH- ⟹ 0,1.10-1 = 0,05.3 - (a + b) (2)
- Chất rắn sau cô cạn gồm: NaCl (a) và KCl (b)
⟹ 58,5a + 74,5b = 9,15 (3)
Giải (1), (2), (3) được a = 0,08; b = 0,06; c = 0,05.
Bước 2: Tính giá trị của m hỗn hợp ban đầu
- mhh = 0,08.23 + 0,06.39 + 0,05.16 = 4,98 gam gần nhất với 5 gam.
Đốt môi sắt chứa kim loại M cháy ngoài không khí rồi đưa vào bình đựng khí CO2 như hình vẽ, thấy kim loại M vẫn tiếp tục cháy trong bình đựng CO2
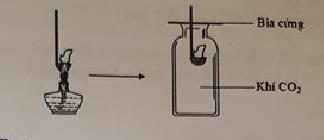
Kim loại M là
Kim loại M là Mg vì 2Mg + O2 \(\xrightarrow{{{t^o}}}\) 2MgO
Mg + CO2 \(\xrightarrow{{{t^o}}}\) MgO + C
Hỗn hợp X gồm K, K2O, Ba, BaO. Lấy m gam X hòa tan vào H2O dư thu được 0,07 mol H2 và dung dịch Y. Hấp thụ hết 0,18 mol CO2 vào Y thu được 3,94 gam kết tủa và dung dịch Z. Nhỏ từ từ dung dịch NaOH 1M vào Z đến khi kết tủa lớn nhất thì cần ít nhất 30 ml dung dịch NaOH 1M. Giá trị của m gần nhất với giá trị nào sau đây?
Bước 1: Xác định thành phần các chất trong Z.
- Do thêm NaOH vào vẫn thu được kết tủa nên dung dịch Z chứa Ba(HCO3)2 và KHCO3.
Bước 2: Tính nK (X), nBa (X), nO (X)
Coi hỗn hợp X gồm K, Ba, O
- Để kết tủa lớn nhất cần ít nhất NaOH thì xảy ra phản ứng:
Ba(HCO3)2 + NaOH ⟶ BaCO3 ↓ + NaHCO3 + H2O
0,03 ⟵ 0,03
- nCO2 = 0,18 mol; nBaCO3 = 0,02 mol; nBa(HCO3)2 = 0,03 mol
- Tính nK (X), nBa (X), nO (X):
+ Bảo toàn Ba: nBa (X) = nBaCO3 + nBa(HCO3)2 = 0,05 mol
+ Bảo toàn C: nCO2 = nBaCO3 + 2nBa(HCO3)2 + nKHCO3 ⟶ nKHCO3 = 0,1 mol ⟶ nK (X) = 0,1 mol
+ Bảo toàn e ⟶ nK + 2nBa = 2nO (X) + 2nH2 ⟶ nO (X) = 0,03 mol
Bước 3: Tính mX
- mX = 0,1.39 + 0,05.137 + 0,03.16 = 11,23 gam.

