Thứ tự tăng dần tính oxi hóa của các đơn chất O2, F2, N2 là
Thứ tự tăng dần tính oxi hóa của các đơn chất O2, F2, N2 là: N2 < O2 < F2.
Nitơ thể hiện tính khử khi phản ứng với
Nitơ thể hiện tính khử khi phản ứng với chất có tính oxi hóa => O2
${{N}_{2}}+{{O}_{2}}\overset{{{t}^{o}},xt}{\leftrightarrows}2NO$
Nhận xét nào đúng về tính oxi hóa khử của N2 ?
N2 thể hiện tính khử khi tác dụng với O2 và thể hiện tính oxi hóa khi tác dụng với kim loại (Mg, Li)
Điểm giống nhau giữa N2 và CO2 là
Điểm giống nhau giữa N2 và CO2 là: đều không duy trì sự cháy và sự sống.
A sai vì N2 ít tan trong nước
B sai vì CO2 chỉ có tính oxi hóa, không có tính khử vì C có số oxi hóa +4 là số oxi hóa cao nhất, còn O có số oxi hóa -2 nhưng không có phản ứng nào để O tạo thành O2 nên O không có tính khử.
Mệnh đề nào dưới đây không đúng?
Mệnh đề không đúng là: Tính phi kim của các nguyên tố nhóm VA tăng theo chiều tăng của điện tích hạt nhân.
Vì trong cùng một nhóm, theo chiều tăng của điện tích hạt nhân thì độ âm điện giảm => tính phi kim giảm.
A đúng vì các nguyên tử của các nguyên tố thuộc nhóm VA có cấu hình e lớp ngoài là ns2np3
B đúng vì nitơ có số hiệu nguyên tử nhỏ nhất
D đúng.
Mệnh đề nào dưới đây là không đúng?
Mệnh đề không đúng là: So với các nguyên tố cùng nhóm VA, nitơ có tính kim loại mạnh nhất.
Vì nitơ có độ âm điện lớn nhất trong nhóm VA => nitơ có tính phi kim mạnh nhất.
A đúng
B đúng vì độ âm điện của nitơ mạnh nhất => khả năng hút e mạnh nhất => bán kính nhỏ nhất
D đúng
Mệnh đề nào dưới đây đúng?
A sai, nitơ không duy trì sự hô hấp vì nitơ là khí trơ, không phải là khí độc.
B đúng
C sai vì trong phản ứng của nitơ với kim loại thì nitơ thể hiện tính oxi hóa, kim loại thể hiện tính khử
D sai vì trong N2O4 nguyên tử N có số oxi hóa +4
\(\overset{+3}{\mathop{Al}}\,\overset{-3}{\mathop{N}}\,,\text{ }{{\overset{+4}{\mathop{N}}\,}_{2}}{{\overset{-2}{\mathop{O}}\,}_{4}},\text{ }\overset{-3}{\mathop{N}}\,{{\overset{+1}{\mathop{H}}\,}_{4}}^{+},\text{ }\overset{+5}{\mathop{N}}\,{{\overset{-2}{\mathop{O}}\,}_{3}}^{-},\text{ }\overset{+4}{\mathop{N}}\,{{\overset{-2}{\mathop{O}}\,}_{2}}\)
Trong các hợp chất, nitơ có cộng hóa trị tối đa là
Trong các hợp chất, nitơ có cộng hóa trị tối đa là: 4
Nguyên tử nitơ không có obitan d trống, nên ở trạng thái kích thích không xuất hiện 5 electron độc thân để tạo thành 5 liên kết cộng hóa trị. Ngoài khả năng tạo 3 liên kết cộng hóa trị bằng sự góp chung electron, nitơ còn có khả năng tạo thêm 1 liên kết cho – nhận. Các nguyên tố còn lại của nhóm VA khi ở trạng thái kích thích nguyên tử của chúng xuất hiện 5 electron độc thân nên có khả năng tạo 5 liên kết cộng hóa trị.
Trong các hợp chất, nitơ có thể có các số oxi hóa là
Trong các hợp chất, nitơ có thể có các số oxi hóa là: -3; +1; +2; +3; +4; +5
Cấu hình e của nguyên tử N:
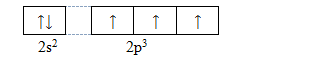
=> ở trang thái kích thích, nguyên tử N có thể cho từ 1 đến 5e để tạo liên kết => có số oxi hóa từ +1 đến +5
N có thể nhận 3e để tạo liên kết => có số oxi hóa -3
Ở điều kiện thường, nitơ phản ứng được với
Ở nhiệt độ thường nitơ chỉ tác dụng với liti tạo liti nitrua.
6Li + N2 → 2Li3N
Cho hỗn hợp khí X gồm N2, Cl2, SO2, CO2, H2 qua dung dịch NaOH dư, người ta thu được các khí thoát ra gồm
Các khí bị giữ lại trong dung dịch NaOH là: Cl2, SO2, CO2
2NaOH + Cl2 → NaCl + NaClO + H2O
2NaOH + SO2 → Na2SO3 + H2O
2NaOH + CO2 → Na2CO3 + H2O
=> 2 khí thoát ra là N2 và H2
Trong phòng thí nghiệm, người ta thu khí nitơ bằng phương pháp dời nước vì
Trong phòng thí nghiệm, người ta thu khí nitơ bằng phương pháp dời nước vì N2 rất ít tan trong nước.
Nitơ có nhiều trong khoáng vật diêm tiêu, diêm tiêu có thành phần chính là
Nitơ có nhiều trong khoáng vật diêm tiêu, diêm tiêu có thành phần chính là: NaNO3
Dãy nào dưới đây gồm các chất mà nguyên tố nitơ có khả năng vừa thể hiện tính khử vừa thể hiện tính oxi hóa khi tham gia phản ứng ?
Nguyên tố N có các số oxi hóa: -3, 0, +1, + 2, +3, +4, +5
Những nguyên tố N mang số oxi hóa trung gian có khả năng vừa thể hiện tính oxi hóa, vừa thể hiện tính khử khi tham gia phản ứng
Trong NH3, Nitơ có số oxi hóa -3, là số oxi hóa thấp nhất nên chỉ thể hiện tính khử.
Trong HNO3 và N2O5, N có số oxi hóa +5, là số oxi hóa cao nhất nên chỉ thể hiện tính oxi hóa.
Khối lượng NaNO2 cần dùng trong phòng thí nghiệm để thu được 6,72 lít N2 (đktc) là
NH4Cl + NaNO2 \(\xrightarrow{{{t}^{o}}}\) N2 + NaCl + 2H2O
Theo PTHH: nNaNO2 = nN2 = 6,72:22,4 = 0,3 mol
=> mNaNO2 = 0,3.69 = 20,7 gam
Cây không sử dụng được nitơ phân tử N2 trong không khí vì:
Cây không sử dụng được nitơ phân tử N2 trong không khí vì phân tử N2 có liên kết ba bền vững cần phải đủ điều kiện mới bẻ gãy được.

