Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm 0,03 mol Cr2O3; 0,04 mol FeO và a mol Al. Sau một thời gian phản ứng, trộn đều, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. Phần một phản ứng vừa đủ với 400 ml dung dịch NaOH 0,1M (loãng). Phần hai phản ứng với dung dịch HCl loãng, nóng (dư), thu được 1,12 lít khí H2 (đktc). Giả sử trong phản ứng nhiệt nhôm, Cr2O3 chỉ bị khử thành Cr. Phần trăm khối lượng Cr2O3 đã phản ứng là
Xét: Cr2O3 + 2Al -> Al2O3 + 2Cr
0,03 y
x 2x x 2x
0,03 – x y – 2x x 2x
Coi toàn bộ 2 phần của hỗn hợp Y phản ứng 0,08 mol NaOH thu được 0,1 mol H2.
Vì Cr2O3 chỉ tác dụng với NaOH đặc, còn NaOH loãng không được.
Ta có:
Tác dụng với NaOH là Al dư và Al2O3: y – 2x + 2x = 0,08 => y = 0,08
Tác dụng với Fe: 3.(y – 2x) + 4x = 0,2
=> 3y – 2x = 0,2
Vậy x = 0,02 => 0,02/0,03 .100% = 66,67%
Hoà tan hoàn toàn m gam hỗn hợp X gồm Na và K vào dung dịch HCl dư thu được dung dịch Y. Cô cạn dung dịch Y thu được (m + 31,95) gam hỗn hợp chất rắn khan. Hoà tan hoàn toàn 2m gam hỗn hợp X vào nước thu được dung dịch Z. Cho từ từ đến hết dung dịch Z vào 0,5 lít dung dịch CrCl3 1M đến phản ứng hoàn toàn thu được kết tủa có khối lượng là
Ta có trong 2m có số mol OH- là = 1,8
Cr3+ + 3OH- → Cr(OH)3 và Cr3+ + 4OH- → [Cr(OH)4] (tan)
a 3a a b 4b
Ta có a + b = 0,5 và 3a + 4b = 1,8 => a = 0,2
=> m = 0,2.103 = 20,6g
Chọn phát biểu đúng:
A và B sai vì:
- Trong môi trường axit, muối crom(III) có tính oxi hóa và dễ bị khử thành muối crom(II)
- Trong môi trường kiềm, muối crom(III) có tính khử
C sai vì ion Cr3+ không có tính lưỡng tính, chỉ có Cr(OH)3 và Cr2O3 có tính lưỡng tính
Thực hiện phản ứng nhiệt nhôm giữa Al và Cr2O3 trong điều kiện không có không khí, sau phản ứng hoàn toàn thu được hỗn hợp X có khối lượng 43,9 gam. Chia X làm 2 phần bằng nhau. Cho phần 1 tác dụng với dung dịch NaOH (dư) thu được 1,68 lít khí (đktc). Phần 2 cho tác dụng vừa đủ với V lít dung dịch HCl 1M (loãng nóng). Giá trị của V là
2Al + Cr2O3 → Al2O3 + 2Cr
2x x x 2x
½ X + NaOH : Do có khí thoát ra nên Al còn, Cr2O3 hết, hỗn hợp X gồm Al2O3, Cr và Al dư
nAl dư 1 phần = 2/3.nH2 = 0,05 mol
=> mX = 27.0,05.2 + 102x + 52.2x = 43,9 => x = 0,2 mol
½ X + HCl :
Al2O3 + 6HCl → 2AlCl3 + 3H2O
0,1 → 0,6
Cr + 2HCl → CrCl2 + H2
0,2 → 0,4
2Al + 6HCl → 2AlCl3 + 3H2
0,05→ 0,15
=> nHCl = 1,15 mol
=> V ddHCl = 1,15 lít
Chia 31,2 gam hỗm hợp X gồm Cr và Zn, Ni và Al thành hai phần bằng nhau. Hòa tan hết phần 1 trong lượng dư dung dịch HCl loãng nóng thu được 7,28lít H2(đktc). Cho phần 2 tác dụng với khí Cl2 (dư ) đốt nóng , thu được 42,225 gam muối clorua . Phần tram khối lượng của crom trong hỗn hợp X là
½ X + HCl → muối Z (CrCl2 , ZnCl2 , NiCl2 , AlCl3) + H2
=> mZ = 15,6 + 71.7,28 / 22,4 = 38,675 gam
½ X + Cl2 → muối Y (CrCl3 , ZnCl2 , NiCl2 , AlCl3)
Gọi 2a là số mol Cr chứa trong hỗn hợp X
=> a = (mY - mX ) / 35,5 = (42,225 – 38,675 ) / 35,5 = 0,1 mol
=> %Cr = 52.0,1.100% / 15,6 = 33,33%
Nung nóng 46,6 gam hỗn hợp gồm Al và Cr2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn. Chia hỗn hợp thu được sau phản ứng thành hai phần bằng nhau. Phần một phản ứng vừa đủ với 300 ml dung dịch NaOH 1M (loãng). Để hòa tan hết phần hai cần vừa đủ dung dịch chứa a mol HCl. Giá trị của a là
TH1: Al dư, Cr2O3 hết. Chỉ có Al dư và Al2O3 tan trong NaOH => nAl ban đầu = nNaOH = 0,3 mol
=> nCr2O3 = 0,1
Với HCl, sản phẩm chứa Al3+ (0,3 mol), Cr2+ (0,2 mol) => nCl- = 1,3 mol
Vậy nHCl = 1,3 mol
TH2: Al hết (x mol), Cr2O3 còn dư (y mol)
=> nNaOH = x + 2y = 0,3
mhh = 27x + 152.(0,5x + y) = 23,3
=> x = 1/54 và y = 19/135
Với HCl, sản phẩm chứa Al3+ (1/54 mol), Cr3+ (2y = 38/135) và Cr2+ (1/54 mol)
=> nCl- = 0,937 mol
Cho dãy các chất : SiO2, Cr(OH)3, CrO3, Zn(OH)2, NaHCO3, Al2O3. Số chất trong dãy tác dụng được với dung dịch NaOH (đặc, nóng) là
SiO2 + 2NaOH → Na2SiO3 + H2O
Cr(OH)3 + NaOH → Na[Cr(OH)4]
2NaOH + Zn(OH)2 → Na2[Zn(OH)4]
NaOH + NaHCO3 → Na2CO3 + H2O
CrO3 + 2NaOH → Na2CrO4 + H2O
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Hiện tượng xảy ra khi nhỏ vài giọt dung dịch H2SO4 vào dung dịch Na2CrO4 là
2CrO42- + 2H+ $\overset {} \leftrightarrows $ Cr2O72- + H2O
(màu vàng) (màu da cam)
Khi nhỏ từ từ dung dịch H2SO4 vào dung dịch Na2CrO4 thì cân bằng trên chuyển dịch sang phải
=> dung dịch chuyển từ màu vàng sang màu da cam
Cho vào ống nghiệm một vài tinh thể K2Cr2O7, sau đó thêm tiếp khoảng 1 ml nước và lắc đều để K2Cr2O7 tan hết, thu được dung dịch X. Thêm vài giọt dung dịch KOH vào dung dịch X, thu được dung dịch Y. Màu sắc của dung dịch X và Y lần lượt là
Cr2O72- + 2OH- $\overset {} \leftrightarrows $ 2CrO42- + H2O
màu da cam màu vàng
Khi nhỏ từ từ dung dịch KOH vào dung dịch K2Cr2O7 thì cân bằng trên chuyển dịch sang phải
=> dung dịch chuyển từ màu da cam sang màu vàng
Cho phản ứng K2Cr2O7 + HCl → KCl + CrCl3 + Cl2 + H2O. Số phân tử HCl bị oxi hóa là
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
=> số phân tử HCl bị oxi hóa = số nguyên tử Cl tạo Cl2 = 6
Phát biểu nào sau đây là sai ?
Phát biểu sai là: Trong môi trường axit, Zn khử Cr3+ thành Cr
Trong môi trường axit, muối crom(III) có tính oxi hóa và dễ bị khử thành muối crom(II)
Zn + 2Cr3+ → Zn2+ + 2Cr2+ => B sai
A đúng
C đúng. Photpho bốc cháy khi tiếp xúc với CrO3: 10CrO3 + 6P → 3P2O5 + 5Cr2O3
D đúng. 3Br2 + 2CrO2- + 8OH- → 2CrO42- + 6Br- + 4H2O
Dung dịch FeSO4 làm mất màu dung dịch nào sau đây?
Dung dịch FeSO4 có thể làm mất màu dung dịch KMnO4/H2SO4, K2Cr2O7/H2SO4, Br2
Cho các phát biểu sau:
(1) Thêm lượng dư NaOH vào dung dịch K2Cr2O7 thì dung dịch chuyển từ màu da cam sang màu vàng.
(2) Thêm lượng dư NaOH và Cl2 vào dung dịch CrCl2 thì dung dịch từ màu xanh chuyển thành màu vàng.
(3) Thêm từ từ dung dịch NaOH vào dung dịch CrCl3 thấy xuất hiện kết tủa vàng nâu tan lại trong NaOH (dư).
(4) Thên từ từ dung dịch HCl vào dung dịch Na[Cr(OH)4] thấy xuất hiện kết tủa lục xám, sau đó tan lại.
Số câu đúng là
(1) đúng vì : Cr2O72- + 2OH- $\overset {} \leftrightarrows $ 2CrO42- + H2O
màu da cam màu vàng
(2) đúng vì:
2CrCl2 + Cl2 → 2CrCl3
2CrCl3 + 3Cl2 + 16NaOH → 2Na2CrO4 + 12NaCl + 8H2O
(3) sai vì Cr(OH)3 là chất kết tủa màu lục xám
(4) đúng vì Na[Cr(OH)4] + HCl → Cr(OH)3 + NaCl + H2O
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
Thực hiện phản ứng nhiệt nhôm hỗn hợp Al, Fe2O3, Cr2O3 sau một thời gian thu được hỗn hợp chất rắn X. Chia X thành 2 phần bằng nhau. Hòa tan hoàn toàn phần 1 trong dung dịch H2SO4 đặc, nóng dư sau khi các phản ứng xảy ra hoàn toàn, thu được 2,016 lít khí SO2 (sản phẩm khử duy nhất, đktc). Hòa tan hết phần 2 trong 400 ml dung dịch HNO3 2M, thu được dung dịch Y và khí NO (sản phẩm khử duy nhất của N+5). Cho từ từ dung dịch NaOH 1M đến dư vào dung dịch Y thu được kết quả như hình vẽ sau:
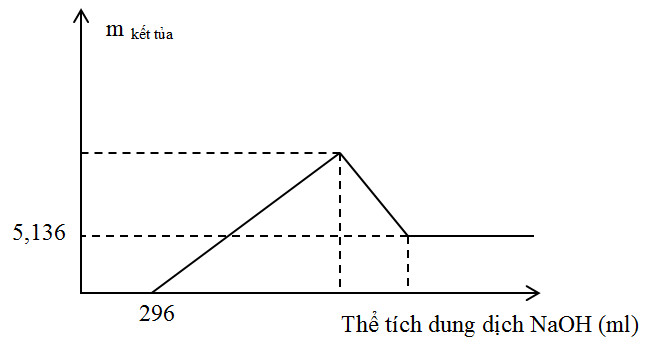
Khối lượng Cr2O3 trong hỗn hợp ban đầu là
Nhìn vào đồ thị ta thấy sau một thời gian kết tủa xuất hiện nên suy ra trong dung dịch Y có chứa H+ dư
=> nH+ dư = 0,296 mol
Khi thêm NaOH khối lượng kết tủa không đổi và bằng 5,136 gam => mFe(OH)3 = 5,136 gam
=> nFe(OH)3 = 0,048 mol
Quy đổi mỗi phần thành: Al (x mol); Fe (0,048 mol); Cr (y mol); O (x mol)
=> nFe2O3 = 0,5.0,048 = 0,024 (mol); nCr2O3 = 0,5y (mol)
+ Ta có: nO = 3nFe2O3 + 3nCr2O3 => z = 3.0,024 + 3.0,5y (1)
+ BTe quá trình phần 1 tác dụng với H2SO4 đặc nóng dư:
3nAl + 3nFe + 3nCr = 2nO + 2nSO2 => 3x + 3.0,048 + 3y = 2z + 0,09.2 (2)
+ Phần 2 tác dụng với HNO3:
Thành phần dung dịch Y \(\left\{ \matrix{
A{l^{3 + }}:x \hfill \cr
F{e^{3 + }}:0,048 \hfill \cr
C{r^{3 + }}:y \hfill \cr
{H^ + }du:0,296 \hfill \cr
\buildrel {BTDT} \over
\longrightarrow N{O_3}^ - :3x + 3y + 0,44 \hfill \cr} \right.\)
Do 2 phần có khối lượng bằng nhau nên ta suy ra lượng e trao đổi của SO2 bằng lượng e trao đổi của NO
=> 2nSO2 = 3nNO => nNO = 2/3.nSO2 = 2/3.0,09 = 0,06 mol
BTNT "N": nHNO3 pư = nNO3- + nNO => 0,8 = 3x + 3y + 0,44 + 0,06 (3)
Giải hệ (1) (2) (3) được x = 0,06; y = 0,04; z = 0,132
Trong mỗi phần ta có: nCr = y = 0,04 => nCr2O3 = 0,02 mol => mCr2O3 = 3,04 gam
=> mCr2O3 (hh đầu) = 6,08 gam
Cho sơ đồ phản ứng: $Cr{O_3}\xrightarrow{{ + NaOH}}X\xrightarrow{{ + {H_2}S{O_4}}}Y\xrightarrow{{ + HCl}}Z \to X$
X, Y, Z là các hợp chất chứa crom. X, Y, Z lần lượt là:
X phải là Na2CrO4 (Cr6+) do đó loại A và D.
Ở cả ý B và C, Y đều là Na2Cr2O7 nên ta bỏ qua, xét Z:
Na2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
Phải chọn Z sao cho từ Z điều chế lại được X là Na2Cr2O7 => chỉ có thể là ý C, Z phải là CrCl3
Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm 0,03 mol Cr2O3; 0,04 mol FeO và a mol Al. Sau một thời gian phản ứng, trộn đều, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. Phần 1 phản ứng vừa đủ với 400 ml dung dịch NaOH 0,1M (loãng). Phần 2 phản ứng với dung dịch HCl loãng, nóng, dư thu được 1,12 lít khí H2 (đktc). Giả sử trong phản ứng nhiệt nhôm, Cr2O3 chỉ bị khử thành Cr. Phần trăm khối lượng Cr2O3 đã phản ứng là:
- Sau phản ứng chia làm hai phần bằng nhau, vậy mỗi phần tương đương với lượng phản ứng ban đầu là 0,015 mol Cr2O3, 0,02 mol FeO và b mol Al (với b = a/2). Số mol các chất trong mỗi phần của hỗn hợp Y là như nhau. (Al, Al2O3, Cr, Cr2O3, Fe, FeO).
Chú ý: Nhiều HS giải cho rằng FeO phản ứng hết. Điều này có thể không chính xác và không khẳng định được.
- Các chất phản ứng với dd NaOH loãng là Al, Al2O3. Riêng Cr2O3 chỉ phản ứng với dd NaOH đặc
- Các chất phản ứng với dd HCl loãng nóng, tạo H2 là Al, Cr, Fe.
- Vậy xét P1: Al + NaOH và Al2O3 + 2NaOH
x x y 2y
=> Số mol Al ban đầu = x + 2y = nNaOH = 0,04 mol
- Xét các phản ứng nhiệt nhôm
2Al + Cr2O3 → Al2O3 + 2Cr
m m/2 m
2Al + 3FeO → Al2O3 + 3Fe
n 1,5n
- Xét phản ứng với dd HCl, ta có tỉ lệ
Al → 1,5H2 ; Cr → H2; Fe → H2
=> nH2 = 1,5x + m + 1,5n và x = 0,04 – m – n
=> 1,5 (0,04 – m – n) + m + 1,5n = 0,05 => 0,06 - 1,5m - 1,5n + m + 1,5n = 0,05
=> 0,06 – 0,5m = 0,05 => m = 0,02
=> Số mol Cr2O3 phản ứng = m/2 = 0,01 mol
=> h = 0,01/0,015*100% = 66,67%.
- Đến đây ta thấy rằng lượng FeO phản ứng không ảnh hưởng tới kết quả phản ứng của Cr2O3.
Gọi x là % Cr2O3 đã phản ứng
0,5a = 0,04
0,5a*3 - 0,015x*2 = 0,05*2
=> a = 0,08 và x = 0,6667
Hoặc: (0,04*3-0,05*2):2*100:0,015 = 66,667%
A là chất bột màu lục thẫm không tan trong dung dịch loãng của axit và kiềm. Khi nấu chảy A với NaOH trong không khí thu được chất B có màu vàng dễ tan trong nước. B tác dụng với axit chuyển thành chất C có màu da cam. Chất C bị lưu huỳnh khử thành chất A. Chất C oxi hóa HCl thành khí D.
Chọn phát biểu sai:
A là Cr2O3 không tan trong dung dịch loãng của axit và kiềm.
B có màu vàng => B là muối cromat Na2CrO4
C là muối đicromat Na2Cr2O7 có màu da cam
Khí D là sản phẩm phản ứng oxi hóa khử => D là Cl2
Phát biểu sai là D
Cho chất X (CrO3) tác dụng với lượng dư NaOH, thu được hợp chất Y của crom. Đem chất Y cho tác dụng với dung dịch H2SO4 loãng, dư, thu được hợp chất Z của crom. Đem chất Z tác dụng với dung dịch HCl dư, thu được khí T. Phát biểu nào sau đây không đúng?
CrO3 + 2NaOH → Na2CrO4 (Y)+ H2O
→ X có màu đỏ thẫm → C đúng
Y có màu vàng → D sai
2Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
→ Z là Na2Cr2O7 → A đúng
Z + HCl : Na2Cr2O7 + 14HCl → 2NaCl + 2CrCl3 + 7H2O + 3Cl2
→ khí T là Cl2 → B đúng
Dung dịch trong nước của chất nào dưới đây có màu da cam?
A. dung dịch K2Cr2O7 có màu da cam
B. dung dich KCl không có màu
C. dung dich K2CrO4 có màu vàng.
D. dung dich KMnO4 có màu tím
Trong công nghiệp kim loại Cr được điều chế bằng phương pháp nào sau đây?
Trong công nghiệp, Cr được điều chế bằng phương pháp nhiệt nhôm
Cr2O3 + 2Al \(\xrightarrow{{{t^0}}}\) Cr + Al2O3
Phương pháp này điều chế được Cr có độ tinh khiết từ 97-99%

