Thực hiện thí nghiệm điều chế clo theo sơ đồ sau:
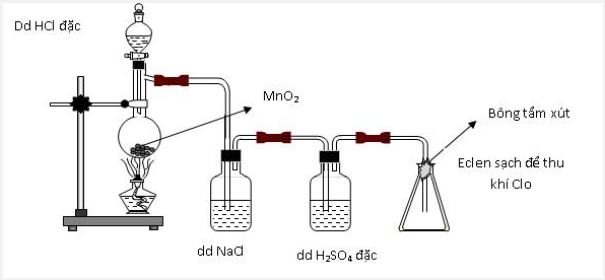
Cho các nhận định sau:
(a) Bình chứa dung dịch NaCl dùng để giữ khí HCl.
(b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước.
(c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước.
(d) Có thể thay chất rắn trong bình cầu thành thuốc tím.
Số nhận định chính xác là:
(a) Bình chứa dung dịch NaCl dùng để giữ khí HCl.
=> đúng
(b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước.
=> đúng
(c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước.
=> sai vì nước không giữ được khí clo vì nước phản ứng rất yếu với clo
(d) Có thể thay chất rắn trong bình cầu thành thuốc tím.
=> đúng vì thuốc tím cũng là một chất oxi hóa mạnh tương tự như MnO2
Vậy có 3 phát biểu đúng.
Hòa tan hoàn toàn m gam KMnO4 trong dung dịch HCl đặc, nóng thu được 4,48 lít khí Cl2 (đktc). Giá trị m là:
\({n_{C{l_2}(dktc)}} = \frac{{{V_{C{l_2}}}}}{{22,4}} = \frac{{4,48}}{{22,4}} = 0,2\,(mol)\)
PTHH: 2KMnO4 + 16HCl \(\xrightarrow{{{t^0}}}\) 2KCl + MnCl2 + 5Cl2 + 8H2O
(mol) 0,08 ← 0,2
Theo PTHH: \({n_{KMn{O_4}}} = \frac{2}{5}{n_{C{l_2}}} = \frac{2}{5}.0,2 = 0,08\,(mol)\)
→ mKMnO4 = nKMnO4×MKMnO4 = 0,08×(39 + 55 + 16.4)= 12,64 (g)
Thể tích khí clo (đktc) và khối lượng natri cần dung để điều chế 4,68 gam NaCl, hiệu suất phản ứng 80% là (cho Na = 23 ; Cl = 35,5)
\({n_{NaCl}} = \frac{{{m_{NaCl}}}}{{{M_{NaCl}}}} = \frac{{4,68}}{{58,5}} = 0,08\,(mol)\)
PTHH: 2Na + Cl2 \(\xrightarrow{{{t^0}}}\) 2NaCl
(mol) 0,08 0,04 ← 0,08
Theo PTHH: nNa = nNaCl = 0,08 (mol) → mNalí thuyết = 0,08.23 = 1,84 (g)
Theo PTHH: nCl2 = 1/2 nNaCl = 0,04 (mol) → VCl2 (đktc) lí thuyết = 0,04.22,4 = 0,896 (lít)
Vì %H = 80% nên khối lượng thực tế Na cần lấy là: \({m_{Na\,thuc\,te}} = \frac{{m{\,_{Na\,li\,thuyet}}}}{{\% H}}.100\% = \frac{{1,84}}{{80\% }}.100\% = 2,3\,(g)\)
Thể tích thực Cl2 cần lấy là: \(V{\,_{C{l_2}(dktc)\,thuc\,te}} = \frac{{V{\,_{C{l_2}(dktc)\,li\,thuyet}}}}{{\% H}}.100\% = \frac{{0,896}}{{80\% }}.100\% = 1,12\,(lit)\)
Dẫn 2 luồng khí clo đi qua 2 dung dịch KOH: dung dịch thứ nhất loãng và nguội, dung dịch thứ 2 đậm đặc và đun nóng ở 1000 C. Nếu lượng muối KCl sinh ra trong 2 dung dịch bằng nhau thì tỷ lệ thể tích khí clo đi qua dung dịch KOH thứ nhất và dung dịch thứ 2 là:
PTHH khi qua dd KOH thứ nhất: Cl2 + 2KOH \(\xrightarrow{{}}\) KCl + KClO + H2O (1)
PTHH khi đi qua dd KOH thứ hai: 3Cl2 + 6KOH \(\xrightarrow{{{{100}^0}C}}\)5KCl + KClO3 + 3H2O (2)
Đặt \(\left\{ \begin{array}{l}{n_{Cl2\,(1)}}:a(mol)\\{n_{Cl2\,(2)}}:\,b(mol)\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{n_{KCl(1)}} = a(mol)\\{n_{KCl(2)}} = \frac{5}{3}b(mol)\end{array} \right.\)
Theo bài khối lượng KCl sinh ra ở 2 PTHH bằng nhau 2 muối bằng nhau, tức số mol muối KCl ở 2 PTHH bằng nhau. \( \Rightarrow a = \frac{5}{3}b \Rightarrow \frac{a}{b} = \frac{5}{3}\)
Cho 10,8g kim loại R tác dụng hết với Cl2 tạo thành 53,4 gam muối. Kim loại R là
Giả sử kim loại R có hóa trị là n (n = 1, 2, 3)
BTNT "R" ta có: R → RCln
R.........R + 35,5n (gam)
Đề bài: 10,8...........53,4
=> 53,4R = 10,8(R + 35,5n) => R = 9n
 Vậy R là kim loại Al.
Vậy R là kim loại Al.
Hấp thụ hết V lít khí Cl2 (đktc) vào 600 ml dung dịch NaOH 0,6M (ở nhiệt độ thường) thu được dung dịch Y chứa 3 chất tan có cùng nồng độ mol. Giá trị của V là
nNaOH = 0,6.0,6 = 0,36 mol
Do sau phản ứng thu được 3 chất tan nên suy ra dung dịch sau phản ứng gồm NaCl, NaClO và NaOH dư
PTHH: Cl2 + 2NaOH → NaCl + NaClO + H2O
x 2x dư: 0,36-2x x x
Do 3 chất tan trong Y có nồng độ mol bẳng sau nên suy ra số mol của chúng bằng nhau:
=> nNaCl = nNaClO = nNaOH dư => x = x = 0,36 - 2x => x = 0,12 mol
=> nCl2 = x = 0,12 mol => VCl2 = 0,12.22,4 = 2,688 lít
Đun nóng 48,2 gam hỗn hợp X gồm KMnO4 và KClO3, sau một thời gia thu được 43,4 gam hỗn hợp chất rắn Y. Cho Y tác dụng hoàn toàn với dung dịch HCl đặc, sau phản ứng thu được 15,12 lít Cl2(đktc) và dung dịch gồm MnCl2, KCl và HCl dư.Số mol HCl phản ứng là
\(X\left\{ \matrix{
K\mathop {Mn}\limits^{ + 7} {O_4} \hfill \cr
K\mathop {Cl}\limits^{ + 5} {O_3} \hfill \cr} \right.\buildrel {{t^0}} \over
\longrightarrow \left\{ \matrix{
Y:{K_2}Mn{O_4},Mn{O_2},KCl,KMn{O_4}du,KCl{O_3}du\buildrel { + H\mathop {Cl}\limits^{ - 1} } \over
\longrightarrow \left\{ \matrix{
\mathop {Mn}\limits^{ + 2} \mathop {C{l_2}}\limits^{ - 1} ,K\mathop {Cl}\limits^{ - 1} ,HCldu \hfill \cr
\mathop {C{l_2}}\limits^0 :0,675\,mol \hfill \cr} \right. \hfill \cr
\mathop {{O_2}:}\limits^0 0,15\,mol \hfill \cr} \right.\)
BTKL ta có:
mO2 = mX – mY = 48,2 -43,4 = 4,8 (g) => nO2= 0,15(mol)
Trong X đặt số mol KMnO4 và KClO4 lần lượt là a và b (mol)
Ta có:
\(\left\{ \matrix{
{m_X} = 158a + 122,5b = 48,2 \hfill \cr
\buildrel {BTe} \over
\longrightarrow 5a + 6b = 0,15.4 + 0,675.2 \hfill \cr} \right. \Rightarrow \left\{ \matrix{
a = 0,15 \hfill \cr
b = 0,2 \hfill \cr} \right.\)
BTNT “Mn”: nMnCl2 = nKMnO4 = 0,15 (mol)
BTNT “K’: nKCl = nKMnO4 + nKClO3 = 0,15 + 0,2 = 0,35 (mol)
BTNT “Cl”: nKClO3 + nHCl = 2nMnCl2 + nKCl + 2nCl2 => nHCl = 2.0,15 + 0,35 +2.0,675 – 0,2 = 1,8 (mol)
Cho m gam KMnO4 tác dụng với dung dịch HCl đặc dư thu được dung dịch X chứa HCl dư và 28,07 gam hai muối và V lít khí Cl2 (đktc). Lượng khí Cl2 sinh ra oxi hóa vừa đủ 7,5 gam hỗn hợp gồm Al và kim loại M có có tỉ lệ mol Al : M = 1: 2. Kim loại M là
16 HCl +2 KMnO4 →2 KCl + 2 MnCl2 + 8 H2O + 5 Cl2
Theo PTHH: n KCl = n MnCl2 = x
Khối lượng muối = 28,07 => m KCl + m MnCl2 = 28,07
=> x. 74,5 + x. 126 = 28,07 => x = 0,14 mol
n KCl = n MnCl2 = 0,14 mol
theo PTHH => n Cl2 = n KCl. 5: 2 = 0,14. 5: 2 = 0,35 mol
=> theo định luật bảo toàn e: n M . x + n Al. 3 = n Cl2. 2 = 0,7 mol
có tỉ lệ mol Al: M = 1: 2 = > n Al = a thì n M = 2 a
=> 2a. x + a. 3 = 0,7 mol
Với x = 1 => a = 0,175 mol => m Al = 0,175. 27 = 4,725 g
=> m M = 7,5 – 4,725 = 2,775 g
M M = 2,775: (0,175.2) = 7,9 (loại)
Với x = 2 => a = 0,1 mol => m Al = 27. 0,1 = 2,7 g
=> m M = 7,5 – 2,7 = 4,8 g
MM = 4,8: (0,1. 2) = 24 (Mg , chọn)
Vậy kim loại cần tìm là Mg
Cho 25 gam nước clo vào một dung dịch có chứa 2,5 gam KBr thấy dung dịch chuyển sang màu vàng đậm và KBr vẫn còn dư. Sau thí nghiệm, nếu cô cạn dung dịch thì còn lại 1,61 gam chất rắn khan. Biết hiệu suất phản ứng là 100%, nồng độ % của nước clo là
Tính toán theo PTHH: 2 KBr + Cl2 →2 KCl + Br2
Với 1 mol KBr (119 gam) → KCl (74,5 gam) => giảm 44,5 gam
Với 1 mol => giảm 44,5 gam
Với x mol => giảm: 2,5 – 1,61 = 0,89 g
=> x = 0,89: 44,5 = 0,02 mol
=> Theo PTHH n Cl2 = n KCl : 2 = 0,01 mol
=> m Cl2 = 0,01. 71 = 0,71 g
=> C% Cl2 = 0,71: 25. 100% = 2,84%
Hỗn hợp khí A gồm clo và oxi. A phản ứng vừa hết với một hỗn hợp gồm 4,8 gam Mg và 8,1 gam Al tạo ra 37,05 gam hỗn hợp các muối clorua và oxit của hai kim loại. Phần trăm theo thể tích của clo trong hỗn hợp ban đầu là:
nMg = 0,2 mol và nAl = 0,3 mol
Bảo toàn khối lượng : mAl + mMg + mCl2 + mO2 = mmuối clorua + moxit
=> 8,1 + 4,8 + 71nCl2 + 32nO2 = 37,05 (1)
Các hợp chất sau phản ứng gồm : MgCl2 ; MgO ; Al2O3 ; AlCl3
Bảo toàn electron: 2nCl2 + 4nO2 = 2nMg + 3nAl = 1,3 (2)
Giải (1) và (2) => nCl2 = 0,25 ; nO2 = 0,2 mol
=> %VCl2 = 55,56%

