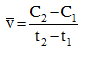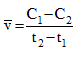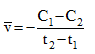Người ta nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clanhke (trong quá trình sản xuất xi măng) là đã tăng yếu tố nào sau đây để tăng tốc độ của phản ứng?
Người ta nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clanhke (trong quá trình sản xuất xi măng) là đã tăng diện tích bề mặt chất phản ứng để tăng tốc độ của phản ứng
Cho phản ứng hóa học sau:
\(4N{H_{3{\text{ }}(k)}} + 3{O_{2{\text{ }}(k)}}\underset{{{v_n}}}{\overset{{{v_t}}}{\longleftrightarrow}}2{N_{2{\text{ }}(k)}} + 6{H_2}{O_{\left( h \right)}},\Delta H < 0 \)
Có bao nhiêu yếu tố ảnh hưởng đến tốc độ phản ứng trên trong số các yếu tố sau: nhiệt độ, nồng độ, áp suất, diện tích tiếp xúc, chất xúc tác.
Tất cả các yếu tố trên đều ảnh hưởng đến tốc độ phản ứng.
Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng sau:
\({\text{2KCl}}{{\text{O}}_{\text{3}}}{\text{(r)}}\,\,\,\xrightarrow{{{t^o}}}\,\,\,{\text{2KCl(r)}}\,\,{\text{ + }}\,\,{\text{3}}{{\text{O}}_{\text{2}}}{\text{(k)}}\)
Yếu tố áp suất chỉ ảnh hưởng đến chuyển dịch cân bằng chứ không làm tăng tốc độ phản ứng
(B-2014) Thực hiện phản ứng sau trong bình kín: H2 (k) + Br2 (k) → 2HBr (k).
Lúc đầu nồng độ hơi Br2 là 0,072 mol/l. Sau 2 phút, nồng độ hơi Br2 còn lại là 0,048 mol/l. Tốc độ
trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên là
=> v = ∆C/∆t = (0,072 – 0,048) /1 20 = 2.10-4 mol/(l.s)
(B-2009) Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
![]()
nO2 = 1,5.10-4 mol
=> nH2O2 phản ứng= 3.10-4 mol
=> ∆CH2O2 = n/V = 3.10-4/0,1 = 3.10-3 M
=> v = ∆C/∆t = 3.10-3 / 60 = 5.10-5 mol/(l.s)
Cho phản ứng: Na2S2O3 (l) + H2SO4 (l) → Na2SO4 (l) + SO2 (k) + S (r) + H2O (l).
Khi thay đổi một trong các yếu tố: (1) tăng nhiệt độ; (2) tăng nồng độ Na2S2O3; (3) giảm nồng độ H2SO4; (4) giảm nồng độ Na2SO4; (5) giảm áp suất của SO2; (6) dùng chất xúc tác. Có bao nhiêu yếu tố làm tăng tốc độ của phản ứng đã cho?
Các yếu tố thỏa mãn: (1) ; (2) ; (6)
Có hai mẫu đá vôi:
Mẫu 1: đá vôi có dạng khối.
Mẫu 2: đá vôi có dạng hạt nhỏ.
Hòa tan cả hai mẫu đá vôi bằng cùng một thể tích dung dịch HCl dư có cùng nồng độ. Ta thấy thời gian để mẫu 1 phản ứng hết nhiều hơn mẫu 2. Thí nghiệm trên chứng minh điều gì?
Mẫu 2 chứa đá vôi có dạng hạt nhỏ, mẫu 1 chứa đá vôi dạng khối
⟹ Diện tích tiếp xúc của mẫu 2 với dung dịch HCl lớn hơn mẫu 1.
⟹ Mẫu 2 tan nhanh hơn trong dung dịch HCl so với mẫu 1.
Vậy thí nghiệm này chứng minh tốc độ phản ứng phụ thuộc vào diện tích tiếp xúc giữa các chất phản ứng.
Đồ thị dưới đây biểu diễn sự phụ thuộc của tốc độ phản ứng vào nồng độ chất phản ứng.

Từ đồ thị trên, ta thấy tốc độ phản ứng
Theo đồ thị ta thấy khi nồng độ chất phản ứng tăng, tốc độ phản ứng tăng.
Cho phản ứng: X → Y
Tại thời điểm t1 nồng độ của chất X bằng C1, tại thời điểm t2 (với t2>t1), nồng độ của chất X bằng C2. Tốc độ trung bình của phản ứng trong khoảng thời gian trên được tính theo biểu thức nào sau đây ?
Vì C1>C2; t2>t1 => \(\overline v = \frac{{{C_1} - {C_2}}}{{{t_2} - {t_1}}}\)
Đổ một lượng dung dịch H2SO4 vào cốc đựng dung dịch Na2S2O3 được 40 ml dung dịch X. Nồng độ ban đầu của H2SO4 trong dung dịch X bằng 0,05M. Sau 20 giây quan sát phản ứng, thấy nồng độ H2SO4 chỉ còn 15% so với ban đầu và trong cốc xuất hiện m gam kết tủa vàng. Tốc độ trung bình của phản ứng trong 20 giây quan sát (tính theo H2SO4) và giá trị của m lần lượt là
Sau 20 giây quan sát phản ứng, thấy nồng độ H2SO4 chỉ còn 15% so với ban đầu
⟹ Nồng độ H2SO4 đã phản ứng bằng 100% – 15% = 85% nồng độ ban đầu
⟹ ∆CH2SO4 = CH2SO4(pứ) = 0,05.85% = 0,0425 M.
⟹ nH2SO4 (pứ) = 0,0425.0,04 = 1,7.10-3 mol.
Tốc độ trung bình của phản ứng trong khoảng thời gian 20 giây theo H2SO4 là \(\overline v = \dfrac{{0,0425}}{{20}} = 2,{125.10^{ - 3}}\) mol/(l.s)
PTHH của phản ứng xảy ra: Na2S2O3 + H2SO4 → S↓ + SO2 + H2O + Na2SO4
⟹ nS ↓ = nH2SO4 pứ = 1,7.10-3 mol
Vậy khối lượng kết tủa vàng là m = mS = 1,7.10-3.32 = 0,0544 g.