Thí nghiệm nào sau đây có kết tủa sau phản ứng ?
A không thu được kết tủa vì Cr(OH)3 tan trong dung dịch kiềm
B không thu được kết tủa vì Al(OH)3 sinh ra tan trong HCl
C sai vì CO2 dư thu được muối Ca(HCO3)2
D đúng vì Al(OH)3 không tan trong NH3
Cho các chất : Al, Al2O3, Al2(SO4)3, Zn(OH)2, NaHS, KHSO3, (NH4)2CO3. Số chất đều phản ứng được với dung dịch HCl, dung dịch NaOH là :
Các chất vừa phản ứng được với dung dịch HCl, vừa phản ứng với NaOH là Al, Al2O3, Zn(OH)2, NaHS, KHSO3, (NH4)2CO3
Cho các chất : Al, Al2O3, Al2(SO4)3, Zn(OH)2, NaHS, KHSO3, (NH4)2CO3. Số chất có tính lưỡng tính là :
Chất có tính lưỡng tính là chất tác dụng được với dung dịch NaOH và dung dịch HCl và không làm thay đổi số oxi hóa
=> Al2O3, Zn(OH)2, NaHS, KHSO3, (NH4)2CO3 là những chất lưỡng tính
Hoà tan m gam hỗn hợp gồm Al, Fe vào dung dịch H2SO4 loãng (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cho dung dịch Ba(OH)2 (dư) vào dung dịch X, thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi, thu được chất rắn Z là :
$\left\{ \begin{gathered}Al \hfill \\Fe \hfill \\ \end{gathered} \right.\xrightarrow{{ + {H_2}S{O_4}}}dd{\text{X}}\left\{ \begin{gathered}A{l_2}{(S{O_4})_3} \hfill \\FeS{O_4} \hfill \\ \end{gathered} \right.\xrightarrow{{Ba{{(OH)}_2}}} \downarrow Y:\,\,\left\{ \begin{gathered}Fe{(OH)_2} \hfill \\BaS{O_4} \hfill \\ \end{gathered} \right.\xrightarrow{{ + {O_2},{t^o}}}Z\left\{ \begin{gathered}
F{e_2}{O_3} \hfill \\BaS{O_4} \hfill \\ \end{gathered} \right.$
Cho Na vào dung dịch chứa Al2(SO4)3 và CuSO4 thu được khí (A), dung dịch (B) và kết tủa (C). Nung kết tủa (C) thu được chất rắn (D). Cho khí (A) dư tác dụng với rắn (D) thu được rắn (E). Hoà tan (E) trong HCl dư thu được rắn (F). Rắn (F) là :
Cho Na vào dung dịch xảy ra phản ứng:
2Na + 2H2O → 2NaOH + H2
Al2(SO4)3 + 3NaOH → Al(OH)3 + Na2SO4
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Al(OH)3 + NaOH → Na[Al(OH)4]
=> A là khí H2
=> dung dịch B chứa Na2SO4 và có thể có Na[Al(OH)4]
Kết tủa C là Cu(OH)2 và có thể có Al(OH)3
Nung C => rắn D: CuO, Al2O3
Sơ đồ phản ứng:
$NaOH + \left\{ \begin{gathered} A{l_2}S{O_4} \hfill \\ CuS{O_4} \hfill \\ \end{gathered} \right. \to \left\{\begin{gathered} dd(B):N{a_2}S{O_4},Na[Al{(OH)_4}{\text{]}} \hfill \\ \downarrow (C):Cu{(OH)_2},Al{(OH)_3}\xrightarrow{{{t^o}}}(D):CuO,A{l_2}{O_3}\xrightarrow{{ + {H_2},{t^o}}}(E):Cu,A{l_2}{O_3}\xrightarrow{{ + HCl}}(F)Cu \hfill \\ \end{gathered} \right.$
Cho chuỗi biến hóa sau :
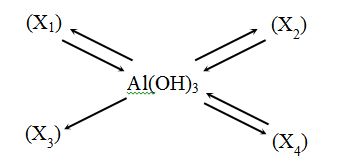
Vậy X1, X2, X3, X4 lần lượt là :
Vì Al(OH)3 tạo ra X3 mà X3 không tạo được ra Al(OH)3 => X3 là Al2O3
Trong các ứng dụng được cho là của nhôm dưới đây, có mấy ứng dụng chưa chính xác ?
(1) Làm vật liệu chế tạo ôtô, máy bay, tên lửa, tàu vũ trụ;
(2) Sản xuất thiết bị điện (dây điện điện), trao đổi nhiệt (dụng cụ đun nấu).
(3) Sản xuất, điều chế các kim loại quí hiếm (Au, Pt, Ag).
(4) Trang trí nội thất và mạ đồ trang sức.
(5) Chế tạo hỗn hợp tecmit, được dùng để hàn gắn đường ray.
Al không dùng để sản xuất, điều chế các kim loại quí hiếm (Au, Pt, Ag); Trang trí nội thất và mạ đồ trang sức.
Cho hỗn hợp dạng bột hai kim loại Mg và Al vào dung dịch có hòa tan hai muối AgNO3 và Cu(NO3)2. Sau khi phản ứng kết thúc, thu được hỗn hợp hai kim loại và dung dịch D. Như vậy :
2 kim loại thu được là Ag và Cu
=> Mg và Al phản ứng hết => dung dịch D chứa Mg(NO3)2, Al(NO3)3 và có thể còn Cu(NO3)2 dư
Hòa tan hết a mol Al vào dung dịch chứa 2a mol NaOH thu được dung dịch X. Kết luận nào sau đây đúng?
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
a a a
=> dung dịch X chứa a mol NaAlO2 và a mol NaOH
A.Sục CO2 dư vào dung dịch thu được:
CO2 + NaAlO2 + 2H2O → Al(OH)3 ↓ + NaHCO3
a a a
NaOH + CO2 → NaHCO3
=> sau phản ứng thu được a mol kết tủa
B sai vì X chứa NaOH phản ứng được với dung dịch CuSO4
C. thêm 2a mol HCl vào X
NaOH + HCl → NaCl + H2O
a a
NaAlO2 + HCl + H2O → NaCl + Al(OH)3
a a a
=> thu được a mol kết tủa
D sai vì dung dịch X làm quỳ chuyển xanh
Cho các kim loại Na, Ca, Al, Fe. Chỉ dùng nước cất có thể nhận biết được mấy kim loại ?
Nhận biết được cả 4 kim loại :
|
|
Na |
Ca |
Al |
Fe |
|
H2O |
Sủi bọt khí, tạo dung dịch trong suốt |
Sủi bọt khí, tạo dung dịch vẩn đục |
Không hiện tượng |
Không hiện tượng |
|
NaOH |
|
|
Sủi bọt khí |
Không hiện tượng |
Các hidroxit: Ba(OH)2, NaOH, Al(OH)3, Fe(OH)3 được kí hiệu ngẫu nhiên là X, Y, Z, T. Kết quả thí nghiệm của X, Y, Z, T được ghi ở bảng sau:
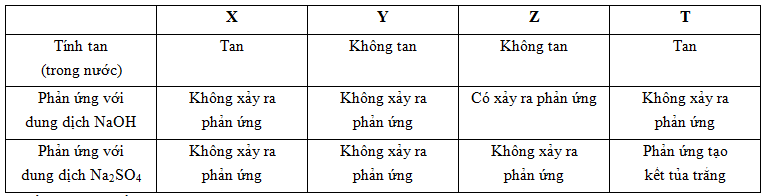
Chất X, Y, Z, T lần lượt là:
- Y, Z không tan trong nước => Al(OH)3 và Fe(OH)3
+ Z tan trong NaOH => Z là Al(OH)3 (PTHH: Al(OH)3 + NaOH → NaAlO2 + 2H2O)
+ Y là Fe(OH)3
- Z, T tan trong nước => Ba(OH)2, NaOH
+ T + H2SO4 tạo kết tủa trắng => T là Ba(OH)2 (PTHH: Ba(OH)2 + H2SO4 → BaSO4 + 2H2O)
+ X là NaOH
Cho các kim loại: Ba, Mg, Al, Fe, Ag. Chỉ dùng dung dịch H2SO4 loãng sẽ nhận biết được bao nhiêu kim loại?
|
|
Ba |
Mg |
Al |
Fe |
Ag |
|
H2SO4 loãng |
Sủi bọt khí, tạo kết tủa trắng |
Sủi bọt, tạo dung dịchh trong suốt |
Sủi bọt, tạo dung dịch trong suốt. |
Sủi bọt, tạo dung dịch trong suốt |
Không hiện tượng |
|
Ba(OH)2 |
|
Kết tủa trắng, không tan |
Kết tủa trắng, tan dần |
Kết tủa trắng xanh |
|
=> nhận biết được cả 5 kim loại
Dân gian xưa kia dùng phèn chua làm thuốc chữa đau răng, đau mắt, cầm máu và đặc biệt dùng làm trong nước. Nguyên nhân nào sau đây làm cho phèn chua có khả năng làm trong nước :
Phèn chua có công thức là KAl(SO4)2.12H2O khi hòa vào nước thì phân ly ra Al3+
Sau đó có phản ứng : Al3+ + 3OH- → Al(OH)3 (kết tủa keo sẽ kéo các hạt bụi bẩn trong nước lắng xuống, từ đó làm trong nước)
Có 3 mẫu hợp kim Fe – Al, K – Na, Cu – Mg. Có thể dùng dung dịch nào dưới đây có thể phân biệt 3 mẫu hợp kim trên ?
- dùng dung dịch NaOH
|
|
Fe - Al |
K - Na |
Cu – Mg |
|
NaOH |
Tan 1 phần, sủi bọt khí |
Tan hoàn toàn, sủi bọt khí |
Không tan |
Cho Al đến dư vào dung dịch gồm NO3-, Cu2+, Fe3+, Ag+. Số phản ứng xảy ra (không kể phản ứng của Al với H2O) là
Al + 3Ag+ → Al3+ + Ag
Al + 3Fe3+ → Al3+ + 3Fe2+
2Al + 3Cu2+ → 2Al3+ + 3Cu
2Al + 3Fe2+ → 2Al3+ + 3Fe

