Hình vẽ sau đây mô tả thí nghiệm điều chế khí Y:
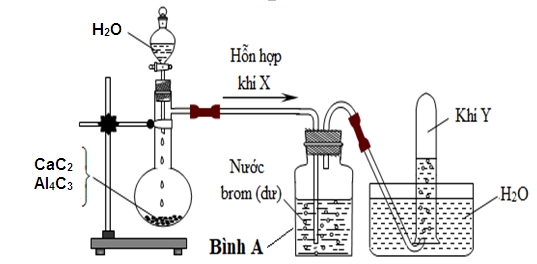
Khí Y là
CaC2 + 2H2O → Ca(OH)2 + C2H2↑
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4↑
Hỗn hợp X gồm C2H2 và CH4. Cho hh này qua bình đựng dd Br2 dư thì C2H2 bị hấp thụ. Khí thoát ra là CH4
C2H2 + 2Br2 → C2H2Br4
Vậy khí Y là CH4
Ankan hòa tan tốt trong dung môi nào sau đây ?
Ankan hoà tan tốt trong dung môi hữu cơ => tan tốt trong benzen
Cho etan qua xúc tác (ở nhiệt độ cao) thu được một hỗn hợp X gồm etan, etilen, axetilen và H2. Tỉ khối của hỗn hợp X đối với etan là 0,4. Nếu cho 0,4 mol hỗn hợp X qua dung dịch Br2 dư thì số mol Br2 đã phản ứng là
Phương trình phản ứng :
$\begin{gathered} {C_2}{H_6}\xrightarrow{{{t^o},\,\,xt}}\,\,{C_2}{H_4} + {H_2}\,\,\,\,\,\,\,\,\,\,(1) \hfill \\ {C_2}{H_6}\xrightarrow{{{t^o},\,\,xt}}\,\,{C_2}{H_2} + 2{H_2}\,\,\,\,\,\,\,(2) \hfill \\ \end{gathered} $
$\begin{gathered} {C_2}{H_4} + B{r_2}\xrightarrow{{}}\,\,{C_2}{H_4}B{r_2}\,\,\,\,\,\,\,(3) \hfill \\ {C_2}{H_2} + 2B{r_2}\xrightarrow{{}}\,\,{C_2}{H_2}B{r_4}\,\,\,\,(4) \hfill \\ \end{gathered} $
Theo các phương trình ta thấy :
+ Số mol khí tăng sau phản ứng bằng số mol H2 sinh ra.
+ Số mol Br2 phản ứng ở (3) và (4) bằng số mol H2 sinh ra ở (1) và (2).
Áp dụng định luật bảo toàn khối lượng ta có :
${{m}_{etan}}=\text{ }{{m}_{X}}~~$
$\Leftrightarrow {{n}_{etan}}.{{M}_{etan}}=\text{ }{{n}_{X}}{{.}_{~}}~{{\overline{M}}_{X}}\Leftrightarrow \frac{{{\text{n}}_{e\tan }}}{{{\text{n}}_{X}}}=\frac{{{\overline{M}}_{X}}}{{{M}_{e\tan }}}=0,4$
Với nX = 0,4 mol => netan = 0,4.0,4 = 0,16 mol
=> ntăng = nH2 sinh ra = nX – netan = 0,4 – 0,16 = 0,24 mol
=> nBr2 phản ứng = nH2 sinh ra = 0,24 mol
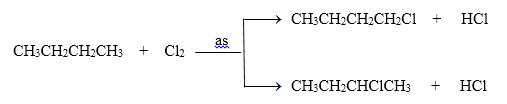
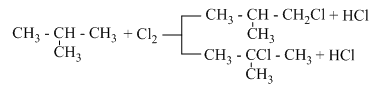
Ankan Y phản ứng với clo tạo ra 2 dẫn xuất monoclo có tỉ khối hơi so với H2 bằng 46,25. Tên của Y là :
Đặt CTPT của ankan là CnH2n+2
Phản ứng của CnH2n+2 với clo tạo ra dẫn xuất monoclo :
${{C}_{n}}{{H}_{2n+2}}+C{{l}_{2}}\xrightarrow{\text{as}}{{C}_{n}}{{H}_{2n+1}}Cl+HCl$ (1)
Theo giả thiết ta thấy CnH2n+1Cl gồm hai đồng phân và ${{M}_{{{C}_{n}}{{H}_{2n+1}}Cl}}=46,25.2=92,5\,\,gam/mol$
=> 14n + 36,5 = 92,5 => n = 4 => CTPT của ankan là C4H10
+) Vì phản ứng tạo 2 dẫn xuất => X là butan hoặc isobutan
Phương trình phản ứng :
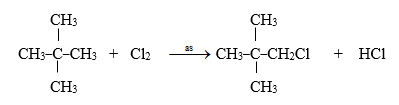
Khi clo hóa một ankan X chỉ thu được một dẫn xuất monoclo duy nhất có tỉ khối hơi đối với hiđro là 53,25. Tên của ankan X là :
Đặt CTPT của ankan là CnH2n+2
Phản ứng của CnH2n+2 với clo tạo ra dẫn xuất monoclo :
${{C}_{n}}{{H}_{2n+2}}\,\,\,\,\,+\,\,\,\,\,\,C{{l}_{2}}\,\,\xrightarrow{\text{as}}\,\,\,{{C}_{n}}{{H}_{2n+1}}Cl\,\,\,\,\,+\,\,\,\,\,HCl$ (1)
Theo giả thiết ${{M}_{{{C}_{n}}{{H}_{2n+1}}Cl}}=53,25.2=106,5\,$=> 14n + 36,5 = 106,5 => n = 5
=>CTPT của ankan là C5H12
Vì phản ứng chỉ tạo ra một sản phẩm duy nhất nên ankan X là 2,2-đimetylpropan.
Phương trình phản ứng :
Cho các chất sau :
C2H6 (I) C3H8 (II) n-C4H10 (III) i-C4H10 (IV)
Nhiệt độ sôi tăng dần theo dãy là :
Vì phân tử i-C4H10 có cấu trúc cồng kềnh hơn n-C4H10 nên tos nhỏ hơn: (IV) < (III)
Nhiệt độ sôi tăng dần khi tăng khối lượng phân tử => (I) < (II) < (IV) < (III)
Cho các chất sau :
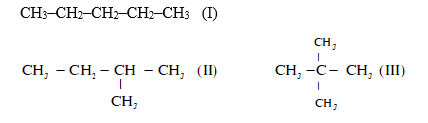
Thứ tự tăng dần nhiệt độ sôi của các chất là :
Cả 3 chất đều có 5C => tos phụ thuộc vào cấu trúc phân tử. Phân tử càng cồng kềnh thì nhiệt độ sôi càng thấp
=> (III) có cấu trúc cồng kềnh nhất => (III) < (II) < (I)
Cracking 8,8 gam propan trong điều kiện thích hợp thu được hỗn hợp Y gồm CH4, C2H4, C3H6, H2 và C3H8 ( biết có 90% C3H8 đã phản ứng). Nếu cho hỗn hợp Y qua nước brom dư thì còn lại hỗn hợp Z có tỉ khối so với H2 bằng 7,3. Xác định khối lượng hiđrocacbon có khối lượng mol phân tử nhỏ nhất trong Z?
Cracking 0,2 mol C3H8 → Hỗn hợp Y gồm CH4, C2H4, C3H6, H2 và C3H8 dư (90% C3H8 phản ứng).
Hỗn hợp Y đi qua nước brom dư thì còn lại hỗn hợp Z có dZ/H2 = 7,3
Đặt nH2 = x mol; nCH4 = y mol
Ta có: nC3H8 phản ứng = nH2 + nCH4 = x + y = 0,2. 90% = 0,18 mol
Hỗn hợp Z gồm x mol H2, y mol CH4 và 0,02 mol C3H8 dư.
Ta có hệ phương trình: \(\left\{ \begin{array}{l}x + y = 0,18\\\frac{{2x + 16y + 44.0,02}}{{x + y + 0,02}} = 7,3.2\end{array} \right. \to \left\{ \begin{array}{l}x = 0,06\\y = 0,12\end{array} \right.\)
Vậy mCH4 = 0,12.16 = 1,92 gam
Thực hiện phản ứng đề hiđro hóa một ankan thu được hỗn hợp khí X có tỉ khối so với H2 bằng 20 (hiệu suất phản ứng đehiđro hóa đạt 80%). Thêm 6,6 gam propan vào a gam hỗn hợp X thu được hỗn hợp Y. Để đốt cháy hoàn toàn hỗn hợp Y cần dùng vừa đủ 397,6 lít không khí (đktc) (giả thiết không khí chứa 20% O2, 80% N2). Giá trị của a là:
Giả sử thực hiện phản ứng đehiđro hóa 1 mol một ankan CnH2n+2 thì nCnH2n+2 phản ứng = nanken = nH2 = 0,8 mol
Suy ra nX = nanken + nH2 + nankan dư = 0,8 + 0,8 + 0,2 = 1,8 mol
Suy ra Mankan = 1,8.20.2 = 72 → 12n + 2n + 2 = 72 → n = 5 → Công thức phân tử của ankan là C5H12.
Ta có: nO2 = 3,55 mol, nC3H8 = 0,15 mol
Ta có nO2 = 8.nC5H12 + 5.nC3H8 = 3,55 mol → nC5H12 = 0,35 mol → a = 25,2 gam
X là hỗn hợp 2 ankan. Để đốt cháy hết 10,2 gam X cần 25,76 lít O2 (đktc). Hấp thụ toàn bộ sản phẩm cháy vào nước vôi trong dư được m gam kết tủa. Giá trị m là:
nO2 = 25,76/22,4 = 1,15 mol
Đặt nCO2 = x và nH2O = y (mol)
+ BTKL: mCO2 + mH2O = mX + mO2
=> 44x + 18y = 10,2 + 1,15.32 (1)
+ BTNT "O": 2nCO2 + nH2O = 2nO2
=> 2x + y = 2.1,15 (2)
Giải hệ thu được x = 0,7 và y = 0,9
Hấp thụ sản phẩm cháy vào nước vôi trong dư thì :
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
Ta thấy: nCaCO3 = nCO2 = 0,7 mol
Suy ra m = mCaCO3 = 0,7.100 = 70 gam

