Hỗn hợp X gồm metan, propan, etilen, buten có tổng số mol là 0,57 mol và tổng khối lượng là m gam. Đốt cháy hoàn toàn m gam X cần 54,88 lít O2 (đktc). Mặt khác cho m gam X qua dung dịch Br2 dư thì thấy số mol Br2 phản ứng là 0,35 mol (biết nguyên tử khối H = 1; C = 12; O = 16; Br = 80). Giá trị của m là
Bước 1: Tính số mol ankan và anken trong hỗn hợp X
Khi cho X tác dụng với dd Br2 dư chỉ có anken phản ứng
\({n_{B{r_2}}} = {n_{anken}} = 0,35\left( {mol} \right) \to {n_{ankan}} = 0,57 - 0,35 = 0,22\left( {mol} \right)\)
Bước 2: Tính số mol CO2 và H2O
Đặt số mol CO2 là x và số mol của H2O là y (mol)
- Ta có: \({n_{{H_2}O}} - {n_{C{O_2}}} = {n_{ankan}}\)
→ y - x = 0,22 (1)
- Bảo toàn nguyên tố O → \(2{n_{{O_2}}} = 2{n_{C{O_2}}} + {n_{{H_2}O}}\)
→ 2.2,45 = 2x + y → 2x + y = 4,9 (2)
Từ (1) (2) → x = 1,56 và y = 1,78
Bước 3: Tính m
- Bảo toàn nguyên tố C → nC(X) = nCO2 = 1,56 mol
- Bảo toàn nguyên tố H → nH(X) = 2.nH2O = 3,56 mol
Vậy m = mC + mH = 1,56.12 + 3,56.1 = 22,28 gam.
Hỗn hợp X gồm metan, propan, etilen, buten có tổng số mol là 0,57 mol và tổng khối lượng là m gam. Đốt cháy hoàn toàn m gam X cần 54,88 lít O2 (đktc). Mặt khác cho m gam X qua dung dịch Br2 dư thì thấy số mol Br2 phản ứng là 0,35 mol (biết nguyên tử khối H = 1; C = 12; O = 16; Br = 80). Giá trị của m là
Bước 1: Tính nanken và nankan
Hỗn hợp gồm ankan và anken.
- Tác dụng với Br2: \({n_{B{r_2}}} = {n_{anken}} = 0,35\left( {mol} \right) \to {n_{ankan}} = 0,57 - 0,35 = 0,22\left( {mol} \right)\)
Bước 2: Tính nCO2 và nH2O
- Đốt X: Đặt số mol CO2 là x và số mol của H2O là y (mol)
Ta có: \({n_{{H_2}O}} - {n_{C{O_2}}} = {n_{ankan}}\)
→ y - x = 0,22 (1)
Bảo toàn nguyên tố O → \(2{n_{{O_2}}} = 2{n_{C{O_2}}} + {n_{{H_2}O}}\)
→ 2.2,45 = 2x + y
→ 2x + y = 4,9 (2)
Từ (1) (2) → x = 1,56 và y = 1,78
Bước 3: Tính mX.
Bảo toàn nguyên tố C → nC(X) = nCO2 = 1,56 mol
Bảo toàn nguyên tố H → nH(X) = 2.nH2O = 3,56 mol
Vậy m = mC + mH = 1,56.12 + 3,56.1 = 22,28 gam.
Đốt cháy hoàn toàn 6,2 gam hỗn hợp X gồm (axetilen, etan và propilen) thu được 0,4 mol nước. Mặt khác 0,5 mol X tác dụng vừa đủ với dung dịch chứa 0,625 mol Br2. Phần trăm thể tích của etan trong hỗn hợp X là:
Gọi số mol của C2H2, C2H6 và C3H6 có trong 6,2 gam X lần lượt là a, b, c mol
=> mhh X = 26a + 30b + 42c = 6,2 (1)
Đốt cháy hoàn toàn X:
C2H2 → H2O ; C2H6 → 3H2O ; C3H6 → 3H2O
Bảo toàn nguyên tử H: $2.{{n}_{{{C}_{2}}{{H}_{2}}}}+6.{{n}_{{{C}_{2}}{{H}_{6}}}}+6.{{n}_{{{C}_{3}}{{H}_{6}}}}=2.{{n}_{{{H}_{2}}O}}$
=> 2a + 6b + 6c = 0,8 (2)
Giả sử trong 0,5 mol X có ka mol C2H2 ; kb mol C2H6 ; kc mol C3H6
=> ka + kb + kc = 0,5 => k.(a + b + c) = 0,5 (3)
X tác dụng vừa đủ với dung dịch chứa 0,645 mol Br2
=> ${{n}_{B{{\text{r}}_{2}}}}=2.{{n}_{{{C}_{2}}{{H}_{2}}}}+{{n}_{{{C}_{3}}{{H}_{6}}}}$ => k.(2a + c) = 0,625 (4)
Từ (3) và (4) => $\dfrac{a+b+c}{2\text{a}+c}=\dfrac{0,5}{0,625}$ (5)
Từ (1), (2) và (5) => a = 0,1 ; b = 0,05 ; c = 0,05
$\Rightarrow \%{{n}_{{{C}_{2}}{{H}_{6}}}}=\dfrac{0,05}{0,1+0,05+0,05}.100\%=25\%$
Nung nóng a mol hỗn hợp X gồm C2H2 và H2 trong bình kín có xúc tác thích hợp thu được hỗn hợp khí Y. Dẫn Y qua lượng dư dung dịch AgNO3 trong NH3, sau khi phản ứng hoàn toàn thu được 24 gam kết tủa và hỗn hợp khí Z. Hỗn hợp Z làm mất màu tối đa 40 gam brom trong dung dịch và còn lại hỗn hợp khí T. Đốt cháy hoàn toàn hỗn hợp T thu được 11,7 gam nước. Giá trị của a là:
C2H2 + 2H2 → C2H6
C2H2 + H2 → C2H4
Trong Y có C2H2, tạo kết tủa Ag2C2 => ${{n}_{A{{g}_{2}}{{C}_{2}}}}=0,1\,mol$
$\Rightarrow {{n}_{{{C}_{2}}{{H}_{2}}(Y)}}=0,1\,mol$
Z làm mất màu dung dịch Br2 => Z chứa C2H4
$=>{{n}_{{{C}_{2}}{{H}_{4}}}}={{n}_{B{{\text{r}}_{2}}}}=0,25\,mol$
Còn lại hỗn hợp khí T gồm C2H6 và H2
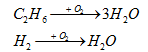
=> ${{n}_{{{H}_{2}}O}}=3.{{n}_{{{C}_{3}}{{H}_{6}}}}+{{n}_{{{H}_{2}}}}$ dư = 0,65 (1)
Bảo toàn nguyên tố C ta có: ${{n}_{{{C}_{2}}{{H}_{2}}}}$ bđầu $={{n}_{{{C}_{2}}{{H}_{2}}\text{ }du}}+\text{ }{{n}_{{{C}_{2}}{{H}_{4}}}}+\text{ }{{n}_{{{C}_{2}}{{H}_{6}}}}$
${{n}_{{{H}_{2}}}}$ ban đầu $={{n}_{{{H}_{2}}\text{ }du}}+{{n}_{{{C}_{2}}{{H}_{4}}}}+2.{{n}_{{{C}_{2}}{{H}_{6}}}}$
Cộng 2 vế phương trình ta có:
$~a={{n}_{{{C}_{2}}{{H}_{2}}\text{ }du}}+2.{{n}_{{{C}_{2}}{{H}_{4}}}}+3.{{n}_{{{C}_{2}}{{H}_{6}}}}+{{n}_{{{H}_{2}}}}_{du}~$
Thay (1) vào => a = 0,1 + 0,25.2 + 0,65 = 1,25
Thực hiện phản ứng crackinh m gam isobutan thu được hỗn hợp X chỉ có các hiđrocacbon. Dẫn hỗn hợp X qua dung dịch chứa 6,4 gam brom, thấy brom phản ứng hết và có 4,704 lít hỗn hợp khí Y (đktc) thoát ra. Tỉ khối hơi của Y so với H2 là 117/7. Giá trị của m là:
C4H10 → C3H6 + CH4
x x x
C4H10 dư = y mol
Sau khi tác dụng với 0,04 mol Br2 thì C3H6 còn lại là: nC3H6 = x – 0,04 mol
Ta có: 58.(x + y) = m
Mà: $\frac{58y+42.(x-0,04)+16\text{x}}{0,21}=117.\frac{2}{7}\Rightarrow 58.(x+y)=8,7$
Hỗn hợp X gồm H2 và hai olefin là đồng đẳng kế tiếp nhau. Cho 8,96 lít hỗn hợp X đi qua xúc tác Ni nung nóng thu được hỗn hợp Y. Dẫn Y qua dd brom dư thấy khối lượng bình tăng 1,82 gam và thoát ra 5,6 lít hỗn hợp khí Z (đktc). Tỉ khối của Z đối với H2 là 7,72. Biết tốc độ phản ứng của hai olefin với hiđro là như nhau. Công thức phân tử và % thể tích của anken có ít nguyên tử cacbon hơn trong X là:
$X\left\{ \begin{gathered}
{H_2} \hfill \\
{C_n}{H_{2n}} \hfill \\
\end{gathered} \right.\xrightarrow{{Ni,{t^o}}}hhY\xrightarrow{{ + B{{\text{r}}_2}\,du}}\left\{ \begin{gathered}
{m_{binh \uparrow }} = 1,82\,gam \hfill \\
hh\,{\text{Z}}\,{\text{(}}{\overline {\text{M}} _Z} = 15,44) \hfill \\
\end{gathered} \right.$
nH2 trong X = nH2 pứ + nH2 dư = nankan + nH2 dư = nZ = 0,25 mol
$ \to 0,4mol\left\{ {\begin{array}{*{20}{l}}{{n_{{C_n}{H_{2n}}}} = 0,4 - 0,25 = 0,15{\mkern 1mu} mol}\\{{n_{{H_2}}} = 0,25{\mkern 1mu} mol}\end{array}} \right.$
=> mZ = 0,25.2.7,72 = 3,86 => mX = mY = mZ + mbình tăng = 3,86 + 1,82 = 5,68 gam
=> molefin trong X = mX – mH2 = 5,68 – 0,25.2 = 5,18 gam
$\Rightarrow {{\bar{M}}_{olefin}}=\frac{5,18}{0,15}=34,533$ => 2 olefin cần tìm là C2H4 (a mol) và C3H6 (b mol)
Ta có: .
$\Rightarrow \%{{n}_{{{C}_{2}}{{H}_{4}}}}=\frac{0,08}{0,4}.100\%=20\%$
Một hỗn hợp X gồm a mol axetilen; 2a mol etilen và 5a mol H2. Cho hỗn hợp X qua Ni nung nóng thu được hỗn hợp Y gồm 4 chất. Đặt k là tỉ khối của hỗn hợp Y so với hỗn hợp X. Hãy cho biết khoảng giá trị của k.
4 chất ở đây là ankan, anken, ankin và H2 nên số mol Y < 8a
Nếu Y có 2 chất (ankan và H2) thì nY = 4a
Vậy ta có:
\({m_X} = {m_Y} \to \frac{{{n_X}}}{{{n_Y}}} = \frac{{{M_Y}}}{{{M_X}}} \to \frac{{8{\rm{a}}}}{{8{\rm{a}}}} = 1 < \frac{{{M_Y}}}{{{M_X}}} < \frac{{8{\rm{a}}}}{{4{\rm{a}}}} = 2\)
=> 1 < k < 2 hay 2 > k > 1
Hỗn hợp khí X gồm propilen và H2. Cho 6,5 gam hỗn hợp X vào một bình kín có chứa một ít bột niken là xúc tác. Đun nóng bình một thời gian thu được hỗn hợp khí Y. Dẫn hỗn hợp Y qua bình đựng dung dịch brom dư thấy có 2,24 lít hỗn hợp khí Z thoát ra (đktc). Biết tỉ khối hơi của Z so với metan là 2,225. Hiệu suất phản ứng cộng giữa propilen với hiđro là
X gồm C3H6, H2 đi qua ống sứ đựng bột Ni => Thu được Y gồm (C3H8; C3H6 và H2 dư)
Cho Y qua brom thì chỉ có C3H6 bị giữ lại => m bình brom tăng = m C3H6
Bảo toàn khối lượng: mX = mY = mbình brom tăng + mZ => mbình brom tăng = mX – mZ = 6,5 - 0,1.16.2,225 = 2,94
$Z:0,1{\mkern 1mu} mol\left\{ {\begin{array}{*{20}{l}}{{H_2}:a{\mkern 1mu} mol}\\{{C_3}{H_8}:b{\mkern 1mu} mol}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{2{\rm{a}} + 44b = 0,1.35,6}\\{a + b = 0,1}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{a = 0,02}\\{b = 0,08}\end{array}} \right.$
=> mbình brom = 2,94 => nC3H6 = 0,07
$\to 6,5{\mkern 1mu} gam{\mkern 1mu} X\left\{ {\begin{array}{*{20}{l}}{{n_{{C_3}{H_6}}} = 0,07 + 0,08 = 0,15{\mkern 1mu} mol}\\{{n_{{H_2}}} = 0,1{\mkern 1mu} mol}\end{array}}\right.$
=> hiệu suất tính theo H2: $H=\frac{0,08}{0,1}.100\%=80\%$
Cho hỗn hợp X gồm: etan, propilen, benzen, metylaxetat, axit propanoic. Đốt cháy hoàn toàn m gam hỗn hợp X cần dùng 4,592 lít (đktc) khí O2 thu được hỗn hợp sản phẩm. Cho toàn bộ sản phẩm cháy vào 100 ml dung dịch Ca(OH)2 1M thu được 5 gam kết tủa và một muối của canxi. Sau phản ứng thấy khối lượng dung dịch tăng 4,3 gam. Phần trăm số mol của hỗn hợp (metyl axetat, axit propanoic) trong X là:
${{n}_{Ca}}=0,1\,mol\xrightarrow{BTNT\,Ca}\left\{ \begin{align}& {{n}_{Ca{{(HC{{O}_{3}})}_{2}}}}=0,05\,mol \\& {{n}_{CaC{{\text{O}}_{3}}}}=0,05\,mol \\\end{align} \right.\xrightarrow{BTNT\,C}{{n}_{C{{O}_{2}}}}={{n}_{C}}=0,15\,mol$.
$\Delta {{m}_{\tan g}}={{m}_{C{{O}_{2}}}}+{{m}_{{{H}_{2}}O}}-{{m}_{CaC{{\text{O}}_{3}}}}\Rightarrow {{m}_{{{H}_{2}}O}}=2,7\,gam\Rightarrow {{n}_{{{H}_{2}}O}}=0,15\,mol$
BTNT O: nO (trong X) + 0,205.2 = 0,15.2 + 0,15 => nO (trong X) = 0,04 mol
Ta thấy các chất trong X đều có 6H
=> ${n_X} = \frac{{0,15.2}}{6} = 0,05{\mkern 1mu} mol{\mkern 1mu} \to \% {n_{hh}} = \frac{{0,02}}{{0,05}}.100\% = 40\% $
Đốt cháy hỗn hợp X chứa 1 ankan, 1 anken và 1 ankin, sản phẩm cháy dẫn qua dung dịch Ba(OH)2 dư thu được 45,31 gam kết tủa, đồng thời khối lượng dung dịch giảm 29,97 gam. Mặt khác, đun nóng hỗn hợp X trên với 0,05 mol H2 (Ni, to) thu được hỗn hợp Y có tỉ khối so với He bằng 5,375. Dẫn toàn bộ Y lần lượt qua bình (1) đựng dung dịch AgNO3/NH3 dư thu được m1 gam kết tủa, bình (2) đựng Br2 dư thấy khối lượng bình tăng m2 gam. Khí thoát ra khỏi bình chứa 2 hiđrocacbon kế tiếp có thể tích là 2,688 lít (đktc). Tổng giá trị m1 và m2 là
${{n}_{C{{O}_{2}}}}={{n}_{BaC{{O}_{3}}}}=0,23\,mol$
$\Delta m={{m}_{BaC{{O}_{3}}}}-({{m}_{C{{O}_{2}}}}+{{m}_{{{H}_{2}}O}})=29,97\Rightarrow \text{ }{{n}_{{{H}_{2}}O}}=0,29$
=> mX = mC + mH = 3,34 gam
Bảo toàn khối lượng => mY = mX + mH2 = 3,34 + 0,05.2 = 3,44
MY = 21,5 => nY = 0,16 mol
Vì trong phản ứng cộng H2 số mol hiđrocacbon không đổi => nX = 0,16 mol
Do MY = 21,5 => trong Y chứa CH4 => khí thoát ra khỏi bình Br2 là CH4 và C2H6
=> X chứa CH4 (x mol), C2H4 (y mol) và C2H2 (z mol)
nX = x + y + z = 0,16
${{n}_{C{{O}_{2}}}}$ = x + 2y + 2z = 0,23
${{n}_{{{H}_{2}}O}}$ = 2x + 2y + z = 0,29
=> x = 0,09; y = 0,04; z = 0,03
Trong Y đặt C2H2 dư (a mol), C2H4 (b mol)
=> nY = a + b + 0,12 = 0,16 (1)
Bảo toàn liên kết π: nπ trong X = nπ trong Y + nH2
=> 2a + b + 0,05 = 0,04 + 2.0,03 (2)
Từ (1) và (2) => a = 0,01 và b = 0,03
=> m1 = ${{m}_{{{C}_{2}}A{{g}_{2}}}}$= 2,4 (gam) và m2 = ${{m}_{{{C}_{2}}{{H}_{4}}}}$= 0,84 (gam)
=> m1 + m2 = 3,24
Hỗn hợp X gồm hiđro và một hiđrocacbon A. Nung nóng 14,56 lít hỗn hợp X (đktc), có Ni xúc tác đến khi phản ứng hoàn toàn thu được hỗn hợp Y có khối lượng 10,8 gam. Biết tỉ khối của Y so với metan là 2,7 và Y có khả năng làm mất màu dung dịch brom. Công thức phân tử của hiđrocacbon là:
$X\left\{ \begin{align}& {{H}_{2}} \\& A \\\end{align} \right.\xrightarrow{Ni,{{t}^{o}}}Y$.
Bảo toàn khối lượng: mX = mY = 10,8 gam
nX = 0,65 mol;
nY = $\frac{{{m}_{Y}}}{{{M}_{Y}}}=\frac{10,8}{16.2,7}=0,25\,mol$
=> Số mol H2 phản ứng: nH2 phản ứng = nhụt đi = nX – nY = 0,65 – 0,25 = 0,4 mol
Phản ứng xảy ra hoàn toàn mà Y làm mất màu brom => H2 phản ứng hết, Y chỉ gồm hiđrocacbon
=> nH2 trong X = 0,4 mol
=> mA = mhh X – mH2 = 10,8 – 0,4.2 = 10 gam
Vì A cộng H2 tạo thành các chất trong Y => nA = nY = 0,25 mol
=> ${{M}_{A}}=\frac{10}{0,25}=40\text{ }\Rightarrow \text{ }{{C}_{3}}{{H}_{4}}$
Một bình kín chứa hỗn hợp X gồm 0,06 mol axetilen; 0,09 mol vinylaxetilen; 0,16 mol H2 và một ít bột Ni. Nung hỗn hợp X thu được hỗn hợp Y gồm 7 hiđrocacbon (không chứa but-1-in) có tỉ khối hơi đối với H2 là 328/15. Cho toàn bộ hỗn hợp Y đi qua bình đựng dung dịch AgNO3/NH3 dư, thu được m gam kết tủa vàng nhạt và 1,792 lít hỗn hợp khí Z thoát ra khỏi bình. Để làm no hoàn toàn hỗn hợp Z cần vừa đúng 50 ml dung dịch Br2 1M. Các phản ứng xảy ra hoàn toàn. Giá trị của m là:
Bảo toàn khối lượng: mY = mX = 6,56 gam
Vì $\Rightarrow {{n}_{{{H}_{2}}}}$phản ứng = nX – nY = 0,16 mol => H2 phản ứng hết
Gọi x và y là số mol C2H2 và C4H4 trong Y
Ta có: nY = nC2H2 + nC4H4 + nZ => x + y = 0,15 – 0,08 = 0,07 (1)
Bảo toàn số mol π: ${{n}_{\pi \,({{C}_{2}}{{H}_{2}})}}+{{n}_{\pi \,({{C}_{4}}{{H}_{4}})}}=\sum{{{n}_{\pi \,trong\,X}}}-{{n}_{\pi \,trong\,Z}}$
=> 2x +3y = 0,06.2 + 0,09.3 – 0,16 – 0,05 = 0,18 mol (2)
Từ (1) và (2) => x = 0,03 mol; y = 0,04 mol
${{n}_{{{C}_{2}}A{{g}_{2}}}}={{n}_{{{C}_{2}}{{H}_{2}}}}=0,03\,mol;\,\,{{n}_{{{C}_{4}}{{H}_{3}}Ag}}={{n}_{{{C}_{4}}{{H}_{4}}}}=0,04\,mol$
=> m = 0,03.240 + 0,04.159 = 13,56 gam
Đốt cháy hoàn toàn 0,25 mol hỗn hợp X gồm hai hidrocacbon mạch hở cần dùng vừa đủ 14 lít O2 (đktc). Hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2, sau khi các phản ứng xảy ra hoàn toàn thu được 30 gam kết tủa và một dung dịch có khối lượng giảm 4,3 gam so với khối lượng dung dịch Ca(OH)2 ban đầu. Mặt khác, cho 8,55 gam X trên tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được tối đa m gam kết tủa. Giá trị của m là
0,25 mol X + 0,625 mol O2 → x mol CO2 + y mol H2O
Khi cho sản phẩm cháy vào dung dịch Ca(OH)2 thì
mdd giảm = mkết tủa - mCO2 – mH2O = 30 – 44x – 18 y = 4,3 → 44x + 18y = 25,7
bảo toàn nguyên tố O có 0,625.2 = 2x + y
→ x = 0,4 mol và y = 0,45 mol
X có số →X có CH4 chất còn lại là CnH2n+2-2k ( với k là số liên kết pi) với số mol lần lượt là a và b mol
Khi đó ta có a + b = 0,25 mol
a + bn = 0,4 mol
2a + b(n+1-k) = 0,45
Từ 3 phương trình trên có b.k = 0,2
Với k = 1 → b = 0,2 → a = 0,05 → n = 1,75 loại
Với k = 2 → b = 0,1 → a = 0,15 → n = 2,5 loai
Với k = 3 → b = 0,2/3 → a = 0,183 → n = 3,25 loại
Với k = 4 → b = 0,05 → a = 0,2 mol → n = 4
→ chất còn lại trong X là C4H2 : CH ≡ C – C ≡ CH
→ 0,2 mol X có m = 0,05. 50 +0,2.16= 5,7 g
Nên trong 8,55 gam X có nC4H2 =
CH ≡ C – C ≡ CH → Ag- C ≡ C – C ≡ C- Ag
0,075 0,075 mol
→ mkết tủa = 0,075.264 =19,8
Hỗn hợp X gồm C2H4, C2H2, C3H8, C4H10. Lấy 6,32g X cho qua bình đựng dung dịch nước Br2 (dư) thấy có 0,12 mol Br2 tham gia phản ứng. Mặt khác, đốt cháy hết 2,24 lít khí X (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được 9,68g CO2. Biết các phản ứng hoàn toàn. Giá trị của V là:
*Đốt cháy 0,1 mol X thu được 0,22 mol CO2:
=> Số C trung bình = nCO2 : nX = 0,22 : 0,1 = 2,2
Giả sử công thức trung bình của hỗn hợp là C2,2H2.2,2+2-2k hay C2,2H6,4-2k (k là độ bất bão hòa)
*Xét phản ứng 6,32 gam X cho qua dung dịch Br2 dư:
C2,2H6,4-2k + k Br2 → Sản phẩm
0,12/k ← k (mol)
mX = nX.MX =>
Vậy X có công thức trung bình là C2,2H5,2
Phản ứng đốt cháy 0,1 mol X:
C2,2H5,2 + 3,5 O2 → 2,2 CO2 + 2,6 H2O
0,1 → 0,35 mol
=> VO2 = 0,35.22,4 = 7,84 lít
Hỗn hợp A chứa 3 ankin với tổng số mol là 0,1 mol. Chia A thành 2 phần bằng nhau. Đốt cháy hoàn toàn phần 1, thu 2,34g nước . Phần 2 tác dụng với vừa đủ 250 ml dung dịch AgNO3 0,12M trong NH3 tạo ra 4,55g kết tủa . Hãy gọi tên và phần trăm khối lượng của từng chất trong hỗn hợp A, biết rằng ankin có phân tử khối nhỏ nhất chiếm 40% về số mol.
- Xét phần 1 : nA1 = nA2 = ½ nA = 0,05 mol
nH(H2O) = nH(A1) = 2nH2O = 2.2,34 : 18 = 0,26 mol
=> Số H trung bình (A) = 0,26 : 0,05 = 5,2
- Xét phần 2 : nAgNO3 = 0,25.0,12 = 0,03 mol < nA2 = 0,05 mol
=> trong A có ankin không phản ứng với AgNO3 => But-2-in
+) Không thể có CH≡CH trong A vì : nC2H2 = nA.40% = 0,02 mol (C2H2 có M nhỏ nhất trong A)
CH≡CH + 2AgNO3 → Ag2C2
0,02 → 0,04 mol > 0,03 (Vô lý)
- Dựa vào Số H trung bình = 5,2 => A phải chứa C3H4 (propin)
=> Bộ 3 ankin phù hợp là propin (0,02 mol) ; but-1-in ; but-2-in
- Tổng quát : RC≡CH + AgNO3 → RC≡CAg ↓
=> nankin = npropin + nbut-1-in = nAgNO3 = 0,03 => nbut-1-in = 0,03 – 0,02 = 0,01 mol
=> nbut-2-in = nA2 – npropin – nbut-1-in = 0,05 – 0,02 – 0,01 = 0,02 mol
=> mA2 = 0,02.MC3H4 + 0,02.MC4H6 + 0,01.MC4H6 = 2,42g
=> %mbut-2-in = 0,02.54 : 2,42 = 44,6%
Đốt cháy hoàn toàn 0,2 mol hỗn hợp X gồm metan, axetilen, buta-1,3-đien và vinyl axetilen thu được 24,2 gam CO2 và 7,2 gam nước. Biết a mol hỗn hợp X làm mất màu tối đa 112 gam Br2 trong dung dịch. Giá trị của a là
nCO2 = 0,55 mol; nH2O = 0,4 mol
Đặt công thức chung của các chất là CnHm
CnHm → nCO2 + 0,5mH2O
0,2 → 0,2n → 0,1m
+ nCO2 = 0,2n = 0,55 => n = 2,75
+ nH2O = 0,1m = 0,4 => m = 4
Vậy công thức trung bình của hỗn hợp X là C2,75H4
Độ bất bão hòa: k = (2C + 2 - H)/2 = (2.2,75 + 2 - 4)/2 = 1,75
Khi cho a mol X tác dụng với Br2: nBr2 = 112 : 160 = 0,7 mol
C2,75H4+ 1,75Br2 → ...
0,4 ← 0,7
Vậy a = 0,4
Đốt cháy hoàn toàn 0,2 mol hỗn hợp X gồm C3H6, C4H4, C3H4, CxHy thì thu được 25,3 gam CO2 và 6,75 gam H2O. Công thức phân tử của CxHy là
Bước 1: Tính số mol của C, H trong X
- BTNT.C ⟹ nC = nCO2 = 25,3/44 = 0,575 mol
- BTNT.H ⟹ nH = 2nH2O = 2.(6,75/18) = 0,75 mol
Bước 2: Tìm số nguyên tử C, H trung bình của X
- Số C trung bình = nC/nX = 0,575/0,2 = 2,875
- Số H trung bình = nH/nX = 0,75/0,2 = 3,75
Bước 3: Biện luận xác định CTPT của CxHy
Ta có:
- Các chất khác đều có số C ≥ 3 ⟹ Hiđrocacbon cần tìm phải có C < 2,875 (*)
- Các chất khác đều có số H ≥ 4 ⟹ Hiđrocacbon cần tìm phải có H < 3,75 (**)
Kết hợp (*) (**) và các đáp án ⟹ CTPT của CxHy là C2H2.
Đốt cháy 12,7 gam hỗn hợp X gồm C4H4, C2H2, C3H6 và H2 cần dùng 1,335 mol O2. Mặt khác, nung nóng 12,7 gam X có mặt Ni làm xúc tác, sau một thời gian thu được hỗn hợp khí Y chỉ gồm các hiđrocacbon có tỉ khối so với He bằng 127/12. Dẫn toàn bộ Y qua bình đựng lượng dư dung dịch AgNO3 trong NH3 thu được 23,98 gam kết tủa; khí thoát ra khỏi bình được làm no hoàn toàn cần dùng 0,11 mol H2 (xúc tác Ni, to) thu được hỗn hợp khí Z có thể tích là 4,032 lít (đktc). Phần trăm khối lượng của C2H2 có trong Y là
Bước 1: Tính số mol C và H trong X
Quy đổi X thành C (x mol) và H (y mol).
+ mC + mH = 12,7 ⟹ 12x + y = 12,7
+ nO2 = x + y/4 = 1,335
⟹ x = 0,92 và y = 1,66
Bước 2: Tính số mol của các chất trong Y
- Giả sử trong Y chứa:
CH≡C-CH=CH2: a mol, CH≡C-CH2-CH3: b mol, CH≡CH: c mol
- m kết tủa = mC4H3Ag + mC4H5Ag + mC2Ag2 = 23,98 gam
⟹ m kết tủa = 159a + 161b + 240c = 23,98 (1)
- nZ = 4,032/22,4 = 0,18 mol
- BTKL pư nung X: mY = mX = 12,7 gam ⟹ nY = 12,7 : (127/3) = 0,3 mol.
- nY = n hiđrocacbon bị AgNO3 hấp thụ + nZ
⟹ a + b + c + 0,18 = 0,3 (2)
- Trong Z chứa:
nC = 0,92 - 4a - 4b - 2c (BTNT.C)
nH = 1,66 - 4a - 6b - 2c + 0,11.2 (BTNT.H)
- Z là ankan nên nếu đốt Z thì: nZ = nH2O - nCO2
0,18 = (1,88 - 4a - 6b - 2c)/2 - (0,92 - 4a - 4b - 2c) (3)
Bước 3: Giải hệ (1)(2)(3) tìm a, b, c => %mC2H2 (Y)
Giải hệ (1)(2)(3): a = 0,04; b = 0,02; c = 0,06.
⟹ %mC2H2 (Y) = 12,28%.
Cho hỗn hợp chất rắn gồm CaC2, Al4C3, Ca vào nước dư thu được hỗn hợp X gồm 3 khí (trong đó có 2 khí có cùng số mol). Lấy 8,96 lít hỗn hợp X (đktc) chia làm 2 phần bằng nhau. Phần 1 cho vào dung dịch AgNO3 trong NH3 (dư), sau phản ứng thu được 24 gam kết tủa. Phần 2 cho qua Ni (đun nóng) thu được hỗn hợp Y. Thể tích O2 (đktc) cần dùng để đốt cháy hoàn toàn Y là
Bước 1: Tính nC2H2, nCH4 và nH2
CaC2, Al4C3, Ca tác dụng với H2O thu được hỗn hợp X gồm 3 khí lần lượt là C2H2; CH4 và H2.
nX = 8,96/22,4 = 0,4 (mol) ⟹ nX trong mỗi phần ứng = 0,2 (mol)
- Phần 1: Chỉ có C2H2 pư
PTHH: C2H2 + AgNO3 + NH3 → Ag2C2↓ + NH4NO3
⟹ nC2H2 = nAg2C2 = 24/240 = 0,1 (mol)
⟹ (nCH4 + nH2) = nX - nC2H2 = 0,2 - 0,1 = 0,1 (mol)
Hỗn hợp X có 2 khí có số mol bằng nhau ⟹ nCH4 = nH2 = 0,1/2 = 0,05 (mol) (vì nếu C2H2 bằng với mol 1 chất khí còn lại thì vô lí).
Bước 2: Tính số mol CO2 và H2O
- Phần 2: Thành phần nguyên tố của hỗn hợp X và Y giống nhau nên đốt Y cũng như đốt X.
\(\left\{ {\begin{array}{*{20}{l}}
{{C_2}{H_2}:0,1} \\
{C{H_4}:0,05} \\
{{H_2}:0,05}
\end{array}} \right. + {O_2} \to \begin{array}{*{20}{l}}
{BTNT{\mkern 1mu} {\mkern 1mu} C:{\mkern 1mu} {\mkern 1mu} {n_{C{O_2}}} = 2{n_{{C_2}{H_2}}} + {n_{C{H_4}}} = 0,25mol} \\
{BTNT{\mkern 1mu} {\mkern 1mu} H:{\mkern 1mu} {\mkern 1mu} {n_{{H_2}O}} = 2{n_{{H_2}}} = 0,25mol}
\end{array}\)
Bước 3: Tính thể tích khí O2 (đktc)
- BTNT O ⟹ nO2 pư = nCO2 + ½ nH2O = 0,25 + ½.0,25 = 0,375 mol
⟹ VO2 (đktc) = 0,375.22,4 = 8,4 (lít).
Đốt cháy 12,0 gam hỗn hợp gồm C2H6, C3H4, C3H8 và C4H10 được hỗn hợp X. Dẫn X qua dung dịch H2SO4 đặc, nhận thấy bình tăng thêm 21,6 gam. Nếu đốt cháy hoàn toàn 100 gam hỗn hợp khí trên thì thải ra môi trường bao nhiêu lít CO2 (đktc)? (C = 12; H = 1; O = 16)
Bước 1: Tính nH
- Bình H2SO4 đặc hấp thụ H2O ⟹ \({m_{{H_2}O}} = 21,6\left( g \right) \to {n_{{H_2}O}} = \dfrac{{21,6}}{{18}} = 1,2\left( {mol} \right)\)
- Bảo toàn nguyên tố H ⟹ \({n_H} = 2{n_{{H_2}O}} = 2 \times 1,2 = 2,4\left( {mol} \right)\)
Bước 2: Tính nCO2
- BTKL hỗn hợp ban đầu: mhh = mC + mH ⟹ \({m_C} = {m_{hh}} - {m_H} = 12 - 2,4 \times 1 = 9,6\left( g \right) \to {n_C} = \dfrac{{9,6}}{{12}} = 0,8\left( {mol} \right)\)
- Bảo toàn nguyên tố C ⟹ \({n_{C{O_2}}} = {n_C} = 0,8\left( {mol} \right) \to {V_{C{O_2}\left( {dktc} \right)}} = 0,8 \times 22,4 = 17,92\left( l \right)\)
Bước 3: Tính VCO2
Tỷ lệ: 12 gam hỗn hợp sinh ra 17,92 lít khí CO2
⟹ 100 gam hỗn hợp sinh ra 149,33 lít khí CO2.

