Trộn 100 ml dung dịch A gồm KHCO3 1M và K2CO3 1M vào 100 ml dung dịch B gồm NaHCO3 1M và Na2CO3 1M thu được dung dịch C. Nhỏ từ từ 100 ml dung dịch D gồm H2SO4 1M và HCl 1M vào dung dịch C thu được V lít CO2 (đktc) và dung dịch E. Cho dung dịch Ba(OH)2 tới dư vào dung dịch E thì thu được m gam kết tủa.Giá trị của m và V lần lượt là :
Dd C có: nHCO−3=0,2 mol; nCO2−3=0,2 mol và Na+ , K+
Dd D: nH+=0,3mol;nSO2−4=0,1molvà Cl-
Nhỏ từ từ D vào C
CO32- + H+ → HCO3-
0,2 → 0,2 → 0,2
H+ + HCO3- → CO2 + H2O
0,1 → 0,1 → 0,1
=> V = 0,1.22,4 = 2,24 lít
E chứa HCO3- (0,3 mol); SO42- (0,1 mol) và các ion khác
Cho Ba(OH)2 dư vào E
Ba2+ + HCO3- + OH- → BaCO3 + H2O
0,3 → 0,3
Ba2+ + SO42- → BaSO4
0,1 → 0,1
=> m = 0,3.197 + 0,1.233 = 82,4 gam
Cho m gam hỗn hợp gồm Na, Na2O, Ba, BaO vào lượng nước dư, thu được dung dịch X và a mol khí H2. Sục khí CO2 đến dư vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:
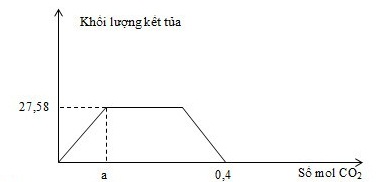
Giá trị của m là
nBa2+ =n↓max =27,58197=0,14 mol (tại thời điểm nCO2 =a=0,14)
Khi nCO2 =0,4 mol : dung dịch thu được gồm: Ba2+ (0,14 mol), HCO3- (0,4 mol) và Na+
BTĐT => nNa+ =nHCO3− −2nBa2+ = 0,12 mol
BT e: 2nBa + nNa = 2nO + 2nH2 => nO = 0,06 mol
m = mBa + mNa + mO = 22,9 gam
Hấp thụ hoàn toàn V lít CO2 (đktc) vào dung dịch chứa đồng thời 0,1 mol Ba(OH)2; 0,255 mol KOH và 0,2 mol NaOH. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và kết tủa Y. Nhỏ từ từ đến hết dung dịch X vào dung dịch chứa 0,35 mol HCl, sinh ra 0,25 mol CO2. Giá trị của V là
nOH−=0,1.2+0,225+0,2=0,625 mol
Do nH+>nCO2 nên X có cả CO32- => X không có Ba2+ => nBaCO3 =nBa(OH)2= 0,1 mol
Đặt x, y là số mol CO32- và số mol HCO3- phản ứng với H+
x + y = nCO2 = 0,25
2x + y = nH+ = 0,35
=> x = 0,1; y = 0,15
Dung dịch X chứa: K+ (0,225 mol), Na+ (0,2 mol), CO32- (0,1k mol), HCO3- (0,15k mol)
BTĐT: 0,225 + 0,2 = 2.0,1k + 0,15k => k = 1,3
BTNT C: nCO2ban đầu =nBaCO3+nCO2−3 + nHCO−3 = 0,1 + 0,13 + 0,195 = 0,425 mol
=> V = 9,52 lít
Dung dịch Z gồm Na2CO3 0,4M, KHCO3 xM. Thêm từ từ 0,5 lít dung dịch Z vào 500 ml dung dịch HCl 1M sau phản ứng hoàn toàn thu được khí và dung dịch Y. Cho dung dịch Ba(OH)2 dư vào dung dịch Y sau phản ứng hoàn toàn thu được 78,8 gam kết tủa. Giá trị x là
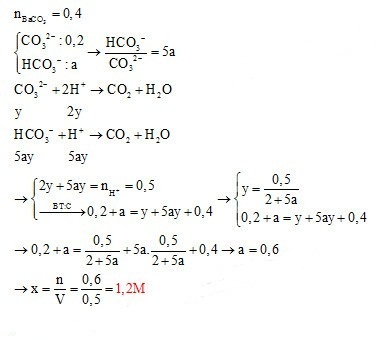
Hấp thụ hết 4,480 lít CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Cho từ từ 100 ml X vào 300 ml dung dịch HCl 0,5M thu được 2,688 lít khí (đktc). Mặt khác, 100 ml X tác dụng với dung dịch Ba(OH)2 dư, thu được 39,4 gam kết tủa. Giá trị của x là
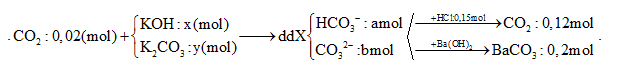
Xét trong 100 ml dung dịch X
BTNT: C => nBaCO3 = a + b = 0,2 (1)
Gọi u và v lần lượt là số mol HCO3- và CO32- tác dụng với HCl với tỉ lệ u/v = a/b
HCO3- + H+ → CO2 + H2O
u → u → u (mol)
CO32- + 2H+ → CO2 + H2O
v → 2v → v (mol)
Ta có hệ phương trình
{∑nH+=u+2v=0,15∑nCO2=u+v=0,12⇒{u=0,09(mol)v=0,03(mol)=>ab=uv=13⇒3a−b=0,2(2)
Từ (1) và (2) => a = 0,05 và b = 0,15 (mol)
Xét trong 200 ml dd X chứa: CO32-: 0,1 ; HCO3-: 0,3; K+ : 0,5 (mol) (Bảo toàn điện tích ra được số mol của K+)
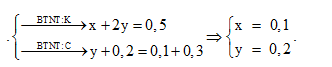
Sục CO2 vào dung dịch chứa Ca(OH)2 và NaOH ta thu được kết quả biểu diễn theo hình bên. Giá trị của x bằng bao nhiêu?
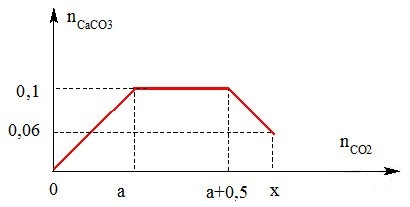
+ Tại nCO2 = a mol:
CO2 + Ca(OH)2 → CaCO3 + H2O
0,1 ← 0,1
a = 0,1 mol
+ Từ nCO2 = a+0,5 đến nCO2 = x có thêm giai đoạn:
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,04←0,04
=> x = 0,04 + a + 0,5 = 0,04 + 0,1 + 0,5 = 0,64 mol
Hấp thụ hết 4,48 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Cho từ từ đến hết 100 ml dung dịch X vào 300 ml dung dịch HCl 0,5M, thu được 2,688 lít khí (đktc). Mặt khác, cho 100 ml dung dịch X tác dụng với đung dịch Ba(OH)2 dư, thu được 39,4 gam kết tủa. Giá trị của x là
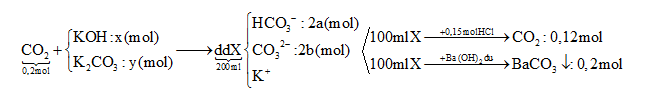
TH1: Nếu trong dd X có OH- dư => dd X chứa OH- dư, CO32-, K+
Khi cho từ từ 100 ml dd X vào 0,15 mol HCl
OH- + H+ → H2O
CO32- + 2H+ → CO2 ↑+ H2O
=> nH+ =nOH−+2nCO2 >0,12.2=0,24 (mol)
=> loại vì nH+=0,15(mol)
Vậy dd X không chứa OH- dư
TH2: dd X không chứa OH- dư ta có sơ đồ bài toán như trên
Khi cho từ từ 100ml dd X vào 0,15 mol HCl có phản ứng:
HCO3- + H+ → CO2 + H2O
x → x → x (mol)
CO32- + 2H+ → CO2 + H2O
y → 2y → y (mol)
Gọi x và y là số mol khi tham gia phản ứng với HCl với tỉ lệ xy=ab
Ta có:
{∑nCO2=x+y=0,12∑nHCl=x+2y=0,15⇒{x=0,09(mol)y=0,03(mol)⇒ab=xy=31=>a=3b(1)
BTNT C: nBaCO3 = a + b = 0,2 (2)
Từ (1) và (2) => a = 0,15 và b = 0,05 (mol)
Trong 200 ml dd X: nHCO−3 =0,3(mol);nCO2−3 =0,1(mol)
Bảo toàn điện tích đối với dd X : nK+ = 0,3 + 0,1.2 = 0,5 (mol)
BTNT C: nCO2(b)+nK2CO3=nHCO−3+nCO2−3 => 0,2 + y = 0,3 + 0,1 => y = 0,2 (mol)
BTNT K: nK+=nKOH+2nK2CO3=>nKOH=0,52.0,2=0,1(mol)
=> x = 0,1 (mol)
Cho một luồng khí CO đi qua ống sứ đựng m gam Fe2O3 nung nóng. Sau một thời gian thu được 44,46 gam hỗn hợp X gồm Fe3O4, FeO, Fe, Fe2O3 dư. Cho X tác dụng hết với dung dịch HNO3 loãng thu được 3,136 lít NO (đktc) duy nhất. Thể tích khí CO (đktc) và m gam Fe2O3 đã dùng là:
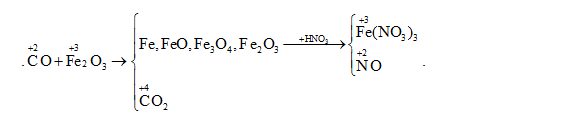
Bảo toàn e cho cả quá trình
=> ne (CO) nhường = n e (HNO3) nhận
=> n CO =0,14.32=0,21( mol)
=> VCO = 4,704 (lít)
Coi X gồm Fe : x (mol) và O : y (mol)
Dùng bảo toàn e và bảo toàn khối lượng
→{56x+16y=44,463x−2y=0,14.3→{x=0,59775=nFe⇒nFe2O3=0,298875y=0,686625=nO
=> mFe2O3 = 0,298875.160 = 47,82 (gam)
Hòa tan hết 34,6 gam hỗn hợp gồm Na, Na2O, Ba, BaO vào nước dư, thu được dung dịch X và a mol khí H2. Sục khí CO2 dư vào dung dịch X, phản ứng được biểu diễn theo sơ đồ sau:
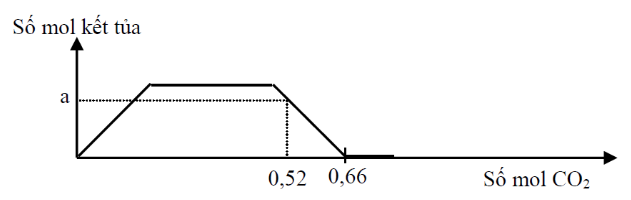
Nếu cho 34,6 gam X tác dụng với 300 ml dung dịch H2SO4 0,4M và HCl 0,6M. Kết thúc phản ứng, thu được dung dịch Y có khối lượng tăng x gam so với dung dịch ban đầu. Giá trị của x là
Hỗn hợp ban đầu chứa Na (x mol); Ba (y mol) và O (z mol)
=> 23x + 137y + 16z = 34,6 (1)
Bảo toàn electron: x + 2y = 2z + 2a (2)
Trên đồ thị, khi CO2 = 0,66 thì kết tủa bị hòa tan hết => nHCO−3=0,66
Bảo toàn điện tích => x + 2y = 0,66 (3)
Tại nCO2 = 0,53 thì kết tủa bị hòa tan 1 phần
nBaCO3=a⇒nBa(HCO3)2=y−a và nNaHCO3=x
Bảo toàn C => a + 2.(y – a) + x = 0,52 (4)
Từ (1), (2), (3), (4) => x = 0,3; y = 0,18; z = 0,19; a = 0,14
nH2SO4=0,12⇒nBaSO4=0,12
Δm=34,6−mBaSO4−mH2=6,36 => tăng 6,36 gam
Cho từ từ dung dịch HCl 1M đến dư vào 200 ml dung dịch X chứa Na2CO3 và NaHCO3. Phản ứng được biểu diễn theo đồ thị sau:
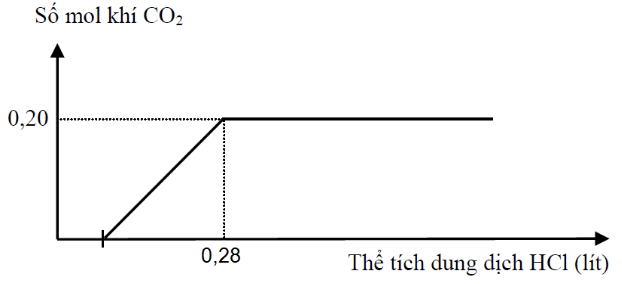
Nếu cho từ từ 200 ml dung dịch X vào 175 ml dung dịch HCl 1M, thu được V lít khí CO2 (đktc). Giá trị của V là
X chứa nCO2−3=a vˊa nHCO−3=b
=> nCO2 max = a + b = 0,2
nHCl = 2a + b = 0,28
=> a = 0,08 và b = 0,12 => a/b = 2/3
Khi cho từ từ X vào HCl, đặt 2x và 3x là số mol CO32- và HCO3- phản ứng
=> nH+ = 2x.2 + 3x = 0,175
=> x = 0,025
=> nCO2 = 5x = 0,125
=> V = 2,8 lít

