Trong phòng thí nghiệm, nitơ tinh khiết được điều chế từ:
Trong phòng thí nghiệm, người ta thường điều chế N2 bằng phương pháp đun nóng dung dịch NH4NO2 bão hòa:
NH4NO2 \(\xrightarrow{{{t^o}}}\) N2 + 2H2O
Khí N2 tương đối trơ ở nhiệt độ thường là do
Ở điều kiện thường, nitơ khá trơ về mặt hóa học do phân tử nitơ có liên kết ba bền vững.
Phản ứng nitơ thể hiện tính khử là
A. \(N_2^0 + 6Li \to 2L{i_3}\mathop N\limits^{ - 3} \Rightarrow {N_2}\) thể hiện tính oxi hóa.
B. \(N_2^0 + 2Al \to 2Al\mathop N\limits^{ - 3} \Rightarrow {N_2}\) thể hiện tính oxi hóa.
C. \(N_2^0 + O_2 \to 2\mathop N\limits^{ +2}O \Rightarrow {N_2}\) thể hiện tính khử.
D. \(N_2^0 + 3H_2 \to 2\mathop N\limits^{ - 3} H_3 \Rightarrow {N_2}\) thể hiện tính oxi hóa.
Trong phòng thí nghiệm có thể điều chế N2 bằng cách
NaNO2 + NH4Cl → N2 + NaCl + 2H2O
Khí nitơ tương đối trơ ở nhiệt độ thường là do
Phân tử N2 có chứa 1 liên kết ba bền vững nên nitơ tương đối trơ ở nhiệt độ thường
Để điều chế một lượng nhỏ nitơ trong phòng thí nghiệm ta cần đun nóng hỗn hợp dung dịch bão hòa các muối:
Trong phòng thí nghiệm, người ta điều chế N2 bằng cách đun nóng dung dịch NaNO2 và NH4Cl:
NaNO2 + NH4Cl \(\xrightarrow{{{t^o}}}\) NaCl + N2 + 2H2O
Điểm giống nhau giữa N2 và CO2:
Đáp án C
Ở nhiệt độ thường, nitơ phản ứng được với:
Ở nhiệt độ thường, N2 phản ứng được với Li
N2 + 6Li → 2Li3N
Khí N2 tương đối trơ về mặt hóa học ở nhiệt độ thường do nguyên nhân chính là
Do phân tử N2 có chứa liên kết 3 rất bền vững, không phân cực và có năng lượng lớn nên N2 tương đối trơ về mặt hóa học ở điều kiện thường.
Cho N (Z = 7). Cấu hình electron của Nitơ là?
Nito có cấu hình e là: 1s22s22p3
Trong phòng thí nghiệm, N2 được điều chế từ
Trong phòng thí nghiệm người ta điều chế N2 bằng cách đun nóng dung dịch NH4NO2:
NH4NO2 \(\xrightarrow{{{t^o}}}\) N2 + 2H2O
Khí N2 tương đối trơ ở nhiệt độ thường là do
Khí N2 tương đối trơ ở nhiệt độ thường là do trong phân tử N2 chứa liên kết 3 rất bền
Cho hình vẽ mô tả thí nghiệm điều chế khí Y từ dung dịch chứa chất X
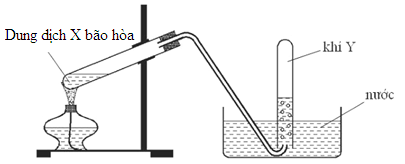
Cặp chất X, Y phù hợp là
Từ hình vẽ ta thấy khí Y thu bằng phương pháp đẩy nước → khí Y không tan hoặc tan rất ít trong nước
Vậy cặp chất X, Y phù hợp là NH4NO2 và N2
\(N{H_4}N{O_2}\xrightarrow{{{t^0}}}{N_2} + 2{H_2}O\)
Cấu hình electron lớp ngoài cùng của nguyên tố nitơ là
Cấu hình electron lớp ngoài cùng của nguyên tố nitơ là : 2s22p3
Nhóm nitơ gồm những nguyên tố nào ?
Nhóm nitơ gồm N, P, As, Sb, Bi.
Các nguyên tố thuộc nhóm nitơ đều thuộc các nguyên tố họ
Các nguyên tố thuộc nhóm nitơ đều thuộc các nguyên tố họ p
Thứ tự tăng dần tính oxi hóa của các đơn chất O2, F2, N2 là
Thứ tự tăng dần tính oxi hóa của các đơn chất O2, F2, N2 là: N2 < O2 < F2.
Ở điều kiện thường, nitơ khá trơ về mặt hóa học là do
Ở điều kiện thường, nitơ khá trơ về mặt hóa học là do phân tử nitơ có liên kết ba khá bền.
Nitơ thể hiện tính khử khi phản ứng với
Nitơ thể hiện tính khử khi phản ứng với chất có tính oxi hóa => O2
${{N}_{2}}+{{O}_{2}}\overset{{{t}^{o}},xt}{\leftrightarrows}2NO$
Nhận xét nào đúng về tính oxi hóa khử của N2 ?
N2 thể hiện tính khử khi tác dụng với O2 và thể hiện tính oxi hóa khi tác dụng với kim loại (Mg, Li)

