Cho các phản ứng sau:
(1) CH4 + O2 $\xrightarrow{xt,{{t}^{o}}}$ CH2O + H2O
(2) 2C4H10 + 5O2 $\xrightarrow{xt,{{t}^{o}}}$ 4C2H4O2 + 2H2O
(3) 2C2H6 + 12O2 $\xrightarrow{xt,{{t}^{o}}}$ 3C + 9CO2 + 6H2O
(4) C3H8 + 5O2 $\xrightarrow{xt,{{t}^{o}}}$ 3CO2 + 4H2O
Số phản ứng thuộc loại phản ứng oxi hóa không hoàn toàn là
Các phản ứng oxi hóa không hoàn toàn là (1), (2) và (3) vì số oxi hóa của C trong sản phẩm chưa đạt tối đa
Đốt cháy hoàn toàn V lít (đktc) hỗn hợp X gồm CH4, C2H4 thu được 0,15 mol CO2 và 0,2 mol H2O. Giá trị của V là
Gọi số mol CH4 và C2H4 là a, b
BTNT: 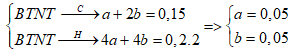
V= (0,05+ 0,05). 22,4 = 2,24 lít
Hỗn hợp khí X gồm hai anken kế tiếp nhau trong dãy đồng đẳng. Đốt cháy hoàn toàn 5 lít hỗn hợp X cần vừa đủ 18 lít khí oxi (các thể tích đo ở cùng điều kiện nhiệt độ, áp suất). CTPT của hai anken là
+) Gọi công thức của 2 anken là: \({C_{\overline n }}{H_{2\overline n }}\)
PTHH:
\(\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{C_{\overline n }}{H_{2\overline n + 1}} + \dfrac{{3\overline n }}{2}{O_2} \to \overline n C{O_2} + \overline n {H_2}O\)
\(PT\,\,\,\,\,\,\,\,\,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\dfrac{{3\overline n }}{2}\)
\(DB\,\,\,\,\,\,\,\,\,5\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,18\)
\( = > \overline n = 2,4\)
Công thức của 2 anken là: C2H4 và C3H6
Đốt cháy hoàn toàn 0,1 mol hỗm hợp gồm CH4, C4H10 và C2H4 thu được 0,14 mol CO2 và 0,23 mol H2O. Số mol của ankan và anken trong hỗn hợp lần lượt là
Gọi số mol CH4, C4H10 và C2H4 là a, b, c (mol)
Ta có: 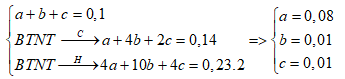
Số mol ankan = 0,08 + 0,01 = 0,09 mol
Số mol anken = 0,01 mol
Đốt cháy hoàn toàn a gam hỗn hợp A gồm 4 anken đồng đẳng kế tiếp cần dùng vừa đủ b lít khí oxi (ở đktc) thu được 5,28 gam CO2. Giá trị của b là
Hỗn hợp A gồm các anken => đốt cháy thu được nCO2 = nH2O = 0,12 mol
Bảo toàn nguyên tố O: 2.nO2 = 2.nCO2 + nH2O
\({n_{{O_2}}} = \dfrac{{2.0,12 + 0,12}}{2} = 0,18\)
\(b = 0,18.\,\,22,4 = 4,032\,\,lit\)
Một hỗn hợp X gồm 2 hiđrocacbon liên tiếp nhau trong dãy đồng đẳng. Đốt cháy hoàn toàn 0,5 mol hỗn hợp X thu được 29,12 lít khí CO2 (đktc) và 23,4 gam H2O. Công thức phân tử và thành phần % khối lượng tương ứng của hai hiđrocacbon là
nCO2 = nH2O = 1,3 mol => Gọi công thức của 2 hiđrocacbon là:
\({C_{\overline n }}{H_{2\overline n }}\)
\(\overline n = \dfrac{{{n_{C{O_2}}}}}{{{n_{hh}}}} = \dfrac{{1,3}}{{0,5}} = 2,6\)=> CTPT của 2 chất là C2H4 và C3H6
Gọi số mol C2H4 và C3H6 là a, b (mol)
Ta có: 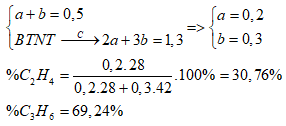
Đốt cháy hoàn toàn 0,1 mol hỗm hợp gồm CH4, C4H10 và C2H4 thu được 0,14 mol CO2 và 0,23 mol H2O. Số mol của ankan và anken trong hỗn hợp lần lượt là
Gọi số mol CH4, C4H10 và C2H4 là a, b, c (mol)
Ta có: 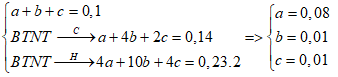
Số mol ankan = 0,08 + 0,01 = 0,09 mol
Số mol anken = 0,01 mol
Một hỗn hợp X gồm 2 hiđrocacbon A, B có cùng số nguyên tử cacbon. A, B chỉ có thể là ankan hay anken. Đốt cháy 4,48 lít (đkc) hỗn hợp X thu được 26,4g CO2 và 12,6g H2O. Xác định CTPT và số mol của A, B trong hỗn hợp X.
nH2O > nCO2 => Trong X có chứa ankan
Gọi công thức của anken A là CxH2x và ankan B là CxH2x+2
Số C = nCO2 : n hỗn hợp = 0,6: 0,2 = 3 => CTPT của A là C3H6 và CTPT của B là C3H8
Gọi số mol C3H6 và C3H8 là a, b (mol)
Ta có: 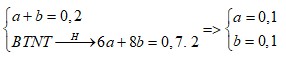
Một hỗn hợp khí gồm 1 ankan và 1 anken có cùng số nguyên tử C trong phân tử và có cùng số mol. Lấy m gam hỗn hợp này thì làm mất màu vừa đủ 80 gam dung dịch Br2 20%. Đốt cháy hoàn toàn m gam hỗn hợp đó thu được 0,6 mol CO2. Ankan và anken đó có công thức phân tử là
Do ankan và anken có cùng số nguyên tử C nên gọi CTPT của ankan và anken là CnH2n+2 và CnH2n với số mol là a (mol)
nBr2 = 0,1 mol
Chỉ có anken phản ứng với Br2 theo tỉ lệ mol 1:1 => n CnH2n = n CnH2n+2 = n Br2 = a = 0,1 mol
BTNT C: 0,1. n + 0,1. n = 0,6 => n = 3
CTPT của Ankan và anken là C3H8 và C3H6
Đốt cháy hoàn toàn 0,1 mol anken X thu được CO2 và hơi nước. Hấp thụ toàn bộ sản phẩm cháy bằng 100 gam dung dịch NaOH 21,62% thu được dung dịch mới trong đó nồng độ của NaOH chỉ còn 5%. Công thức phân tử đúng của X là
Gọi công thức của anken là CnH2n
Khi đốt cháy: nCO2 = nH2O = 0,1 n (mol)
nNaOH = 0,5405 mol
n NaOH p/u = 0,1n . 2 = 0,2n mol
=> n NaOH dư = 0,5405 – 0,2n (mol)
m dd sau phản ứng = m CO2 + m H2O + m dd NaOH = 6,2n + 100 (gam)
Ta có:
\(\dfrac{{(0,5405 - 0,2n).\,40}}{{6,2n + 100}} = \dfrac{{5}}{{100}} \to n = 2\)
CTPT của X là C2H4
Một hỗn hợp A gồm hai hiđrocacbon X, Y liên tiếp nhau trong cùng dãy đồng đẳng. Đốt cháy 11,2 lít hỗn hợp X thu được 57,2 gam CO2 và 23,4 gam H2O. Công thức phân tử của X, Y và khối lượng của X, Y là
nCO2 = nH2O = 1,3 mol => Gọi công thức của 2 hiđrocacbon là:\({C_{\overline n }}{H_{2\overline n }}\)
\(\overline n = \dfrac{{{n_{C{O_2}}}}}{{{n_{hh}}}} = \dfrac{{1,3}}{{0,5}} = 2,6\)
=> CTPT của 2 chất là C2H4 và C3H6
Gọi số mol C2H4 và C3H6 là a, b (mol)
Ta có: 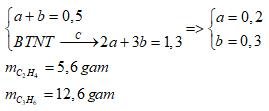
Đem đốt cháy hoàn toàn 0,1 mol hỗn hợp X gồm 2 anken là đồng đẳng kế tiếp nhau thu được CO2 và hơi nước có khối lượng hơn kém nhau 6,76 gam. Công thức phân tử của 2 anken đó là
Khi đốt cháy anken ta luôn thu được nCO2 = nH2O
Đặt nCO2 = nH2O = a mol
Theo đề bài ta có: mCO2 – mH2O = 6,76 <=> 44a – 18a = 6,76 => a = 0,26 mol
Gọi công thức của 2 hiđrocacbon là: \({C_{\overline n }}{H_{2\overline n }}\)
Ta có: \(\overline n = \dfrac{{{n_{C{O_2}}}}}{{{n_{hh}}}} = \dfrac{{0,26}}{{0,1}} = 2,6\)
Vậy công thức của 2 anken là : C2H4 và C3H6
Đốt cháy hoàn toàn 0,1 mol anken X thu được CO2 và hơi nước. Hấp thụ hoàn toàn sản phẩm bằng 100 gam dung dịch NaOH 21,62% thu được dung dịch mới trong đó nồng độ của NaOH chỉ còn 5%. Công thức phân tử đúng của X là
Gọi công thức của anken là CnH2n
Khi đốt cháy: nCO2 = nH2O = 0,1 n (mol)
nNaOH = 0,5405 mol
n NaOH p/u = 0,1n . 2 = 0,2n mol
=> n NaOH dư = 0,5405 – 0,2n (mol)
m dd sau phản ứng = m CO2 + m H2O + m dd NaOH = 6,2 n + 100 (gam)
Ta có: \(\dfrac{{(0,5405 - 0,2n).\,40}}{{6,2n + 100}} = \dfrac{5}{{100}} < = > n = 2\)
CTPT của X là C2H4
Một hỗn hợp A gồm 2 hiđrocacbon X, Y liên tiếp nhau trong cùng dãy đồng đẳng. Đốt cháy 11,2 lít hỗn hợp X thu được 57,2 gam CO2 và 23,4 gam H2O. CTPT X, Y và khối lượng của X, Y là:
nCO2 = nH2O = 1,3 mol => Gọi công thức của 2 hiđrocacbon là: \({C_{\overline n }}{H_{2\overline n }}\)
\(\overline n = \dfrac{{{n_{C{O_2}}}}}{{{n_{hh}}}} = \dfrac{{1,3}}{{0,5}} = 2,6\) => CTPT của 2 chất là C2H4 và C3H6
Gọi số mol C2H4 và C3H6 là a, b (mol)
Ta có:
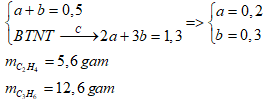
Đốt cháy hoàn toàn 0,4 mol hỗn hợp hai anken X và Y là đồng đẳng liên tiếp thu được m gam nước và (m +39) gam CO2 . Công thức phân tử của hai anken X và Y là
Khi đốt cháy anken ta luôn thu được nCO2 = nH2O
Đặt nCO2 = nH2O = a mol
Theo đề bài ta có: mCO2 – mH2O = 39 <=> 44a – 18a = 39 => a = 1,5 mol
Gọi công thức của 2 hiđrocacbon là: \({C_{\overline n }}{H_{2\overline n }}\)
Ta có: \(\overline n = \dfrac{{{n_{C{O_2}}}}}{{{n_{hh}}}} = \dfrac{{1,5}}{{0,4}} = 3,75\)
Vậy công thức của 2 anken là : C3H6 và C4H8
Phản ứng oxi hóa hoàn toàn là
Các phản ứng oxi hóa không hoàn toàn là (A), (B) và (C) vì số oxi hóa của Cacbon trong sản phẩm chưa đạt tối đa
Phản ứng oxi hóa hoàn toàn là (D) vì số oxi hóa của Cacbon trong sản phẩm đã đạt tối đa
Cho phản ứng: CnH2n + KMnO4 + H2O → CnH2n+2O2 + MnO2 + KOH. Tổng hệ số cân bằng của phản ứng (khi tối giản) là
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n+2O2 + 2MnO2 + 2KOH
=> tổng hệ số cân bằng = 3 + 2 + 4 + 3 + 2 + 2=16
Cho phản ứng sau:
CnH2n + KMnO4 + H2O → CnH2n(OH)2 + KOH + MnO2.
Tổng hệ số (nguyên, tối giản) của các chất trong phương trình phản ứng trên là
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n(OH)2 + 2KOH + 2MnO2.
=> tổng hệ số cân bằng = 3 + 2 + 4 + 3 + 2 + 2 = 16
Cho phản ứng sau:
CnH2n + KMnO4 + H2O → CnH2n(OH)2 + KOH + MnO2.
Tổng hệ số (nguyên, tối giản) của các chất trong phương trình phản ứng trên là
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n(OH)2 + 2KOH + 2MnO2.
=> tổng hệ số cân bằng = 3 + 2 + 4 + 3 + 2 + 2 = 16
Chất nào sau đây làm mất màu nước brom?
Các anken phản ứng được với dung dịch brom => propen làm mất màu nước brom

