Trùng hợp propen, sản phẩm thu được có cấu tạo là
![]()
Monome của sản phẩm trùng hợp có tên gọi là polipropilen (P.P) là:
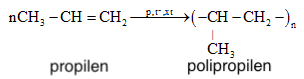
Ứng dụng nào sau đây không phải ứng dụng của etilen ?
Ứng dụng không phải của etilen là điều chế khí ga.
Một phân tử polietilen có khối lượng phân tử bằng 56000u. Hệ số polime hóa của phân tử polietilen này là
M(-CH2-CH2-)n = 28n = 56000 => n = 2000
Vậy hệ số polime là n = 2000
Trùng hợp hoàn toàn 56 lít khí CH3-CH=CH2 (đktc) thì thu được m gam polipropilen (nhựa PP). Giá trị của m là
\(\begin{gathered}{n_{propen}} = \frac{{56}}{{22,4}} = 2,5mol \hfill \\ nC{H_3} - CH = C{H_2} \to {( - C{H_2} - CH(C{H_3}) - )_n} \hfill \\{n_{PP}} = \frac{{2,5}}{n}mol \to {m_{PP}} = \frac{{2,5}}{n}.42n =105gam \hfill \\ \end{gathered} \)
Tiến hành trùng hợp 1 mol etilen ở điều kiện thích hợp, đem sản phẩm sau trùng hợp tác dụng với dung dịch brom dư thì lượng brom phản ứng là 36 gam. Hiệu suất phản ứng trùng hợp và khối lượng polietilen (PE) thu được là
nCH2=CH2 → (-CH2-CH2-)n
Sản phẩm sau trùng hợp tsac dụng với dd Brom dư thì Etilen dư tác dụng với brom
\(\begin{gathered}\to {n_{B{r_2}}} = {n_{{C_2}{H_4}}} = 0,225mol \hfill \\\to {n_{{C_2}{H_4}pu}} = 1 - 0,225 = 0,775mol \hfill \\H = \frac{{{n_{pu}}}}{{{n_{bd}}}}.100\% = \frac{{0,775}}{1}.100\% = 77,5\% \hfill \\{n_{PE}} = \frac{{{n_{{C_2}{H_4}pu}}}}{n} = \frac{{0,775}}{n} \hfill \\\to {m_{PE}} = \frac{{0,775}}{n}.28n = 21,7gam \hfill \\ \end{gathered} \)
Trong phòng thí nghiệm quá trình điều chế etilen thường có lẫn khí CO2 và SO2. Để loại bỏ CO2 và SO2 người ta cho hỗn hợp khí đi qua dung dịch dư nào sau đây?
CO2 + Ca(OH)2 → CaCO3 ↓+ H2O
SO2 + Ca(OH)2 → CaSO3 ↓+ H2O
Etilen không tác dụng với Ca(OH)2
Đun nóng V (ml) ancol etylic 95o với H2SO4 đặc ở 170oC được 3,36 lít khí etilen (đktc). Biết hiệu suất phản ứng là 60% và ancol etylic nguyên chất có d = 0,8 g/ml. Giá trị của V (ml) là
H3C-CH2-OH\(\xrightarrow{{{H_2}S{O_{4d}},{{170}^o}C}}\) CH2=CH2 + H2O
\(\begin{gathered}{n_{{C_2}{H_5}OH(pu)}} = {n_{{C_2}{H_4}}} = 0,15mol \hfill \\ \to {n_{{C_2}{H_5}OH(bd)}} = \frac{{0,15}}{{60\% }} = 0,25mol \hfill \\ \end{gathered} \)
Ta có
\(\begin{gathered}{n_{{C_2}{H_5}OH(bd)}} = \frac{{V.d.95}}{{100.46}} \hfill \\ \to V = \frac{{{n_{{C_2}{H_5}OH(bd)}}.100.46}}{{95.d}} \approx 15,13 \hfill \\ \end{gathered} \)
Cho etan qua xúc tác (ở nhiệt độ cao) thu được một hỗn hợp X gồm etan, etilen, axetilen và H2. Tỷ khối của hỗn hợp X đối với etan là 0,4. Hãy cho biết nếu cho 0,4 mol hỗn hợp X qua dung dịch Br2 dư thì số mol Br2 đã phản ứng là bao nhiêu ?
C2H6 → C2H4 + H2
p/ ứng (mol) a a a
C2H6 → C2H2 + H2
p/ ứng (mol) b b b
hỗn hợp X gồm C2H6 dư (0,4-a-b) mol
C2H4 a mol; C2H2 b mol; H2 (a+b) mol
Ta có:
\(\begin{gathered}{d_{X/e\tan }} = 0,4 \to {M_X} = 12 \hfill \\ \frac{{30}}{{0,4 + a + 2b}} = 12 \to a + 2b = 0,6(mol) \hfill \\ {n_{B{r_2}}} = {n_{{C_2}{H_4}}} + 2{n_{{C_2}{H_2}}} = a + 2b = 0,6(mol) \hfill \\ \end{gathered} \)
Thực hiện phản ứng để hiđrat hóa ancol etylic thu được anken X. Tên gọi của X là:
H3C-CH2-OH → CH2=CH2 + H2O
Sản phẩm của phản ứng đề hidrat hóa ancol etylic là Etilen.
Trùng hợp etilen, sản phẩm thu được có cấu tạo là
Phương trình trùng hợp: nCH2=CH2 → (-CH2-CH2-)n
Trùng hợp but-2-en, sản phẩm thu được có cấu tạo là
Phương trình trùng hợp but-2-en: nCH3-CH=CH-CH3 → (-CH(CH3)-CH(CH2)-)n
Ứng dụng nào sau đây không phải của anken ?
Ứng dụng không phải của anken là: Nguyên liệu sản xuất vật liệu silicat.
Một phân tử polietilen có phân tử khối là 840000 đvC. Hệ số polime hóa của phân tử này là
M(-CH2-CH2-)n = 28n = 840000 => n = 30000
Vậy hệ số polime hóa là n = 30000
Thể tích monome (đktc) cần dùng để sản xuất 70 tấn PE (H = 80%) là
nCH2=CH2 → (-CH2-CH2-)n
mPE = 70 tấn => mmonome theo lí thuyết = 70 tấn
=> mmonome thực tế = 70.100/80 = 87,5 tấn = 87,5.106 gam
=> nC2H4 = 3,125.106 mol => V = 3,125.106.22,4 = 70.106 lít = 70000 m3
Trùng hợp 60 kg propilen thu được m kg polime, biết H = 70%. Giá trị của m là
nCH2=CH-CH3 → (-CH2-CH(CH3)-)n
Theo lí thuyết: mpolime = mpropilen = 60 kg => mpolime thực tế = 60.70/100 = 42 kg
Trong phòng thí nghiệm, C2H4 được điều chế từ
C2H4 có thể được điều chế bằng cách tách nước của C2H5OH.
Phương pháp đề hiđro hóa C2H6; crackinh C4H10 dùng để điều chế C2H4 trong công nghiệp
Cho hình vẽ mô tả thí nghiệm điều chế khí Z từu dung dịch X và chất rắn Y:
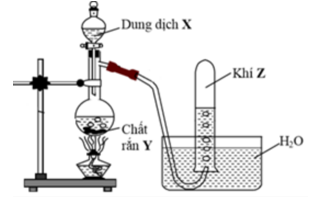
Hình vẽ bên minh họa cho phản ứng nào sau đây ?
A và B sai vì NH3 và HCl là những chất tan tốt trong nước nên không thu khí bằng phương pháp đẩy nước.
C sai vì C2H5OH không phải chất rắn.
D đúng. Chất rắn Y là Zn, dung dịch X là H2SO4 loãng, khí Z là H2 không tan trong nước.
Khối lượng etilen thu được khi đun nóng 230 gam ancol etylic (với H2SO4 đậm đặc, hiệu suất phản ứng đạt 40%) là
C2H5OH → C2H4 + H2O
46 gam 28 gam
230 gam → 140 gam
mC2H4 lí thuyết = 140 gam => mC2H4 thực tế = 140.40/100 = 56 gam
Từ 3,36 lít etan (đktc), tiến hành phản ứng đề hiđro hóa thu được V lít etilen (đktc), biết H = 60%. Giá trị của V là
C2H6 → C2H4 + H2
Theo lí thuyết: VC2H4 lí thuyết = VC2H6 = 3,36 lít
H = 60% => nC2H4 thực tế = 3,36.60/100 = 2,016 lít

