Trộn lẫn 100 ml dung dịch KOH 1M với 50 ml dung dịch H3PO4 1M thì nồng độ mol của muối trong dung dịch thu được là
\({n_{K{\rm{O}}H}} = 0,1.1 = 0,1\,\,mol\)
\({n_{{H_3}P{O_4}}} = 0,05.1 = 0,05\,\,mol\)
\( \to \dfrac{{{n_{K{\rm{O}}H}}}}{{{n_{{H_3}P{O_4}}}}} = \dfrac{{0,1}}{{0,05}} = 2 \to \)muối tạo thành là K2HPO4
PTHH: \(2K{\rm{O}}H + {H_3}P{O_4} \to {K_2}HP{O_4} + 2{H_2}O\)
Theo phương trình, \({n_{{K_2}HP{O_4}}} = {n_{{H_3}P{O_4}}} = 0,05\,\,mol\)
\( \to {C_{M({K_2}HP{O_4})}} = \dfrac{{0,05}}{{0,1 + 0,05}} = 0,33\,\,M\)
Khối lượng dung dịch KOH 8% cần lấy cho tác dụng với 47 gam K2O để thu được dung dịch KOH 21% là
Gọi khối lượng dung dịch KOH 8% cần lấy là m gam
\( \to {m_{K{\rm{O}}H(8\% )}} = \dfrac{{8\% .m}}{{100}} = 0,08m\,\,gam\)
\({n_{{K_2}O}} = \dfrac{{47}}{{94}} = 0,5\,\,mol\)
PTHH:
\({K_2}O + {H_2}O \to 2K{\rm{O}}H\)
Theo phương trình hóa học: \({n_{K{\rm{O}}H}} = 2{n_{{K_2}O}} = 1\,\,mol\)
\( \to \sum {{m_{K{\rm{O}}H}}} = 0,08m + 1.56 = 0,08m + 56\,\,(gam)\)
Khối lượng dung dịch sau phản ứng = m + 47 (gam)
\( \to C{\% _{K{\rm{O}}H(21\% )}} = \dfrac{{0,08m + 56}}{{m + 47}}.100\% = 21\% \to m = 354,85\,\,gam\)
Cho m gam P2O5 tác dụng với 500 ml dung dịch KOH 1M. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X (không chứa H3PO4), cô cạn dung dịch X thu được 193m/71 gam chất rắn khan. Nếu cho X tác dụng với dung dịch BaCl2 dư thì thu được bao nhiêu gam kết tủa?
Đặt nP2O5 = x mol → nH3PO4 = 2x mol
Nếu KOH vẫn còn dư → Chất rắn gồm K3PO4 (2x mol) và KOH dư (0,5- 6x) mol
→ 212.2x + 56. (0,5-6x) = 193.142/171
Suy ra x = 0,094
Loại vì 0,5 - 6x < 0. Vậy KOH phản ứng hết.
Khi đó nH2O = nKOH = 0,5 mol
Theo bảo toàn khối lượng: mH3PO4 + mKOH = mmuối + mH2O
→ 98.2x + 0,5.56 = 193.142x/71 + 0,5.18 → x = 0,1 → m = 14,2
Ta có: nH3PO4 = 0,2 mol và nKOH = 0,5 mol → X chứa K3PO4 (0,1 mol) và K2HPO4 (0,1 mol)
Vậy kết tủa gồm Ba3(PO4)2 (0,05 mol) và BaHPO4 (0,1 mol) → mkết tủa = 53,35 gam
Hòa tan 142 gam P2O5 vào 500 gam dung dịch H3PO4 24,5%. Nồng độ % của H3PO4 trong dung dịch thu được là
nP2O5 = 1 mol; nH3PO4 ban đầu = 1,25 mol
P2O5 + 3H2O → 2H3PO4
1 mol → 2 mol
=> tổng số mol H3PO4 trong dung dịch thu được = 2 + 1,25 = 3,25 mol
=> mH3PO4 = 318,5 gam
mdung dịch thu được = mP2O5 + mdung dịch ban đầu = 142 + 500 = 642 gam
=> C% = 318,5 / 642 . 100% = 49,61%
Cho m gam P2O5 vào 700 ml dung dịch KOH 1M, sau khi kết thúc phản ứng, cô cạn dung dịch thu được (3m + 5,4) gam chất rắn. Giá trị của m là:
Ta có: \({n_{{P_2}{O_5}}} = \frac{m}{{142}}(mol)\)
-TH1: Chất rắn khan chỉ chứa các muối
P2O5 + 3H2O → 2 H3PO4
m/142 2m/142 mol
KOH + H3PO4 → KH2PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
3KOH + H3PO4 → K3PO4 + 3H2O
Vì dung dịch sau phản ứng chỉ chứa muối nên ta có: nH2O = nKOH = 0,7 (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
mKOH + mH3PO4 = mmuối + mH2O → 0,7.56 + 2m.98/142 = 3m + 5,4 + 0,7.18 → m = 13,09 gam
→ nH3PO4 = 2m/142 = 0,184 mol
Ta thấy:
\(\frac{{{n_{KOH}}}}{{{n_{H3PO4}}}} = \frac{{0,7}}{{0,184}} > 3\) → Sau phản ứng có KOH dư → Trường hợp này loại
-TH2: Chất rắn khan chứa muối và KOH dư
P2O5+ 3H2O → 2 H3PO4
\(\frac{m}{{142}}\) \(\frac{{2m}}{{142}}\)mol
3KOH + H3PO4 → K3PO4 + 3H2O
\(\frac{{6m}}{{142}}\) \(\frac{{2m}}{{142}}\) \(\frac{{2m}}{{142}}\) mol
Chất rắn khan chứa 2m/142 mol K3PO4 và (0,7-6m/142) mol KOH
→ 212 . 2m/142+ 56 . (0,7-6m/142) = 3m + 5,4 → m = 14,2 gam
Hoà tan 100 gam P2O5 vào m gam dung dịch H3PO4 48% ta được dung dịch H3PO4 60%. Giá trị của m là :
Phương trình phản ứng :
P2O5 + 3H2O → 2H3PO4
142 → 196 gam
100 → x gam
\( \Rightarrow x = \frac{{100.196}}{{142}} = 138\,\,gam\)
Coi P2O5 là dung dịch H3PO4 có nồng độ phần trăm là : C% = \(\frac{{138}}{{100}}.100\% = 138\% \)
Gọi m1, m2 lần lượt là khối lượng của P2O5 và dung dịch H3PO4 48%.
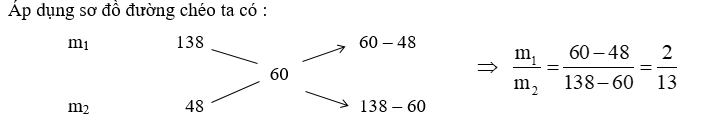
=> \({m_{{\rm{dd}}\,\,{H_3}P{O_4}\,\,48\% }} = {m_2} = \frac{{13}}{2}.100 = 650\,\,gam.\)
Cho 200 ml dung dịch NaOH 1M tác dụng với 200 ml dung dịch H3PO4 0,5M, muối thu được có khối lượng là :
Bước 1: Tính tỉ lệ \( \dfrac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}}\), xác định sản phẩm tạo thành.
Theo giả thiết ta có :
\({n_{NaOH}} = 0,2.1 = 0,2\,\,mol;\,\,{n_{{H_3}P{O_4}}} = 0,2.0,5 = 0,1\,\,mol \Rightarrow \frac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{2}{1}\)\( \Rightarrow \) Sản phẩm tạo thành là Na2HPO4
Bước 2: Viết PTHH.
Phương trình phản ứng :
2NaOH + H3PO4 \( \to \) Na2HPO4 + 2H2O (1)
0,2 → 0,1 → 0,1
Bước 3: Tính toán số mol và khối lượng muối thu được theo PTHH.
Theo (1) ta thấy : \({n_{N{a_2}HP{O_4}}} = 0,1\,\,mol \Rightarrow {n_{N{a_2}HP{O_4}}} = 142.0,1 = 14,2\,\,gam\)
Cho 14,2 gam P2O5 vào 200 gam dung dịch NaOH 8% thu được dung dịch A. Muối thu được và nồng độ % tương ứng là
\({n_{{P_2}{O_5}}} = \dfrac{{14,2}}{{142}} = 0,1\,\,mol;\,\,{n_{NaOH}} = \dfrac{{200.8\% }}{{40}} = 0,4\,\,mol\)
P2O5 + 3H2O → 2H3PO4 (1)
0,1 → 0,2 mol
Tỉ lệ \(\dfrac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}} = \dfrac{2}{1}\)\( \Rightarrow \) Sản phẩm tạo thành là Na2HPO4
Bảo toàn nguyên tố P: \({n_{N{a_2}HP{O_4}}} = {n_{{H_3}P{O_4}}} = 0,2\,\,mol \Rightarrow {m_{N{a_2}HP{O_4}}} = 142.0,2 = 28,4\,\,gam\)
Khối lượng dung dịch sau phản ứng là : \(m = {m_{{\rm{dd}}\,\,NaOH}} + {m_{{P_2}{O_5}}} = 200 + 14,2 = 214,2\,\,mol\)
=> \(C{\% _{N{a_2}HP{O_4}}} = \dfrac{{28,4}}{{214,2}}.100 = 13,26\% \)
Cho 1,32 gam (NH4)2SO4 tác dụng với dung dịch NaOH dư, đun nóng thu được một sản phẩm khí. Hấp thụ hoàn toàn lượng khí trên vào dung dịch chứa 3,92 gam H3PO4. Muối thu được là:
n(NH4)2SO4 = 0,01 mol; nH3PO4 = 0,04 mol
Khí thu được là NH3 => nNH3 = 2.n(NH4)2SO4 = 0,02 mol
Ta có: nOH- = nNH3 = 0,02 mol
Xét tỉ lệ \(\frac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{{0,02}}{{0,04}} = \frac{1}{2} < 1\) => muối thu được là NH4H2PO4
Cho 200 ml dung dịch NaOH 2M tác dụng với 100 ml dung dịch H3PO4 aM thu được 25,95 gam hai muối. Giá trị của a là:
ta có:
nNaOH =0,4(mol)
vì dung dịch sau phản ứng có hai muối => NaOH phản ứng hết
OH- + H+ → H2O
Mol : 0,4 → 0,4 → 0,4
Bảo toàn khối lượng có : mNaOH + mH3PO4 = mmuối + mH2O
=> mH3PO4 = 25,95 + 0,4.18 – 0,4.40 = 17,15 gam
=>nH3PO4 = 0,175 => CH3PO4= 1,75(M)
Đốt cháy hoàn toàn 3,1 gam photpho bằng oxi dư rồi cho sản phẩm tạo thành tác dụng vừa đủ với m gam dung dịch NaOH 32%, thu được muối Na2HPO4. Giá trị của m là :
nP = 0,1 mol
Bảo toàn nguyên tố P : nH3PO4 = nNa2HPO4 = nP = 0,1 mol
Bảo toàn nguyên tố Na: nNaOH = 2.nNa2HPO4 = 0,2 mol
=> mdung dịch NaOH = 0,2.40.100 / 32 = 25 gam
Để trung hoà hoàn toàn dung dịch thu được khi thuỷ phân 4,5375 gam một photpho trihalogenua cần dùng 55 ml dung dịch NaOH 3M. Biết rằng phản ứng thuỷ phân tạo ra hai axit, trong đó có axit H3PO3 là axit hai nấc. Công thức của photpho trihalogenua đó là
Gọi x là số mol PX3 phản ứng
Phương trình phản ứng :
PX3 + 3H2O → H3PO3 + 3HX (1)
mol: x → x → 3x
Trung hòa X bằng NaOH => 2 muối thu được là Na2HPO3 và NaX
Bảo toàn nguyên tố P và X: nNa2HPO3 = nH3PO3 = x mol; nNaX = nHX = 3x mol
Bảo toàn nguyên tố Na: nNaOH = 2.nNa2HPO3 + nNaX => 0,165 = 2x + 3x
=> x = 0,033
\( = > {\rm{ }}{M_{PX3}} = \frac{{4,5375}}{{0,033}} = 137,5\,\)
=> X = 35,5 (Cl)
Từ quặng photphorit, có thể điều chế axit photphoric theo sơ đồ sau :
$Quặng -photphorit\xrightarrow{{{t}^{0}},Si{{O}_{2}},C}P\xrightarrow{{{t}^{0}}}{{P}_{2}}{{O}_{5}}\to {{H}_{3}}P{{O}_{4}}$
Biết hiệu suất chung của quá trình là 90%. Để điều chế được 1 tấn dung dịch H3PO4 49%, cần khối lượng quặng photphorit chứa 73% Ca3(PO4)2 là
mH3PO4 = 1.49 / 100 = 0,49 tấn
Ca3(PO4)2 → 2H3PO4
310 196
0,775 tấn ← 0,49 tấn
=> mCa3(PO4)2 thực tế dùng = 0,775.100 / 90 = 31/36 tấn
=> mquặng = 31/36 . 100/73 = 1,18 tấn
Cho m gam P2O5 vào dung dịch chứa 0,1 mol NaOH và 0,05 mol KOH, thu được dung dịch X. Cô cạn X, thu được 8,56 gam hỗn hợp chất rắn khan. Giá trị của m là
Giả sử kiềm có công thức chung là MOH (M = \(\frac{{0,1.23 + 0,05.39}}{{0,15}} = \frac{{85}}{3}\)) với số mol là 0,15 mol
Nếu phản ứng chỉ tạo 1 muối:
MH2PO4: mmuối = 0,15.376 / 3 = 18,8 gam
M2HPO4: mmuối = \(\frac{{0,15}}{2}.\frac{{458}}{3} = 11,45\,\,gam\)
M3PO4: mmuối = \(\frac{{0,15}}{3}.180 = 9\,gam\)
Vì mchất rắn = 8,56 gam < 9 gam => MOH còn dư, phản ứng tạo muối M3PO4
Đặt nM3PO4 = x mol; nMOH = y mol
mmuối = 180x + 136y/3 = 8,56 (1)
Bảo toàn nguyên tố M: nMOH = 3.nM3PO4 + nMOH => 3x + y = 0,15 (2)
Từ (1) và (2) => x = 0,04 mol; y = 0,03 mol
=> nP2O5 = 0,04 / 2 = 0,02 mol => mP2O5 = 2,84 gam
Cho 4,26 gam P2O5 vào dung dịch chứa x mol KOH và 0,04 mol K3PO4. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa 16,64 gam hai chất tan. Giá trị của x là
nP2O5 = 4,26/142 = 0,03 mol
Nếu phản ứng chỉ tạo 1 muối:
+ KH2PO4 : (0,03.2 + 0,04).136 = 13,6 gam.
+ K2HPO4 : 0,1.174 = 17,4 gam.
+ K3PO4 : 0,1.212 = 21,2 gam.
Ta thấy: 13,6 < mc/tan = 16,64 < 17,4
⟹ chất tan chứa KH2PO4 (a mol) và K2HPO4 (b mol)
⟹ mc/tan = 16,64 = 136a + 174b (1)
BTNT P ⟹ a + b = 0,03.2 + 0,04 (2)
Từ (1)(2) ⟹ a = 0,02 và b = 0,08.
BTNT K ⟹ x + 3.0,04 = 0,02 + 2.0,08
⟹ x = 0,06
Cho m gam P2O5 tác dụng với 400 ml dung dịch NaOH 0,3M, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được 1,55m gam chất rắn. Giá trị của m gần nhất với:
TH1: P2O5 và NaOH pứ vừa đủ tạo muối: nH2O = nNaOH = 0,12mol
P2O5 + H2O → 2H3PO4
m/142 → 2m/142 mol
Có thể xảy ra các PT:
H3PO4 + NaOH → NaH2PO4+ H2O (3)
H3PO4 + 2NaOH → Na2HPO4+ 2H2O (4)
H3PO4 + 3NaOH → Na3PO4 + 3H2O (5)
Bảo toàn khối lượng ta có: mH3PO4 + mNaOH = m rắn + mH2O
(2m/142) . 98 + 0,12 . 40 = 1,55m + 0,12 . 18 →m = 15,555 gam gần nhất với 15,6 gam
TH2: Chất rắn gồm: NaOHdư; Na3PO4
P2O5 + 6NaOH → 2Na3PO4 + 3H2O
m/142 0,12 2m/142 3m/142
Bảo toàn khối lượng ta có: mP2O5 + mNaOHbđ = m rắn + mH2O
m + 0,12 . 40 = 1,55m + 18 . 3m/142 → m = 5,16g (Loại)
Cho 17,04 gam P2O5 vào 200 ml dung dịch NaOH nồng độ aM thu được dung dịch có tổng khối lượng các chất tan bằng 30,12 gam. Giá trị của a là:
P2O5 + 3H2O → 2H3PO4 (1)
Ta có: nH3PO4 = 2.nP2O5 = 0,24 mol; nNaOH = 0,2 a (mol)
H3PO4 + NaOH → NaH2PO4 + H2O (2)
H3PO4 + 2NaOH → Na2HPO4 + 2H2O (3)
H3PO4 + 3NaOH → Na3PO4 + 3H2O (4)
Đặt \((*) = \frac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}}\)
Ta xét các trường hợp sau:
Trường hợp 1: Nếu (*) ≤ 1 → 0,2a / 0,24 ≤ 1→ a ≤ 1,2.
Khi đó chất tan thu được chứa (0,24 – 0,2a) mol H3PO4 dư và 0,2a mol NaH2PO4
→ mchất tan = (0,24 – 0,2a) . 98 + 0,2a . 120 = 30,12 gam → a = 1,5 (Loại)
Trường hợp 2:
+ Nếu 1 < (*) < 3 → 1 < 0,2a / 0,24 < 3 → 1,2 < a < 3,6
Khi đó nNaOH = nH2O = 0,2a (mol)
Dùng định luật bảo toàn khối lượng ta có: mH3PO4 + mNaOH = mmuối + mH2O
→ 0,24 . 98 + 0,2a . 40 = 30,12 + 0,2a . 18 → a = 1,5 (thỏa mãn)
+ Nếu (*) ≥ 3 → 0,2a / 0,24 ≥ 3 → a ≥ 3,6
→ Khi đó chất tan thu được chứa 0,24 mol Na3PO4và (0,2a – 0,24.3) mol NaOH dư
→ mchất tan = 0,24 . 164 + mNaOH dư > 30,12 gam → Loại
Vậy giá trị của a = 1,5.
Hòa tan hết 17,94 gam một kim loại kiềm vào một lượng nước dư thu được dung dịch X. Cho dung dịch X tác dụng với 36,92 gam P2O5 thì thu được dung dịch Y chỉ chứa hai muối có nồng độ mol bằng nhau. Kim loại kiềm là:
nH3PO4 = 2nP2O5 = 2.36,92/142 = 0,52 mol
Gọi kim loại kiềm cần tìm là M.
M + H2O → MOH + ½ H2 ↑
Phản ứng xảy ra theo thứ tự:
P2O5 + 3H2O → 2H3PO4
H3 PO4 + MOH → MH2PO4 + H2O
MH2PO4 + MOH → M2HPO4 + H2O
M2HPO4 + MOH → M3PO4 + H2O
Xét hai trường hợp:
TH1: Hai muối là M2HPO4 và MH2PO4
Dung dịch Y chỉ chứa hai muối có nồng độ mol bằng nhau →n MH2PO4 = nM2HPO4 = 0,26 (mol)
Bảo toàn nguyên tố M ta có: nM = nMH2PO4 + 2n M2HPO4 = 0,78 mol → M = 17,94/0,78 = 23 (Na)
TH2: Hai muối là: M2HPO4 và M3PO4 → n M2HPO4 = n M3PO4 = 0,26 (mol)
Bảo toàn nguyên tố M ta có: nM = 2nM2HPO4 + 3nM3PO4 = 1,3 mol → M = 17,94/1,3 = 13,8 (loại)
Vậy kim loại kiềm cần tìm là Na.
Trộn 100 ml dung dịch gồm Na3PO4 1M và Na2HPO4 1,5M với 200 ml dung dịch H3PO4 1M phản ứng xong thu được dung dịch X. Cô cạn dung dịch X thu được khối lượng chất rắn khan là:
Ta có: nNa3PO4 = 0,1 mol; nNa2HPO4 = 0,15 mol; nH3PO4 = 0,2 mol
(1) 2Na3PO4 + H3PO4 → 3Na2HPO4
Bđ: 0,1 0,2 0,15
Pư: 0,1 → 0,05 → 0,15
Sau: 0 0,2 - 0,05 = 0,15 0,15 + 0,15 = 0,3
Sau phản ứng (1) có 0,15 mol H3PO4 và 0,3 mol Na2HPO4
(2) Na2HPO4 + H3PO4 → 2NaH2PO4
Bđ: 0,3 0,15
Pư: 0,15 ← 0,15 → 0,3
Sau: 0,15 0 0,3
Vậy dung dịch X có chứa 0,3 mol NaH2PO4 và 0,15 mol Na2HPO4.
Cô cạn dung dịch X thu được khối lượng chất rắn khan là:
mchất rắn khan = mNaH2PO4 + mNa2HPO4 = 0,3 . 120 + 0,15 . 142 = 57,3 (gam)
Trộn 200 ml dung dịch Ca(H2PO4)2 1M với 200 ml dung dịch Ca(OH)2 1M. Khối lượng kết tủa thu được là:
Ta có: nH2PO4- = 0,4 mol; nCa2+ = 0,4 mol và nOH- = 0,4 mol
Phản ứng trung hòa:
H2PO4- + OH- → HPO42- + H2O
0,4 0,4 0,4 mol
Phản ứng tạo kết tủa:
Ca2+ + HPO42- → CaHPO4↓
0,4 0,4 0,4 mol
mCaHPO4v = 0,4 . 136 = 54,4 gam

