Đốt cháy hoàn toàn hỗn hợp 2 hidrocacbon (phân tử khối hơn kém nhau 14 đvC), thu được 5m (g) CO2 và 3m (g) H2O. CTPT của 2 hidrocacbon trên là:
Gọi CT chung của hai hidrocacbon là \({C_{\overline x }}{H_{\overline y }}\)
\({C_{\overline x }}{H_{\overline y }} + (\overline x + \dfrac{{\overline y }}{4}){O_2}\underrightarrow {{t^0}}\overline x C{O_2} + \dfrac{{\overline y }}{2}{H_2}O\)
\(\dfrac{{{n_{C{O_2}}}}}{{{n_{{H_2}O}}}} = \dfrac{{2\overline x }}{{\overline y }} = \dfrac{{5m}}{{44}}.\dfrac{{18}}{{3m}} = > \dfrac{{2\overline x }}{{\overline y }} = \dfrac{{15}}{{22}}\)
=> \(\overline y = 2,93\overline x > 2\overline x \)
=> Hai hidrocacbon là ankan
Mặt khác, ta có: \(\overline y = 2\overline x + 2 = > 2,93\overline x = 2\overline x + 2\)
\( = > \overline x = 2,15\)
Hai hidrocacbon đó là C2H6 và C3H8
Đốt cháy hết 2,24 lít ankan X (đktc), dẫn toàn bộ sản phẩm cháy vào dd nước vôi trong dư thấy có 40g kết tủa. CTPT X
nankan = 0,1 mol
nCO2 = n kết tủa = 0,4 mol
Áp dụng công thức : nankan = nH2O – nCO2 => nH2O = 0,1 + 0,4 = 0,5 mol
BTNT C => nC = nCO2 = 0,4 mol
BTNT H=> nH = 2n H2O = 1 mol
nC : nH = 0,4 : 1 = 4 : 10
Vậy CTPT X là C4H10
Đốt cháy 4,4 gam hỗn hợp CH4, C2H4, C3H6, C4H10 cần a mol O2 thu được b mol CO2 và 7,2 gam H2O. Giá trị a, b lần lượt là
nH2O = 0,4 mol => BTNT H: nH = 2.nH2O = 0,8 mol
BTKL: mankan = mC + mH <=> mC = 4,4 – 0,8 = 3,6 gam => nC = 0,3 mol
BTNT C=> nCO2 = nC = 0,3 mol
BTNT O: 2nO2 = 2nCO2 + nH2O => 2a = 0,3. 2 + 0,4 => a = 0,5 mol
Đốt cháy hoàn hỗn hợp X gồm CH4, C2H2, C3H6 thu được 2,24 lít CO2 (ở đktc) và 2,52 gam H2O.
Thể tích khí O2 đã tham gia phản ứng cháy (ở đktc) là
nCO2 = 0,1 mol; nH2O = 0,14 mol
Bảo toàn nguyên tố O:
\(2.{n_{{O_2}}} = 2.{n_{C{O_2}}} + {n_{{H_2}O}} = > \,\,{n_{{O_2}}} = \dfrac{{2.{n_{C{O_2}}} + {n_{{H_2}O}}}}{2} = \dfrac{{2.0,1 + 0,14}}{2} = 0,17\,\,mol\)
=> VO2 = 0,17. 22,4 = 3,808 lít
Đốt cháy hoàn toàn một thể tích khí thiên nhiên gồm metan, etan và propan được 7,84 lít CO2 (đktc) và 9,9 gam nước. Thể tích O2 (đktc) tối thiểu cần dùng là
nCO2 = 0,35 mol; nH2O = 0,55 mol
Bảo toàn nguyên tố O:
\(2.{n_{{O_2}}} = 2.{n_{C{O_2}}} + {n_{{H_2}O}} = > \,\,{n_{{O_2}}} = \dfrac{{2.{n_{C{O_2}}} + {n_{{H_2}O}}}}{2} = \dfrac{{2.0,35 + 0,55}}{2} = 0,625\,\,mol\)
=> VO2 = 0,625. 22,4 = 14 lít
Đốt cháy hoàn toàn 6,72 lít (đktc) hỗn hợp E gồm hai hiđrocacbon X và Y (MY > MX), thu được 11,2 lít khí CO2 (đktc) và 10,8 gam H2O. Công thức của X là
nhh E = 0,3 mol ; nCO2 = 0, 5 mol ; nH2O = 0,6 mol
NX : nH2O > nCO2 => X, Y thuộc dãy đồng đẳng ankan
\({n_{\overline C }} = \dfrac{{{n_{CO2}}}}{{{n_{hh}}}} = \dfrac{{0,5}}{{0,3}} = 1,66\)
=> Trong E có chứa CH4
Khi đốt cháy hoàn toàn 7,84 lít hỗn hợp khí gồm CH4, C2H6, C3H8 (đktc) thu được 16,8 lít khí CO2(đktc) và x gam H2O. Giá trị của x là
Đốt cháy ankan ta có nankan = nH2O – nCO2=> nH2O = nankan + nCO2 = 0,35 + 0,75 = 1,1 mol
=> mH2O = 1,1. 18= 19,8 gam
Đốt cháy hoàn toàn 4,48 lít hỗn hợp gồm C2H6 và C3H8 (đkc) rồi cho sản phẩm cháy đi qua bình 1 đựng H2SO4 đặc, bình 2 đựng dd nước vôi trong có dư thì thấy khối lượng bình 1 tăng m gam, bình 2 tăng 2,2 gam. Tính m.
Bình 1 chứa H2O; bình 2 chứa CO2
nCO2 = 2,2: 44 = 0,05 mol
Đốt cháy ankan ta có nankan = nH2O – nCO2=> nH2O = nankan + nCO2 = 0,2 + 0,05 = 0,25 mol
=> mH2O = 0,25. 18= 4,5 gam
Đốt cháy hiđrocacbon X, rồi hấp thụ hoàn toàn sản phẩm cháy vào dd Ba(OH)2 dư, thấy có 49,25 gam kết tủa xuất hiện và khối lượng dd sau phản ứng giảm đi 32,85 gam. CTPT của X là:
BTNT C : nCO2 = nBaCO3 = 0,25 mol => mCO2 = 11 g
mCO2 + mH2O = m↓ - mdd giảm = 49,25 – 32,85 = 16,4 g
=> mH2O = 16,4 – 11 = 5,4 g => nH2O = 0,3 mol
Nx : nH2O > nCO2 => X là ankan
nAnkan = nH2O – nCO2 = 0,3 – 0,25 = 0,05 mol
Gọi công thức của ankan là CnH2n+2
BTNT C : 0,05. n = 0,25 => n = 5.
CTPT của X là C5H12
Đốt cháy hoàn toàn một hiđrocacbon X thu được 4,84 gam CO2 và 2,376 gam H2O. Khi X tác dụng với khí clo thu được 4 sản phẩm monoclo. Tên gọi của X là :
nCO2 = 0,11 mol
nH2O = 0,132 mol
Nx : nH2O > nCO2 => X là ankan
nAnkan = nH2O – nCO2 = 0,132 – 0,11 = 0,022 mol
Gọi công thức của ankan là CnH2n+2
BTNT C : 0,022. n = 0,11 => n = 5.
CTPT của X là C5H12
\(\mathop C\limits^a - \mathop C\limits^b - \mathop C\limits^c - \mathop C\limits^b - \mathop C\limits^a \)
có 3 vị trí thế monoclo là a, b, c
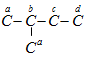 : có 4 vị trí thế monoclo là a, b, c, d
: có 4 vị trí thế monoclo là a, b, c, d
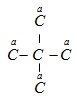
chỉ có 1 vị trí thế là a
Hỗn hợp X gồm CH4, C2H4, C3H6, C4H6 trong đó CH4 và C4H6 có cùng số mol . Đốt cháy m gam X rồi hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2 dư thì khối lượng dung dịch giảm 7,6g. Giá trị của m là :
Do CH4 và C4H6 có cùng số mol nên qui đổi hỗn hợp thành C2H4 và C3H6
Khi đốt cháy nCO2 = nH2O = a mol
BTNT C: nCO2 = nCaCO3
Mặt khác mCO2 + mH2O = mCaCO3 – 7,6
=> 44a+18a= 100a – 7,6 <=> a = 0,2 mol
mX = mC +mH = 12.nCO2 + 1. 2nH2O= 2,8 gam
Đốt cháy hoàn toàn 4,872 gam một hiđrocacbon X, hấp thụ toàn bộ sản phẩm cháy qua bình đựng dung dịch nước vô trong. Sau phản ứng thu được 27,93 gam kết tủa và thấy khối lượng dung dịch giảm 5,586 gam. Tìm công thức phân tử của X?
Gọi số mol của C và H trong X lần lượt là a, b (mol)
Ta có : mX = mC + mH <=> 4,872 = 12a + b (1)
BTNT C : nCO2 = nC (X) = a mol
BTNT H : n H2O = nH (X)/2 = b/2 mol
Áp dụng công thức : mCO2 + mH2O = m kết tủa – m dd giảm <=> 44a + 9b = 27,93 – 5,586 (2)
Từ (1)(2) => a = 0,336 và b = 0,84
Ta có nC :nH = a : b = 0,336 : 0,84 = 4 : 10
X là C4H10
Đốt cháy hoàn toàn V lít hỗn hợp X gồm H2, CH4, C2H6, C3H8, C4H10 thu được 7,84 lít khí CO2 và 9,9 gam nước, các khí đều đo ở đktc. Giá trị của V là
nCO2 = 7,84 : 22,4 = 0,35 (mol); nH2O = 9,9 :18 = 0,55 (mol)
Hỗn hợp X gồm ankan và H2 => khi đốt cháy cho nH2O > nCO2
và nX = nH2O – nCO2 = 0,55 – 0,35 = 0,2 (mol)
=> VX(đktc) = 0,2. 22,4 = 4,48 (l)
Hỗn hợp X có tỉ khối so với H2 là 21,2 gồm propan, propen và propin. Khi đốt cháy hoàn toàn 0,1 mol X, tổng khối lượng của CO2 và H2O thu được là:
Qui đổi hỗn hợp thành C3Hy
MX = 21,2. 2 = 42,4 <=> 12. 3 + y = 42,4 <=> y = 6,4
BTNT C : nCO2 = nC(X) = 0,1. 3 = 0,3 mol
BTNT H : nH2O = nH(X)/2 = ( 0,1. 6,4) /2 mol
\({m_{C{O_2}}} + {m_{{H_2}O}} = 0,3.44 + \dfrac{{0,1.6,4}}{2}.18 = 18,96\,\,gam\)
Cho 2,4 gam hỗn hợp C2H2, C3H8, C2H6, C4H6 và H2 đi qua bột Ni nung nóng, sau một thời gian thu được hỗn hợp khí X. Đốt cháy hoàn toàn X cần vừa đủ V lít khí O2 (đktc), thu được 3,36 lít CO2 (đktc). Gía trị của V là
BTNT C: nC =nCO2 = 0,15 mol => mC = 1,8 gam
mhh= mC + mH => mH = 2,4 – 1,8 = 0,6 gam => nH = 0,6 mol
BTNT H: nH2O = nH : 2 = 0,3 mol
BTNT O: 2n O2 = 2nCO2 + nH2O = 0,15. 2 + 0,3 = 0,6 mol
=> nO2 = 0,3 mol => VO2 = 6,72 lít
Đốt cháy hoàn toàn hỗn hợp X gồm hai ankan kế tiếp trong dãy đồng đẳng được 57,2 gam CO2 và 32,4 gam H2O. Công thức phân tử 2 ankan là :
nCO2 = 1,3 mol ; nH2O = 1,8 mol
nankan = nH2O – nCO2 = 1,8 – 1,3 = 0, 5 mol
Số C trung bình = nCO2 / nankan = 1,3 : 0,5 = 2,6
Vì 2 ankan liên tiếp => 2 ankan là C2H6 và C3H8
Đốt cháy hoàn toàn hỗn hợp hai hiđrocacbon đồng đẳng có khối lượng phân tử hơn kém nhau 28 đvC, ta thu được 4,48 l CO2 (đktc) và 5,4 gam H2O. CTPT của 2 hiđrocacbon trên là:
nCO2 = 0,2 mol ; nH2O = 0,3 mol
Nx : nH2O > nCO2 => hai hiđrocacbon là ankan.
nankan = nH2O – nCO2 = 0,3- 0,2 = 0, 1 mol
Số C trung bình = nCO2 / nankan = 0,2 : 0,1 = 2
Vì 2 ankan liên tiếp => 2 ankan là CH4 và C3H8
Đốt cháy hoàn toàn 2 hiđrocacbon liên tiếp nhau trong dãy đồng đẳng. Sản phẩm cháy lần lượt cho qua bình 1 đựng H2SO4 đặc và bình 2 đựng KOH đặc, dư thấy khối lượng bình 1 tăng 2,52 gam và bình 2 tăng 4,4 gam. Hai hiđrocacbon đó là
Bình 1 chứa nước, bình 2 chứa CO2
nCO2 = 0,1 mol ; nH2O = 0,14 mol
Nx : nH2O > nCO2 => hai hiđrocacbon là ankan.
nankan = nH2O – nCO2 = 0,14 - 0,1 = 0,04 mol
Số C trung bình = nCO2 / nankan = 0,1 : 0,04 = 2,5
Vì 2 ankan liên tiếp => 2 ankan là C2H6 và C3H8
Cho hỗn hợp X gồm 2 ankan A và B ở thể khí, có tỉ lệ số mol trong hỗn hợp nA : nB = 1 : 4. Tỷ khối của hỗn hợp X so với khí He là 13,1. Công thức phân tử của hai ankan A và B lần lượt là :
Gọi công thức phân tử trong bình là
\({C_{\bar n}}{H_{2\bar n + 2}}\)
\( = > 14\bar n + 2 = 52,4\,\, = > \,\bar n = 3,6\)
=> loại B vì 2 chất có số C > 3,6 và loại C vì 2 chất đều có số C < 3,6
Giả sử A đúng => nC2H6 = 1 mol ; nC4H10 = 4 mol
\(= > \,\,\bar C = \dfrac{{2.1 + 4.4}}{{1 + 4}} = 3,6\)(thỏa mãn)
Giả sử D đúng => nC4H10 = 1 mol ; nC3H8 = 4 mol
\( = > \,\,\bar C = \dfrac{{4.1 + 3.4}}{{1 + 4}} = 3,2\) (loại)
Đốt cháy hoàn toàn một lượng hiđrocacbon X. Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ba(OH)2 (dư) tạo ra 29,55 gam kết tủa, dung dịch sau phản ứng có khối lượng giảm 19,35 gam so với dung dịch Ba(OH)2 ban đầu. Công thức phân tử của X là
BTNT C: nC(X) =nCO2= nBaCO3 = 0,15 mol
mCO2 +mH2O = mBaCO3 – mdd giảm = 29,55 – 19,35 = 10,2 gam
=> mH2O = 10,2 – 0,15. 44 = 3,6 gam => nH2O = 0,2 mol
BTNT H: nH(X) = 2n H2O = 0,4 mol
nC: nH = 0,15 : 0,4 = 3:8
X là C3H8

