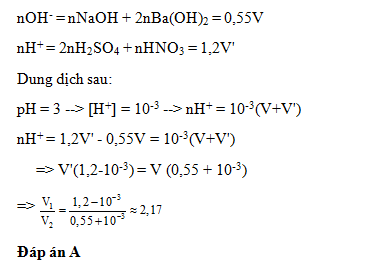Phương trình ion thu gọn H+ + OH- → H2O biểu diễn bản chất của các phản ứng hóa học nào sau đây?
Phương trình ion thu gọn H+ + OH- → H2O biểu diễn bản chất của phản ứng: HCl + NaOH → NaCl + H2O
Để phân biệt dung dịch Na3PO4 và dung dịch NaNO3 nên dùng thuốc thử nào sau đây?
Để nhận biết PO43- ta sử dụng ion Ag+ tạo kết tủa màu vàng theo PTHH:
Ag+ + PO43- → Ag3PO4↓
Để phân biệt dung dịch Na3PO4 và dung dịch NaNO3 nên dùng thuốc thử nào sau đây?
Để nhận biết PO43- ta sử dụng ion Ag+ tạo kết tủa màu vàng theo PTHH:
Ag+ + PO43- → Ag3PO4↓
Tính số ml H2O cần thêm vào 2 lít dung dịch NaOH 1M để thu được dung dịch mới có nồng độ 0,1M.
Do số mol NaOH không đổi nên ta có: CV = C’V’ => V’ = CV/C’ = 1.2/0,1 = 20 lít
=> Số ml cần thêm là: 20 – 2 = 18 lít = 18000 ml
Cho các chất: Al, Al2O3, Al2(SO4)3, Zn(OH)2, NaHS, K2SO3, (NH4)2CO3. Số chất đều phản ứng được với dung dịch HCl, dung dịch NaOH là
Các chất vừa tác dụng với HCl và NaOH là: Al, Al2O3, Zn(OH)2, NaHS, (NH4)2CO3
=> Có 5 chất
Để được một dung dịch có các ion \({K^ + },SO_4^{2 - },M{g^{2 + }},C{l^ - }\) thì cần trộn những dung dịch muối nào?
Ta thấy KCl, MgSO4, K2SO4, MgCl2 đều là các muối tan
Có 3 dung dịch NaOH, HCl, H2SO4 đựng trong các lọ mất nhãn. Thuốc thử duy nhất để phân biệt ba dung dịch này là:
Nhỏ từ từ đến dư các dung dịch vào BaCO3:
- Không hiện tượng => NaOH
- Kết tủa tan dần đến hết và sủi bọt khí => HCl
BaCO3 + 2HCl → BaCl2 + H2O + CO2↑
- Sủi bọt khí, sau phản ứng thu được kết tủa trắng:
BaCO3 + H2SO4 → BaSO4↓ + H2O + CO2↑
Phản ứng nào sau đây có phương trình ion thu gọn là Ba2+ + SO42- → BaSO4 ?
Phản ứng có phương trình ion thu gọn là Ba2+ + SO42- → BaSO4 là: Ba(HCO3)2 + Na2SO4 → BaSO4 + 2NaHCO3
Tính pH của dung dịch HNO2 0,2M biết Ka = 4.10--4
Các quá trình điện li:
HNO2 \(\overset {} \leftrightarrows \) H+ + NO2- Ka = 4.10-4
H2O \(\overset {} \leftrightarrows \) H+ + OH- Kw = 10-14
Ta thấy: Ka.Ca = 0,2.4.10-4 = 8.10-5 > > Kw = 10-14. Do vậy sự phân li của H2O tạo ra H+ là không đáng kể. Vì vậy bỏ qua sự điện li của H2O. Dung dịch chỉ có sự điện li của HNO2
HNO2 \(\overset {} \leftrightarrows \) H+ + NO2- Ka = 4.10-4
ban đầu: 0,2
phân li: x x x
cân bằng: (0,2 - x) x x
Ta có:\(Ka = {{{\rm{[}}{H^ + }{\rm{]}}.{\rm{[}}N{O_2}^ - {\rm{]}}} \over {{\rm{[}}HN{O_2}]}} = {{{x^2}} \over {0,2 - x}} = {4.10^{ - 4}}(*)\)
Cách 1: giải phương trình bậc 2
→ x2 + 4.10-4x - 0,2.4.10-4 = 0
→ x = 8,7465.10-3 (M)
→ [H+] = x = 8,7465.10-3 (M)
→ pH = -lg[H+] = -lg(8,7465.10-3) = 2,058
Cách 2: ta thấy \({{Ca} \over {Ka}} = {{0,2} \over {{{4.10}^{ - 4}}}} = 500\) (Chỉ cần Ca lớn gấp 100 lần Ka là coi như x rất nhỏ)
→ x << 0,2
→ coi 0,2 - x ≈ 0,2
Từ phương trình (*) →\({{{x^2}} \over {0,2}} = {4.10^{ - 4}} \Rightarrow x = \sqrt {0,{{2.4.10}^{ - 4}}} = 8,{944.10^{ - 3}}(M)\)
→ [H+] = x = 8,944.10-3 (M)
→ pH = -lg[H+] = -lg(8,944.10-3) = 2,048 ≈ 2,05
Tính pH của dung dịch CH3COOH 0,1M biết Ka = 1,8.10-5
CH3COOH \(\overset {} \leftrightarrows \) H+ + CH3COO- Ka = 1,8.10-5
Ban đầu : 0,1M 0 0
Phân li x x x
Cân bằng 0,1- x x x
Kb = x2/(0,1 – x) = 1,8.10-5
=> Giải phương trình bậc hai, ta có : x = 1,33267.10-3 = 10-2,87M => pH = 2,87
Có các dung dịch AlCl3, NaCl, MgCl2, H2SO4. Chỉ được dùng thêm một thuốc thử, thì có thể dùng thêm thuốc thử nào sau đây để nhận biết các dung dịch đó?
Sử dụng thuốc thử là dung dịch NaOH
+ Xuất hiện kết tủa rồi kết tủa tan: AlCl3
+ Xuất hiện kết tủa trắng, không tan khi NaOH dư: MgCl2
+ Không có hiện tượng: NaCl, H2SO4
Tách lấy kết tủa của phản ứng NaOH với MgCl2 làm thuốc thử nhận biết 2 chất còn lại
+ Kết tủa tan: H2SO4
+ Không hiện tượng: NaCl
Tính pH của dung dịch gồmNaOH 10-3M và NH3 10-2M (NH3 có Kb = 1,8.10-5 )
\(NaOH \to N{a^ + } + O{H^ - }\)
10-3 \( \to\) 10-3
\(N{H_3} + {H_2}O \rightleftarrows NH_4^ + + O{H^ - }\)
Ban đầu: 0,01 10-3
Phân li: x x 10-3 + x
Cân bằng 0,01 – x x 10-3 + x
Vì \({K_{b(N{H_3})}} = \dfrac{{{\text{[}}O{H^ - }{\text{]}}.{\text{[}}NH_4^ + {\text{]}}}}{{{\text{[}}N{H_3}{\text{]}}}} \to 1,{8.10^{ - 5}} = \dfrac{{({{10}^{ - 3}} + x)x}}{{0,01 - x}} \to x = 1,{536.10^{ - 4}}\)
\( \to {\text{[}}O{H^ - }{\text{]}} = 1,{536.10^{ - 4}} + {10^{ - 3}} = 11,{536.10^{ - 4}}\,\,M\)
\( \to pH = 14 + \log (11,{536.10^{ - 4}}) = 11,062\)
Có 4 lọ đựng 4 dung dịch Al(NO3)3, NaNO3, Na2CO3. Nếu chỉ dùng một thuốc thử thì có thể dùng chất nào sau đây để nhận biết 3 lọ trên?
Dùng H2SO4 làm thuốc thử
+ Xuất hiện khí không màu thoát ra: Na2CO3
+ Không có hiện tượng: Al(NO3)3, NaNO3
Dùng Na2CO3 vừa nhận biết được để phân biệt Al(NO3)3 và NaNO3
+ Xuất hiện khí không màu thoát ra và kết tủa keo: Al(NO3)3
+ Không có hiện tượng: NaNO3
Phải thêm bao nhiêu ml dung dịch HCl 1M vào 90 ml nước để được dung dịch có pH = 1?
pH = 1 => [H+] = 0,1M
Đặt thể tích dung dịch HCl 1M cần thêm vào là V (lít)
=> nHCl = V mol
Sau khi trộn với 90 ml H2O:
[H+] = CM HCl sau trộn = \(\dfrac{V}{{V + 0,09}}\) = 0,1M => V = 0,01 lít = 10 ml
Phản ứng nào dưới đây có phương trình ion rút gọn là: Ba2+ + SO42- → BaSO4
A. Ba2+ +2OH- + 2H+ + SO42- → BaSO4 + 2H2O
B. Ba2+ + 2HCO3- + 2H+ + SO42- → BaSO4 + 2H2O + 2CO2
C. Ba2+ + 2OH- + 2H+ + SO42- → BaSO4 + 2H2O
D. Ba2+ + SO42- → BaSO4
Cho phản ứng hóa học: NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion rút gọn với phản ứng trên?
NaOH + HCl → NaCl + H2O có phương trình ion rút gọn là: OH- + H+ → H2O
Xét các phương án:
+ 2KOH + FeCl2 → Fe(OH)2 + 2KCl
→ PT ion rút gọn: 2OH- + Fe2+ → Fe(OH)2
+ NaOH + NaHCO3 → Na2CO3 + H2O
→ PT ion rút gọn: OH- + HCO3- → CO32- + H2O
+ NaOH + NH4Cl → NaCl + NH3 + H2O
→ PT ion rút gọn: OH- + NH4+ → NH3 + H2O
+ KOH + HNO3 → KNO3 + H2O
→ PT ion rút gọn: OH- + H+ → H2O
=> KOH + HNO3 → KNO3 + H2O có cùng phương trình ion rút gọn
Dd X có pH = 5 gồm các ion NH4+, Na+, Ba2+ và 1 anion Y. Y có thể là anion nào sau đây?
Không thể là SO4 và CO3 vì sẽ tạo kết tủa với Ba2+
Không thể là CH3COO- vì ion này thủy phân cho môi trường bazo nên không phù hợp với yêu cầu pH = 5
Cho các ion sau : K+( 0,15 mol) ; Fe2+(0,1 mol) ; NH4+(0,2mol) ; H+(0,2 mol) ; Cl-(0,1 mol); SO42-(0,15 mol) ; NO3-(0,05 mol) ; CO32-(0,15 mol). Có 2 dung dịch mỗi dung dịch chứa 2 cation và 2 anion trong các ion trên không trùng nhau. 2 dung dịch đó là :
H+ và CO32- không thể cùng tồn tại trong cùng một dung dịch
Tương tự với Fe2+ ; H+ ; NO3-
Đối với dung dịch axit yếu CH3COOH 0,1M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion nào sau đây là đúng?
CH3COOH là một chất điện li yếu do đó khi hòa tan vào nước không phân li hoàn toàn thành ion.
=> [H+] < 0,1M
Dung dịch X chứa hỗn hợp NaOH 0,25M và Ba(OH)2 0,15M dung dịch Y chứa hỗn hợp H2SO4 0,5M và HNO3 0,2M.Trộn V lít dung dịch X với V’ lit dung dịch Y thu được dung dịch Z có pH =3. Tỉ lệ V/V’ là