Cho m gam hỗn hợp Cu, Fe3O4 vào 200 ml dung dịch chứa NaNO3 1M và H2SO4 2M thu được dung dịch Y và thấy 1,12 lít khí NO (đktc). Thêm dung dịch HCl dư vào dung dịch Y lại thấy thoát ra 0,336 lít khí NO (đktc), NO là sản phẩm khử duy nhất của NO3-. Giá trị của m là:
Ta có: nNO3 = nNaNO3 = 0,2 mol ; nSO4 = nH2SO4 = 0,4 mol
Thêm HCl vào Y vẫn tạo NO chứng tỏ Y không còn H+, còn NO3- và Fe2+
=> nH+ = 2nH2SO4 = 0,4.2 = 4nNO + 2nO => nO = 0,3 mol
Bảo toàn nguyên tố Oxi => nFe3O4 = 0,075 mol
nNO tổng = 0,065 mol < nNO3 => sau khi kết thúc tất cả quá trình thì NO3- vẫn dư
Bảo toàn e: 2nCu + nFe3O4 = 3nNO tổng
=> nCu = 0,06 mol
Vậy m = mCu + mFe2O3 = 0,06.64 + 0,075.232 = 21,24g
Cho 30,24 gam hỗn hợp chất rắn X gồm Mg, MgCO3 và Mg(NO3)2 (trong đó oxi chiếm 28,57% về khối lượng hỗn hợp) vào dung dịch chứa 0,12 mol HNO3 và 1,64 mol NaHSO4, khuấy đều cho các phản ứng xảy ra hoàn toàn thu được dung dịch Y chứa các muối trung hòa có khối lượng 215,08 gam và hỗn hợp khí Z gồm N2O, N2, CO2 và H2 (trong đó số mol của N2O bằng số mol của CO2). Tỉ khối hơi của Z so với He bằng a. Giá trị gần nhất của a là
mO(X) = 30,24.28,57% = 8,64 gam => nO(X) = 0,54 mol
Do phản ứng thu được khí H2 nên trong dung dịch Y không chứa NO3-
Đặt các ẩn như trong sơ đồ sau:
\(30,24(g)X\left\{ \matrix{
Mg:x \hfill \cr
MgC{O_3}:y \hfill \cr
Mg{(N{O_3})_2}:z \hfill \cr} \right. + \left\{ \matrix{
HN{O_3}:0,12 \hfill \cr
NaHS{O_4}:1,64 \hfill \cr} \right. \to {\rm{dd}}\,Y\underbrace {\left\{ \matrix{
M{g^{2 + }}:x + y + z \hfill \cr
N{H_4}^ + :t \hfill \cr
N{a^ + }:1,64 \hfill \cr
S{O_4}^{2 - }:1,64 \hfill \cr} \right.}_{215,08(g)} + Z\left\{ \matrix{
{N_2}O \hfill \cr
{N_2} \hfill \cr
C{O_2} \hfill \cr
{H_2} \hfill \cr} \right. + {H_2}O\)
+ mX = 24x + 84y + 148z = 30,24 (1)
+ nO(X) = 3y + 6z = 0,54 (2)
+ BTĐT cho dd Y: 2nMg2+ + nNH4+ + nNa+ = 2nSO42- => 2x + 2y + 2z + t + 1,64 = 2.1,64 (3)
+ m muối = mMg2+ + mNH4+ + mNa+ + mSO42- => 24(x+y+z) + 18t + 23.1,64 + 96.1,64 = 215,08 (4)
Giải hệ (1) (2) (3) (4) được x = 0,68; y = 0,06; z = 0,06; t = 0,04
BTNT "C": nCO2 = nMgCO3 = y = 0,06 mol => nN2O = nCO2 = 0,06 mol (theo đề bài)
BTNT "N": 2nMg(NO3)2 + nHNO3 = nNH4+ + 2nN2O + 2nN2
=> 2.0,06 + 0,12 = 0,04 + 2.0,06 + 2nN2 => nN2 = 0,04 mol
BTNT "O": nO(X) + 3nHNO3 + 4nNaHSO4 = 4nSO42- + nN2O + 2nCO2 + nH2O
=> 0,54 + 3.0,12 + 4.1,64 = 4.1,64 + 0,06 + 2.0,06 + nH2O => nH2O = 0,72 mol
BTNT "H": nHNO3 + nNaHSO4 = 4nNH4+ + 2nH2 + 2nH2O
=> 0,12 + 1,64 = 4.0,04 + 2nH2 + 2.0,72 => nH2 = 0,08 mol
=> nZ = 0,06 + 0,04 + 0,06 + 0,08 = 0,24 mol
BTKL: mZ = 0,06.44 + 0,04.28 + 0,06.44 + 0,08.2 = 6,56 gam
=> MZ = 6,56 : 0,24 = 82/3 => dZ/He = 82/3 : 4 = 6,833 gần nhất với 7,0
Hòa tan hoàn toàn 21,5 gam hỗn hợp X gồm Al, Zn, FeO, Cu(NO3)2 cần dùng hết 430 ml dung dịch H2SO4 1M thu được hỗn hợp khí Y (đktc) gồm 0,06 mol NO và 0,13 mol H2 đồng thời thu được dung dịch Z chỉ chứa các muối sunfat trung hòa. Cô cạn dung dịch z thu được 56,9 gam muối khan. Thành phần phần trăm về khối lượng của Zn trong hỗn hợp X có giá trị gần nhất là
X + H2SO4 → 56,9 gam muối + 0,06 mol NO + 0,13 mol H2 + H2O
Bảo toàn khối lượng có mH2O = mX + mH2SO4 – mmuối - mNO – mH2 = 21,5 + 0,43.98 – 56,9 – 0,06.30 – 0,13.2 = 4,68 g
→ nH2O = 0,26 mol
Ta có 4H+ + NO3- + 3e → 2H2O + NO
2H+ + O2- → H2O
2H+ + 2e → H2
10 H+ + 8e + NO3- → 3H2O + NH4+
Bảo toàn H có 2nH2SO4 = 4nNO + 2nH2 + 10nNH4 + 2nO → 2.0,43 = 4.0,06 + 0,13.2 + 10nNH4+ 2nO (1)
Lại có nH2O = 0,26 = 2nNO + nO + 3nNH4 = 0,06.2 + nO + 3nNH4 (2)
Từ 1 và 2 giải được nO = 0,08 mol và nNH4 =0,02 mol → nFeO = nO = 0,08 mol
Bảo toàn N có 2nCu(NO3)2 = nNH4 + nNO = 0,02 + 0,06 =0,08 mol nên nCu(NO3)2 = 0,04 mol
Đặt số mol của Al và Zn lần lượt là a và b ( mol)
Khối lượng của X là 27a + 65b + 0,08.72 + 0,04.188 =21,5 (3)
Vì phản ứng có tạo ra khí H2 nên chỉ tạo muối Fe2+
Bảo toàn electron có 3a + 2b = 3nNO + 2nH2 + 8nNH4 = 3.0,06 + 2.0,13 + 8.0,02 = 0,6 (4)
Giải (3) và (4) có a = 0,16 mol và b = 0,06 mol → %Zn = 18,14% → gần nhất 18,2%
Hỗn hợp X gồm Al và Fe có tỉ lệ số mol tương ứng là 1:1. Cho 2,49 gam X vào dung dịch chứa 0,17 mol HCl, thu được dung dịch Y. Cho 200 ml dung dịch AgNO3 1M vào Y, thu được khí NO và m gam chất rắn. Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm khử duy nhất của N+5. Giá trị của m gần nhất với giá trị nào sau đây
Đặt số mol Al và Fe trong X là x mol thì mX = 27x + 56x = 2,49 → x = 0,03 mol
X + 0,17 mol HCl thì 2 Al + 6HCl → 2AlCl3 + 3H2
Fe + 2HCl → FeCl2 + H2
→ Dung dịch Y thu được có AlCl3 : 0,03 mol ; FeCl2 : 0,03 mol; HCl : 0,02 mol
Y + 0,2 mol AgNO3 thì : 3Fe2+ + 4H+ + NO3- → 3Fe3+ + 2H2O + NO
0,015 mol ← 0,02 mol
Fe2+ + Ag+ → Fe3+ + Ag
0,015 mol 0,015 mol
Ag+ + Cl- → AgCl
0,17 mol 0,17 mol
→ mrắn = mAgCl + mAg = 0,17.143,5 + 0,015.108 = 24,395 + 1,62= 26,015 g → gần nhất với 26,0 g
Cho 66,2 gam hỗn hợp X gồm Fe3O4, Fe(NO3)2, Al tan hoàn toàn trong dung dịch chứa 3,1 mol KHSO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 466,6 gam muối sunfat trung hòa và 10,08 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 23/18. Phần trăm khối lượng của Al trong hỗn hợp Z gần nhất với giá trị nào sau đây?
MZ = 4.23/18 = 5,1 => khí còn lại là H2
Tính được nNO = 0,05 mol và nH2 = 0,4 mol
\(66,2(g)X\left\{ \begin{gathered}
F{e_3}{O_4} \hfill \\
Fe{(N{O_3})_2} \hfill \\
Al \hfill \\
\end{gathered} \right. + KHS{O_4}:3,1 \to 466,6(g)\,muoi\left\{ \begin{gathered}
F{e^{2 + }} \hfill \\
F{e^{3 + }} \hfill \\
A{l^{3 + }} \hfill \\
{K^ + }:3,1 \hfill \\
N{H_4}^ + \hfill \\
S{O_4}^{2 - }:3,1 \hfill \\
\end{gathered} \right. + \left\{ \begin{gathered}
NO:0,05 \hfill \\
{H_2}:0,4 \hfill \\
\end{gathered} \right. + {H_2}O\)
BTKL: mH2O = 66,2 + 3,1.136 – 466,6 – 0,05.30 – 0,4.2 = 18,9 gam => nH2O = 1,05 mol
BTNT “H”: nNH4+ = (nKHSO4 – 2nH2 – 2nH2O)/4 = (3,1 – 0,4.2 – 1,05.2)/4 = 0,05 mol
BTNT “N”: nFe(NO3)2 = (nNH4+ + nNO)/2 = (0,05 + 0,05)/2 = 0,05 mol
BTNT “O”: nFe3O4 = (4nSO42- + nNO + nH2O - 6nFe(NO3)2 - 4nKHSO4)/4 = 0,2 mol
mAl = mX – mFe3O4 – mFe(NO3)2 = 66,2 – 0,2.232 – 0,05.180 = 10,8 gam
=> %mAl = 10,8/66,2.100% = 16,3% gần nhất với giá trị 15%
Hòa tan hết 15 g hỗn hợp X gồm Fe, Fe3O4, FeCO3 và Fe(NO3)2 trong dung dịch chứa NaHSO4 và 0,16 mol HNO3, thu được dd Y và hỗn hợp khí Z gồm CO2 và NO với tỉ lệ số mol là 1 : 4. Dung dịch Y hòa tan được tối đa 8,64 gam Cu thấy thoát ra 0,03 mol khí NO. Nếu cho dd Ba(OH)2 dư vào Y thì thu được 154,4 gam kết tủa. Biết các phản ứng Xảy ra hoàn toàn và khí NO thu được là sản phẩm khử duy nhất của cả quá trình. Phần trăm khối lượng của Fe3O4 trong hỗn hợp X là :
\(\left\{ \begin{gathered} Fe:a \hfill \\ F{e_3}{O_4}:b \hfill \\ FeC{O_3}:c \hfill \\ Fe{(N{O_3})_2}:d \hfill \\ \end{gathered} \right.\xrightarrow{{ + NaHS{O_4} + HN{O_3}}}\left\{ \begin{gathered} F{e^{3 + }} \hfill \\ N{a^ + } \hfill \\ NO_3^ - \hfill \\ SO_4^{2 - } \hfill \\ {H^ + } \hfill \\ \end{gathered} \right.\)
Xét dung dịch Y có :
3Cu + 8H+ + 2NO3- → 3Cu2+ + 4 H2O + 2NO
0,045 0,12 0,03 0,045 0,03
Cu + 2Fe3+ → Cu2+ + 2Fe2+
0,09 0,18
Y + Ba(OH)2 thì thu được nBaSO4 = nSO4 = nNaHSO4 và nFe(OH)3 = nFe(3+) = 0,18 mol
→ 233.nNaHSO4 + 0,18.107 = 154,4 → nNaHSO4 = 0,58 mol
Bảo toàn điện tích cho Y có mol
mX = 15 = 56a + 232b + 116c + 180d
Bảo toàn Fe có : a + 3b + c + d =0,18
Vì nNO = 4nCO2 nên nNO = 4c
Bảo toàn N có 0,16 + 2d = 4c + 0,03 + 0,08
Bảo toàn e có 3a + b + c + d = 3.4c
Giải hệ ta được a = 0,1 ; b = 0,01 ; c = 0,03 và d = 0,02
→%Fe3O4 = 15,47%
Cho 38,55g hỗn hợp X gồm Mg, Al, ZnO và Fe(NO3)2 tan hoàn toàn trong dung dịch chứa 0,725 mol H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 96,55g muối sunfat trong hòa và 3,92 lit khí Z (dktc) gồm 2 khí trong đó có 1 khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 9. Phần trăm số mol Mg trong hỗn hợp X gần nhất với giá trị nào sau đây :
- Xét khí Z : nZ = 3,92 : 22,4 = 0,175 mol
MZ = 9.2 = 18g. Vì có 1 khí hóa nâu ngoài không khí => NO
=> khí còn lại là H2
=> nNO + nH2 = 0,175 mol và mZ = 30nNO + 2N2 = 18.0,175 = 3,15g
=> nNO = 0,1 ; nH2 = 0,075 mol
- Bảo toàn khối lượng : mX + mH2SO4 = mmuối + mZ + mH2O
=> mH2O = 38,55 + 0,725.98 – 3,15 – 96,55 = 9,9g => nH2O = 0,55 mol
- Bảo toàn nguyên tố H : 2nH2SO4 = 4nNH4 + 2nH2 + 2nH2O
=> nNH4 = 0,05 mol
- Công thức tính nhanh : nH+ pứ = 4nNO + 2nH2 + 2nO(X) + 10nNH4
=> nO(X) = 0,2 mol = nZnO (Bảo toàn nguyên tố Oxi)
- Bảo toàn Nito : nNO + nNH4 = 2nFe(NO3)2 => nFe(NO3)2 = 0,075 mol
- Ta có : mX = mAl + mMg + mZnO + mFe(NO3)2 => 24nMg + 27nAl = 8,85g
Và : ne = 3nAl + 2nMg = 2nH2 + 8nNH4 + 3nNO = 0,85 mol
(Vì có H2 nên H+ dư phản ứng với kim loại => chỉ có Fe2+ trong dung dịch)
=> nAl = 0,15 ; nMg = 0,2 mol
=> %mMg(X) = 0,2.24 : (0,2 + 0,15 + 0,2 + 0,075) = 32% (gần nhất với giá trị 30%)
Hòa tan hoàn toàn m gam hỗn hợp X gồm Mg, Al, Zn trong 500 ml dung dịch HNO3 4M, sau phản ứng hoàn toàn thu được dung dịch Y và 4,48 lít (đktc) hỗn hợp gồm hai khí không màu có tỉ khối so với H2 là 18,5 trong đó có 1 khí hóa nâu ngoài không khí. Trung hòa dung dịch Y bằng lượng vừa đủ 100 ml dung dịch NaOH 1M, thu được dung dịch Z. Cô cạn Z, thu được 134,5 gam muối khan. Giá trị của m là
M khí = 37
Khí hóa nâu ngoài không khí là NO (M = 30) => Khí còn lại có M > 37
Vì khí không màu nên khí đó là N2O
Giả sử khí gồm NO (x mol) và N2O (y mol)
Giải hệ: n khí = x + y = 0,2 và m khí = 30x + 44y = 0,2.27 được x = y = 0,1
Trung hòa dd Y cần vừa đủ 0,1 mol NaOH nên ta có nHNO3 = nNaOH = 0,1 mol
Sơ đồ bài toán:
\(m(g)\left\{ \matrix{
Mg \hfill \cr
Al \hfill \cr
Zn \hfill \cr} \right. + HN{O_3}:2 \to \left| \matrix{
{\rm{dd}}\,Y\left\{ \matrix{
M{g^{2 + }} \hfill \cr
A{l^{3 + }} \hfill \cr
Z{n^{2 + }} \hfill \cr
N{H_4}^ + \hfill \cr
{H^ + }:0,1 \hfill \cr
N{O_3}^ - \hfill \cr} \right.\buildrel { + NaOH:0,1} \over
\longrightarrow \underbrace {Muoi}_{134,5(g)} + \underbrace {{H_2}O}_{0,1(mol)} \hfill \cr
Khi\left\{ \matrix{
NO:0,1 \hfill \cr
{N_2}O:0,1 \hfill \cr} \right. \hfill \cr} \right.\)
+ Xét phản ứng của dd Y với NaOH:
m ion dd Y = m muối + mH2O - mNaOH = 134,5 + 0,1.18 - 0,1.40 = 132,3 (g)
+ Ta có công thức: nHNO3 = nHNO3 dư + 4nNO + 10nN2O + 10nNH4NO3
=> 2 = 0,1 + 4.0,1 + 10.0,1 + 10nNH4NO3 => nNH4NO3 = 0,05 mol
+ BTNT "N": nHNO3 = nNH4+ + nNO3- + nNO + 2nN2O
=> 2 = 0,05 + nNO3- (dd Y) + 0,1 + 2.0,1 => nNO3 (dd Y) = 1,65 mol
Ta có: m = mKL = m ion KL = m ion dd Y - mNH4+ - mH+ - mNO3-
= 132,3 - 0,05.18 - 0,1 - 1,65.62 = 29 gam
Hòa tan hoàn toàn hỗn hợp gồm 0,03 mol Cu và 0,09 mol Mg vào dung dịch chứa 0,07 mol KNO3 và 0,16 mol H2SO4 loãng thì thu được dung dịch chỉ chứa các muối sunfat trung hòa và 1,12 lít (đktc) hỗn hợp khí X gồm các oxit của nitơ có tỉ khối so với H2 là x. Giá trị của x là
Bước 1: Tóm tắt sơ đồ phản ứng, xác định thành phần các muối và khí X
\(\left\{ \begin{array}{l}Cu:0,03\\Mg:0,09\end{array} \right. + \left\{ \begin{array}{l}KN{O_3}:0,07\\{H_2}S{O_4}:0,16\end{array} \right. \to \left\{ \begin{array}{l}C{u^{2 + }}:0,03\\M{g^{2 + }}:0,09\\N{H_4}^ + \\{K^ + }:0,07\\S{O_4}^{2 - }:0,16\end{array} \right. + X\left\{ \begin{array}{l}N\\O\end{array} \right. + {H_2}O\)
Bước 2: Tính nNH4+, nH2O, nN(X), nO(X)
+) BTĐT cho dd muối: nNH4+ = 2nSO42- - 2nCu2+ - 2nMg2+ - nK+ = 0,01 mol
+) BTNT "H": 2nH2SO4 = 4nNH4+ + 2nH2O ⟹ nH2O = 0,14 mol
+) BTNT "N": nN(X) = nKNO3 - nNH4+ = 0,06 mol
+) BTNT "O": nO(X) = 3nKNO3 - nH2O = 0,07 mol
Bước 3: Tính giá trị tỉ khối x
mX = mN(X) + mO(X) = 0,06.14 + 0,07.16 = 1,96 gam
⟹ MX = mX : nX = 1,96 : 0,05 = 39,2 ⟹ dX/H2 = 19,6.
Hòa tan hoàn toàn 4,8 gam kim loại M (biết M chỉ có một hóa trị duy nhất) vào dung dịch axit HNO3 dư, thu được dung dịch A. Chia A thành 2 phần bằng nhau.
- Phần 1: cho tác dụng với NaOH dư được kết tủa B. Nung B đến khối lượng không đổi thu được 4,0 gam oxit kim loại.
- Phần 2: cô cạn ở điều kiện thích hợp thu được 25,6 gam một muối X duy nhất. Muối X có công thức phân tử là
Gọi hóa trị của kim loại là n (1 ; 2 ; 3), Khối lượng mol là a (g)
Gọi số mol muối mỗi phần là x. Ta có số mol kim loại ban đầu là 2x
Có : 2ax = 4,8 nên ax = 2,4 (1)
Nếu muối tạo thành chỉ là M(NO3)n thì ta có : (a + 62n)x = 25,6 (2)
Từ (1) và (2) => $x=\frac{25,62,4}{62n}=\frac{0,187}{n}$
Mặt khác, số mol oxit thu được là x/2
=> $(2a+16n).\frac{x}{2}=4$ (3)
Từ (1) và (3) => $x=\frac{42,4}{16n}=\frac{0,1}{n}$
2 giá trị x không bằng nhau. Vì vậy muối phải là muối ngậm nước.
Đặt công thức muối là M(NO3)n.mH2O
Khối lượng muối mỗi phần là (a + 62n + 18m)x = 25,6 (4)
Kết hợp (1), (3), (4) ta có hệ sau :
ax = 2,4
(2a + 16n).x/2 = 4
(a + 62n + 18m)x = 25,6
=> nx = 0,2 ; mx = 0,6
=> a/n = 12. Thay n = 1, 2, 3 ta được a = 24 thỏa mãn => Mg
Thay n = 2 => x = 0,1 ; do đó m = 6
Vậy M là Mg và muối là Mg(NO3)2.6H2O
Nung hỗn hợp rắn A gồm a mol Mg và 0,25 mol Cu(NO3)2, sau một thời gian thu được chất rắn B và 10,08 lít khí hỗn hợp D gồm NO2 và O2. Hòa tan hoàn tòa B vào dung dịch chứa 1,3 mol HCl (vừa đủ), thu được dung dịch X chỉ chứa m gam hỗn hợp muối clorua và 1,12 lít hỗn hợp khí Y gồm N2 và H2 có tỉ khối so với hidro là 11,4. Biết các thể tích đều ở đktc. Giá trị của m gần nhất với :
nD = 0,45 => nO (D) = 0,9 mol
nY = 0,05 mol
Đặt ${{n}_{{{N}_{2}}}}~=x\text{ }\Rightarrow \text{ }{{n}_{{{H}_{2}}}}=0,05x$
=> 28x + 2.(0,05 – x) = 0,05.11,4.2 = 1,14
=> x = 0,04 mol
=> nN2 = 0,04 mol và nH2 = 0,01 mol
Trong Y chứa khí H2 chứng tỏ NO3- hết
Hỗn hợp muối clorua gồm : a mol MgCl2 ; 0,25 mol CuCl2 ; NH4Cl
Bảo toàn Clo : ${{n}_{N{{H}_{4}}Cl}}$ = 1,3 – 2a – 0,5 = 0,8 – 2a
Bảo toàn H : ${{n}_{{{H}_{2}O}}}~=\frac{1}{2}.\left( {{n}_{HCl}}+4{{n}_{N{{H}_{4}}Cl}}\text{-}2{{n}_{{{H}_{2}}}} \right)=4a-0,96$
Bảo toàn O : ${{n}_{O}}{{~}_{(Cu{{\left( N{{O}_{3}} \right)}_{2}})}}={{n}_{O\,(D)}}+{{n}_{O\,({{H}_{2}}O)}}~\Rightarrow \text{ }0,25.6=0,9+4a-0,96$
=> a = 0,39 mol
=> m = 0,39.95 + 0,25.135 + (0,8 – 2.0,39).53,5 = 71,87 gam
Lấy 240 ml dung dịch gồm NaOH 1,6M và KOH 1M tác dụng hết với dung dịch H3PO4 thu được dung dich X. Chia X thành 2 phần bằng nhau:
- Phần 1: Cô cạn thu được 20,544 gam hỗn hợp muối khan.
- Phần 2: Cho tác dụng với dung dịch CaCl2 (dư) thu được m gam kết tủa.
Giá trị của m là
nNaOH = 0,384 mol; nKOH = 0,24 mol
Gọi CT chung của kiềm là MOH (với $M=\frac{23.0,384+39.0,24}{0,624}=\frac{379}{13}$ )
Giả sử chỉ tạo một trong các muối sau:
MH2PO4: ${{n}_{M{{H}_{2}}P{{O}_{4}}}}={{n}_{MOH}}=0,624\Rightarrow {{m}_{M{{H}_{2}}P{{O}_{4}}}}=0,624.\frac{1640}{13}=78,72\text{ }gam$
M2HPO4: ${{n}_{{{M}_{2}}HP{{O}_{4}}}}=\frac{1}{2}.{{n}_{MOH}}=\frac{0,624}{2}\Rightarrow {{m}_{{{M}_{2}}HP{{O}_{4}}}}=\frac{0,624}{2}.\frac{2006}{13}=48,144$ gam
M3PO4: ${{n}_{{{M}_{3}}P{{O}_{4}}}}=\frac{1}{3}.{{n}_{MOH}}=\frac{0,624}{3}\Rightarrow {{m}_{{{M}_{3}}P{{O}_{4}}}}=\frac{0,624}{3}.\frac{2372}{13}=37,952\,gam$
Vì: 37,952 g < 20,544.2 = 41,088 < 48,144 g
=> Tạo 2 muối M2HPO4 (x mol); M3PO4 (y mol) (số mol trong 1 phần)
Ta có:
$\frac{2006}{13}.x+\frac{2372}{13}.y=20,544$ (1)
$2x+3y=\frac{0,624}{2}$ (2)
=> x = 0,048; y = 0,072
${{n}_{C{{a}_{3}}{{(P{{O}_{4}})}_{2}}}}=\frac{1}{2}.{{n}_{{{M}_{3}}P{{O}_{4}}}}=0,036\,mol;\,{{n}_{CaHP{{O}_{4}}}}={{n}_{{{M}_{2}}HP{{O}_{4}}}}=0,048\,mol$
=> ${{m}_{\downarrow }}={{m}_{C{{a}_{3}}{{\left( P{{O}_{4}} \right)}_{2}}}}+{{m}_{CaHP{{O}_{4}}}}=0,036.310+0,048.136=17,688\text{ }gam$
Hòa tan hoàn toàn 3,6 gam Mg trong 500 ml dung dịch HNO3 0,8M, phản ứng kết thúc thu được 448 ml một khí X (ở dktc) và dung dịch Y có khối lượng lớn hơn khối lượng dung dịch HNO3 ban đầu là 3,04 gam. Để phản ứng hết với các chất trong Y cần vừa đủ V ml dung dịch NaOH 2M. Giá trị của V là
nMg = 0,15 mol ; nHNO3 = 0,4 mol ; nX = 0,02 mol
mX = 3,6 – 3,04 = 0,56 gam => MX = 28 (N2)
Bảo toàn e : ${{n}_{N{{H}_{4}}N{{O}_{3}}}}~=\frac{1}{8}.\left( 0,15.2-0,02.10 \right)=0,0125\text{ }mol$
Bảo toàn Nito : ${{n}_{HN{{O}_{3}}\,(Y)}}=0,4-\left( 2{{n}_{Mg}}+2{{n}_{{{N}_{2}}}}+2{{n}_{N{{H}_{4}}N{{O}_{3}}}} \right)=0,035\text{ }mol$
${{n}_{NaOH}}~={{n}_{HN{{O}_{3}}(Y)}}+2{{n}_{Mg}}+{{n}_{N{{H}_{4}}N{{O}_{3}}}}=0,3475\text{ }mol$
=> Vdd NaOH = 173,75 ml
Cho 8,64 gam Mg vào dung dịch hỗn hợp NaNO3 và H2SO4, đun nhẹ hỗn hợp phản ứng, lúc đầu tạo ra sản phẩm khử là khí NO, sau đó thấy thoát ra khí không màu X. Sau khi các phản ứng kết thúc thấy còn lại 4,08 gam chất rắn không tan. Biết rằng tổng thể tích của hai khí NO và X là 1,792 lít (đktc) và tổng khối lượng là 1,84 gam. Cô cạn cẩn thận dung dịch sau phản ứng thu được m gam chất muối khan. Giá trị nào sau đây gần với m nhất?
mMg pư = 8,64 – 4,08 = 4,56 (g) => nMg pư = 0,19 (mol) => ne (Mg nhường) = 0,38 (mol)
nX = 0,08 (mol) => MX = 1,84 : 0,08 = 23 (g/mol) => khí X là H2
Gọi nNO = a (mol); nH2 = b (mol)
∑ nX = a + b = 0,08 (1)
∑ mX = 30a + 2b = 1,84 (2)
Từ (1) và (2) => a = 0,06 ; b = 0,02
=> ∑ ne (nhận) = 3nNO + 2nH2 = 0,06.3 + 0,02.2 = 0,22 < ne (Mg nhường) = 0,38
=> tạo muối NH4+
Bảo toàn electron => $2{{n}_{Mg\text{ }pu}}~=3{{n}_{NO}}+2{{n}_{{{H}_{2}}}}+8{{n}_{NH_{4}^{+}}}$
=> ${{n}_{NH_{4}^{+}}}=\dfrac{2{{n}_{Mg\text{ }pu}}-3{{n}_{NO}}-2{{n}_{{{H}_{2}}}}}{8}=0,02\text{ }\left( mol \right)$
BTNT N => ${{n}_{NO_{3}^{-}}}={{n}_{NO}}+{{n}_{NH_{4}^{+}}}~=0,06+0,02=0,08\text{ }\left( mol \right)\Rightarrow {{n}_{N{{a}^{+}}}}=0,08\text{ }\left( mol \right)$
=> mmuối = ${{m}_{MgS{{O}_{4}}}}+{{m}_{{{\left( N{{H}_{4}} \right)}_{2}}S{{O}_{4}}}}+{{m}_{N{{a}_{2}}S{{O}_{4}}}}$= 0,19.120 + 132.0,01 + 0,04.142 = 29,8 (g)
=> Giá trị gần nhất với m là 29,6
Hòa tan hoàn toàn 1,28 g Cu vào 12,6 gam dd HNO3 60% thu được dung dịch X. Cho X tác dụng hoàn toàn với 105ml dung dịch KOH 1M, sau đó lọc bỏ kết tủa thu được dung dịch Y. Cô cạn Y được chất rắn Z. Nung Z đến khối lượng không đổi, thu được 8,78 gam chất rắn. Nồng độ phần trăm của Cu(NO3)2 trong X là:
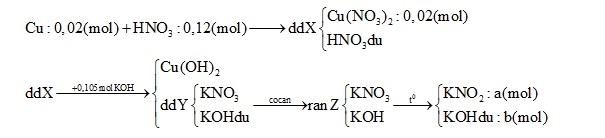
∑nKOH = a + b = 0,105 (1)
∑ mrắn = 85a + 56b = 8,78 (2)
Từ (1) và (2) => a = 0,1 (mol) ; b = 0,005 (mol)
nKNO3 tạo ra từ Cu(NO3)2 = 0,04 (mol)
=> nKNO3 tạo ra từ HNO3 dư = 0,1 – 0,04 = 0,06 (mo)
=> nHNO3 dư = 0,12- 0,06 = 0,06 (mol)
=> nHNO3 bị khử = 0,06 – 0,02.2 = 0,02 (mol)
Với ne( Cu nhường) = 2.nCu = 0,04 (mol) => Trung bình mỗi N+5 nhận 0,04/0,02 = 2e
=> Tạo NO2 (1e) và NO ( 3e)
=> nNO = nNO2 = 0,02/ 2= 0,01(mol)
Vậy mdd X = mCu + mdd HNO3 – m khí = 1,28 + 12,6 – 0,01.30 – 0,01.46 = 13,12 (g)
=> C% Cu(NO3)2 = [( 0,02.188) : 13,12].100% = 28,66%
Từ 5,299 kg quặng photphorit chứa 78% Ca3(PO4)2 còn lại là tạp chất trơ người ta tiến hành điều chế axit photphoric với hiệu suất cả quá trình là 75%. Lấy 0,5% axit thu được hòa tan vào nước rồi trộn với 100 ml dung dịch NaOH xM thu được dung dịch X. Cô cạn cẩn thận dung dịch X thu được 17,2 gam chất rắn. Giá trị gần đúng của x là
PTHH : Ca3(PO4)2 → 2H3PO4
${{n}_{C{{a}_{3}}{{\left( P{{O}_{4}} \right)}_{2}}}}~=\frac{5299.0,78}{310}=13,33$ mol
→ nH3PO4 = 13,33.0,75.2.0,005 = 0,1 mol
Các phương trình có thể xảy ra là :
H3PO4 + 3NaOH → Na3PO4 + 3H2O
H3PO4 + 2NaOH → Na2 HPO4 + 2H2O
H3PO4 + NaOH → NaH2PO4 + H2O
Nếu chất rắn chỉ có muối
Lượng muối tạo ra tối đa khi tạo thành Na3PO4 => mNa3PO4 = 0,1.164 =16,4 < 17,2 → còn dư NaOH
→ chỉ tạo muối Na3PO4: 0,1 mol và còn dư NaOH : 0,8 gam hay 0,02 mol
Bảo toàn nguyên tố Na có 0,1.3 + 0,02 = nNaOH = 0,32 = 0,1x → x = 3,2M
Nhiệt phân hoàn toàn 20,2 gam hỗn hợp gồm Cu(NO3)2 và Fe(NO3)2 thu được hỗn hợp khí X. Dẫn từ từ hỗn hợp khí X vào nước (không có không khí), sau khi các phản ứng xảy ra hoàn toàn thu được 2 lít dung dịch Y và còn 0,448 lít khí (đktc) thoát ra. pH của dung dịch Y là
2Cu(NO3)2 $\xrightarrow{{{t}^{0}}}$2CuO + 4NO2↑+ O2↑ (1)
2x → 4x → x (mol)
4Fe(NO3)2 $\xrightarrow{{{t}^{0}}}$2Fe2O3 + 8NO2↑ + O2↑ (2)
4y → 8y → y (mol)
4NO2 + O2 + 2H2O → 4HNO3 (3)
Ta thấy ở PTHH (1) và (3): ${{n}_{N{{O}_{2}}}}:{{n}_{{{O}_{2}}}}~=4:1$
Ở PTHH (2): ${{n}_{N{{O}_{2}}}}:{{n}_{{{O}_{2}}}}~=8:1$
=> số khí thoát ra chính là khí NO2 dư ở PTHH (2)
=> ${{n}_{N{{O}_{2}}}}=\frac{0,448}{22,4}=0,02$ (mol)
=> 4y = 0,02 => y = 0,005 (mol)
BTKL: mhh = 188.2x + 180.4y = 20,2
=> x = 0,044 (mol)
=> ${{n}_{HN{{O}_{3}}}}=2{{n}_{Cu{{\left( N{{O}_{3}} \right)}_{2}}}}~+2{{n}_{Fe{{\left( N{{O}_{3}} \right)}_{2}}}}-{{n}_{N{{O}_{2}}}}$dư = 2. 2.0,044 + 2. 4.0,005 – 0,02 = 0,196 (mol)
=> ${{C}_{M}}{{~}_{HN{{O}_{3}}}}=\frac{0,196}{2}=0,098M$
=> pH = -log [HNO3] = 1
Cho m gam P2O5 vào dung dịch chứa 0,1 mol NaOH và 0,05 mol KOH, thu được dung dịch X. Cô cạn X, thu được 13,9 gam hỗn hợp chất rắn khan. Giá trị của m là
Giả sử dung dịch kiềm có công thức chung là: MOH: 0,15 (mol) với $M=\frac{0,1.23+0,05.39}{0,1+0,05}=\frac{85}{3}(g/mol)$
+ Nếu phản ứng chỉ tạo 1 muối:
$\begin{array}{*{35}{l}}\begin{align}& M{{H}_{2}}P{{O}_{4}}:0,15(mol)=>{{m}_{1}}=0,15.\frac{376}{3}=18,8(g) \\& {{M}_{2}}HP{{O}_{4}}:0,075(mol)=>{{m}_{2}}=0,075.\frac{458}{3}=11,45(mol) \\& {{M}_{3}}P{{O}_{4}}:0,05(mol)=>{{m}_{3}}=0,05.180=9(g) \\\end{align} \\\end{array}$
Ta thấy 11,45= m2 < mrắn = 13, 9 < m1 = 18,8 => tạo cả 2 muối MH2PO4 và M2HPO4
\(\left\{ {\begin{array}{*{20}{l}}\begin{array}{l}\sum {{n_M} = {\mkern 1mu} } x + 2y = 0,15\\\sum {{m_{{\kern 1pt} ran}}{\mkern 1mu} = \frac{{376}}{3}x + \frac{{458}}{3}y = 13,9}\end{array}\end{array}} \right. = > \left\{ {\begin{array}{*{20}{l}}\begin{array}{l}x = 0,05{\mkern 1mu} (mol)\\y = 0,05{\mkern 1mu} (mol)\end{array}\end{array}} \right.\).
BTNT: P => ${{n}_{P}}~={{n}_{M{{H}_{2}}P{{O}_{4}}}}~+{{n}_{{{M}_{3}}P{{O}_{4}}}}~$ = 0,05 + 0,05 = 0,1 (mol)
=> ${{n}_{{{P}_{2}}{{O}_{5}}}}~=\frac{1}{2}.{{n}_{P}}~=0,05\left( mol \right)\Rightarrow {{m}_{{{P}_{2}}{{O}_{5}}}}~=0,05.142=7,1\text{ (gam)}$
Cho x mol N2 và 12 mol H2 vào bình kín. Tại thời điểm cân bằng thấy có 6 mol NH3 tạo thành.Tính hiệu suất của phản ứng tổng hợp NH3 trên.Biết hiệu suất chung của phản ứng là 75%. Tìm x?
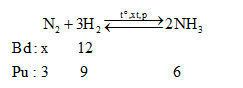
Nhận thấy:
$\frac{{{n}_{{{H}_{2}}pu}}}{{{n}_{{{H}_{2}}bd}}}.100\%=\frac{9}{12}.100\%=75\%$=> Hiệu suất tính theo H2
Nếu H% tính theo N2 thì:
nN2 bđ = 3.(100/75) = 4
=> nN2 bđ = x ≥ 4
Hòa tan hết hỗn hợp X gồm Al, Mg và Al(NO3)3 trong dung dịch chứa NaHSO4 và 0,06 mol NaNO3. Sau phản ứng thu được dung dịch Y chỉ chứa 115,28 gam các muối trung hòa và V lít (đktc) hỗn hợp khí T gồm H2 và N2O (tỉ lệ mol 1:1). Y tác dụng tối đa với 36,8 gam NaOH trong dung dịch và thu được 13,92 gam kết tủa. Giá trị của V là
Đặt nN2O = nH2 = a (mol)
nNH4+ = b (mol)
=> nH+ = 10nN2O + 2nH2 + 10 nNH4+ = 12a + 10b
=> nNa+ = 12a + 10b + 0,06 ; nSO42- = 12a + 10b
nMg = nMg(OH)2 = 0,24 (mol)
Bảo toàn electron: 2nMg + 3nAl = 8nN2O + 2nH2 + 8nNH4+
=> nAl = (10a + 8b – 0,48)/3
BTNT N => 3nAl(NO3)3 + nNaNO3 = 2n N2O + nNH4+
=> nAl(NO3)3 = (2a + b – 0,06)/3
BTNT Al => nAl3+ trong X = nAl + nAl(NO3) = 4a + 3b – 0,18
Khối lượng muối trong X (Na+ ; Al3+; Mg2+; NH4+ ; SO42-):
23( 12a + 10b + 0,06) + 27 (4a + 3b – 0,18) + 0,24.24 + 18b + 96 (12a + 10b) = 115, 28 (1)
nNaOH = 4nAl3+ + 2nMg2+ + nNH4+
=> 0,92 = 4 (4a + 3b – 0,18) + 2.024 + b (2)
Từ (1) và (2) => a = b = 0,04 (mol)
=> nT = 2a = 0,08 (mol)
=> V= 1,792 (lít)

