Đun nóng m gam hỗn hợp Cu và Fe với tỉ lệ khối lượng tương ứng là 7 : 3 với một lượng dung dịch HNO3. Sau khi kết thúc phản ứng thu được 0,75m gam chất rắn, dung dịch X và 5,6 lít (đktc) hỗn hợp sản phẩm khử gồm NO và NO2. Biết lưọng HNO3 đã phản ứng là 44,1 gam. Giá trị của m là
Ta có: nHNO3 = 44,1: 63 = 0,7 mol
Ta có: mCu = 0,7m và mFe = 0,3m
Khối lượng chất rắn sau khi kết thúc các phản ứng là 0,75m → Chất rắn này gồm 0,7m gam Cu và 0,05m gam Fe → mFe pứ = 0,3m - 0,05m = 0,25m
Ta có: nNO + nNO2 = 0,25 mol (1)
Quá trình nhận electron:
NO3-+ 1e + 2H+ → NO2 + H2O
NO3-+ 3e + 4H+ → NO + 2H2O
Ta có: nH+ = 2.nNO2 + 4.nNO = 0, 7 mol (2)
Giải hệ (1) và (2) ta có: nNO = 0,1 mol và nNO2 = 0,15 mol
Do sau phản ứng vẫn còn Fe dư và Cu nên quá trình cho electron là:
Fe → Fe2+ + 2e
Áp dụng định luật bảo toàn electron ta có:
2.nFe = nNO2 + 3.nNO = 0,15 + 3.0,1 = 0,45 mol → nFe pứ = 0,225 mol = 0,25m/56 (mol) → m = 50,4 gam
Lấy m gam hỗn hợp rắn gồm Mg, Zn, FeCO3, FeS2 (trong đó nguyên tố oxi chiếm 16,71% khối lượng hỗn hợp) nung trong bình chứa 0,16 mol O2, sau phản ứng hoàn toàn thu được hỗn hợp rắn X không chứa nguyên tố lưu huỳnh và hỗn hợp khí Y (có tỉ khối so với H2 là 27). Cho X vào dung dịch chứa 0,72 mol HCl và 0,03 mol NaNO3, sau phản ứng hoàn toàn thấy dung dịch thu được chỉ chứa muối clorua và 1,12 lít (đktc) hỗn hợp hai khí thoát ra có khối lượng là 0,66 gam (trong đó có một khí hóa nâu ngoài không khí). Giá trị của m gần nhất với giá trị nào dưới đây?
Đặt số mol của FeCO3 là x mol, FeS2 : y mol
Đốt cháy X có CO2 : x mol và SO2 : 2y mol và hỗn hợp rắn X
Vì dY/H2 = MY : 2 = 27 → MY = 54 = \(\dfrac{{44x + 64.2y}}{{x + 2y}}\) → x = 2y
X + HCl + NaNO3: quy đổi X thành M ( M là kim loại) và O
nkhí = 0,05 mol
Vì khí thu được có M = 0,66 : 0,05 = 13,2 (g/mol) mà một khí hóa nâu ngoài không khí là NO
→ khí còn lại có M < 13,2 → khí đó là H2
nNO = a mol và nH2 = b mol thì nkhí = a + b =0,05 mol và mkhí = 30a + 2b = 0,66
nên a = 0,02 mol và b = 0,03 mol
Vì khí sinh ra có H2 nên lượng NO3- phải phản ứng hết, mà nNO < nNO3 nên xảy ra phản ứng tạo NH4+
PTHH : 4H+ + NO3- + 3e → H2O + NO
0,08 0,02 0,06 0,02
10H+ + NO3- + 9e → 3H2O + NH4+
0,1 0,01 0,09 0,01
O + 2e → O2-
O2- + 2H+ → H2O
2 H+ + 2e → H2
Vì dung dịch thu được chỉ chứa muối clo nên H+ hết nên 0,08 + 0,1 + 2nO + 0,03.2= 0,72 mol→ nO = 0,24 mol
Bảo toàn O cho phản ứng đốt cháy X có nO(X) + 2nO2 = nO(Y) + 2nSO2 + 2nCO2
→ 3x + 2.0,16 = 0,24 + 2.2y + 2x
→ 3x + 0,32 = 0,24 + 2x + 2x → x = 0,08 mol
→ nO(X) = 0,08.3 = 0,24 mol → mO(X) = 3,84 gam
Vì trong X chiếm 16,71% O nên mX = 3,84 : 16,71 .100 =22,98 gam gần nhất với 23 gam
Hòa tan hoàn toàn 16,4g hỗn hợp X gồm FeO, Fe3O4 , Cu (trong đó FeO chiếm 1/3 tổng số mol hỗn hợp X) trong dung dịch NaNO3 và HCl, thu được dung dịch Y chỉ chứa các muối clorua và 0,896 lit NO (sản phẩm khử duy nhất của N+5, dktc). Mặt khác hòa tan hoàn toàn 16,4g hỗn hợp X trên trong dung dịch HCl thu được dung dịch Z chỉ chứa 3 muối có tổng khối lượng là 29,6g. Trộn dung dịch Y với dung dịch Z thì thu được dung dịch T. Cho dung dịch AgNO3 tới dư vào dung dịch T thu được m gam kết tủa . Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với :
- Gọi số mol FeO, Fe3O4, Cu trong X lần lượt là a ; b ; c
=> nX = a + b + c = 3a (= 3nFeO) => 2a – b – c = 0 (1)
- Ta có : mX = mFeO + mFe3O4 + mCu => 72a + 232b + 64c = 16,4g (2)
- Khi X + HCl : Bảo toàn H : nH2O.2 = nHCl = 2x
=> Bảo toàn khối lượng : mX + mHCl = mmuối + mH2O
=> 16,4 + 36,5.2x = 29,6 + 18x => x = 0,24 mol
Bảo toàn nguyên tố oxi : nO(X) = nO(H2O) => a + 4b = 0,24 (3) => nHCl (TN2) = 2nH2O = 0,48 mol
Từ (1,2,3) => a = 0,04 ; b = 0,05 ; c = 0,03 mol
- Thí nghiệm 1 có : nNO = 0,896 : 22,4 = 0,04 mol
=> Công thức tính nhanh : nHCl = 4nNO + 2nO(X) = 0,64 mol
=> nHCl tổng = 0,64 + 0,48 = 1,12 mol
- Trộn dung dịch Y và dung dịch Z để phản ứng với AgNO3 dư
=> Qui đổi về thành quá trình sau :
\(\left. \begin{gathered}F{{\text{e}}_{0,38}} \hfill \\C{u_{0,06}} \hfill \\{O_{0,48}} \hfill \\ \end{gathered} \right\} + \left\{ \begin{gathered}NaN{{\text{O}}_3} \hfill \\HC{l_{1,12}} \hfill \\AgN{O_3} \hfill \\\end{gathered} \right. \to \left\{ \begin{gathered}F{{\text{e}}^{3 + }} \hfill \\C{u^{2 + }} \hfill \\\end{gathered} \right. + \left\{ \begin{gathered}Ag \hfill \\AgCl \hfill \\\end{gathered} \right. + N{O_{0,04}} + {H_2}O\)
(Trong đó : nFe = nFeO + 3nFe3O4 ; nO = nFeO + 4nFe3O4)
(Số mol X gấp đôi vì gộp cả 2 thí nghiệm)
- Bảo toàn electron : 3nFe + 2nCu = nAg + 2nO + 3nNO
=> nAg = 0,18 mol
Lại có : nAgCl = nHCl = 1,12 mol (Bảo toàn nguyên tố Cl)
=> mkết tủa = mAg + mAgCl = 180,16g (Gần nhất với giá trị 180,15)
Cho m1 gam hỗn hợp X chứa Al, Fe(NO3)2 và 0,1 mol Fe3O4 tan hết trong dung dịch chứa 1,025 mol H2SO4. Sau phản ứng thu được 5,04 lít (đktc) hỗn hợp khí Y gồm hai khí trong đó có một khí hóa nâu ngoài không khí và dung dịch Z chỉ chứa các muối trung hòa có khối lượng là 132,5 gam. Biết tỉ khối của Y so với H2 là 31/3. Cho một lượng vừa đủ BaCl2 vào Z sau khi các phản ứng xảy ra xong cho tiếp AgNO3 dư vào thì thu được m2 gam kết tủa. Biết các phản ứng hoàn toàn. Giá trị của tổng m1 + m2 là
MY = 62/3 và trong Y có chứa khí không màu hóa nâu trong không khí => Y có chứa H2 và NO
Đặt nNO = a và nH2 = b (mol)
nY = a + b = 5,04/22,4 = 0,225 (1)
mY = 30a + 2b = 0,225.62/3 (2)
Giải hệ (1) và (2) được a = 0,15 và b = 0,075
Do khí thu được chứa H2 nên ta suy ra dd Z chứa Al3+, Fe2+, NH4+ (có thể có) và SO42-
*Sơ đồ bài toán:
\(\left\{ \matrix{
Al:x \hfill \cr
Fe{(N{O_3})_2}:y \hfill \cr
F{e_3}{O_4}:0,1 \hfill \cr} \right. + {H_2}S{O_4}:1,025 \to {\rm{dd}}\,Z\underbrace {\left\{ \matrix{
A{l^{3 + }}:x \hfill \cr
\buildrel {BT:Fe} \over
\longrightarrow F{e^{2 + }}:y + 0,3 \hfill \cr
\buildrel {BT:N} \over
\longrightarrow N{H_4}^ + :2y - 0,15 \hfill \cr
S{O_4}^{2 - }:1,025 \hfill \cr} \right.}_{132,5(g)} + Y\left\{ \matrix{
NO:0,15 \hfill \cr
{H_2}:0,075 \hfill \cr} \right. + {H_2}O\)
+) m chất tan trong Z = 27x + 56(y + 0,3) + 18(2y - 0,15) + 1,025.96 = 132,5 (3)
+) BTĐT cho dd Z: 3nAl3+ + 2nFe2+ + nNH4+ = 2nSO42- => 3x + 2(y + 0,3) + 2y - 0,15 = 2.1,025 (4)
Giải (3) (4) được x = 0,4 và y = 0,1
=> m1 = mAl + mFe(NO3)2 + mFe3O4 = 0,4.27 + 0,1.180 + 0,1.232 = 52 gam
*Dung dịch Z chứa
\(\left\{ \matrix{
A{l^{3 + }}:0,4 \hfill \cr
F{e^{2 + }}:0,4 \hfill \cr
N{H_4}^ + :0,05 \hfill \cr
S{O_4}^{2 - }:1,025 \hfill \cr} \right.\)
+) Khi cho BaCl2 vừa đủ vào dd Z: nBaCl2 pư = nSO42- = 1,025 mol => mBaSO4 = 1,025 mol
+) Khi cho AgNO3 dư vào dd vừa thu được thì có xảy ra các phản ứng sau:
Ag+ + Cl- → AgCl
Ag+ + Fe2+ → Fe3+ + Ag
Như vậy:
nAgCl = nCl- = 2nBaCl2 = 2,05 mol
nAg = nFe2+ = 0,4 mol
=> m2 = mBaSO4 + mAgCl + mAg = 1,025.233 + 2,05.143,5 + 0,4.108 = 576,2 gam
Vậy: m1 + m2 = 52 + 576,2 = 628,2 gam
Hòa tan hoàn toàn 192,07 gam hỗn hợp NaHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO và Al2O3( trong đó oxi chiếm 30% về khối lượng) tan hết vào X. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch chỉ chứa muối trung hòa và 2,016 lít hỗn hợp khí T có tổng khối lượng 1,84 gam gồm 5 khí đktc, trong đó H2,N2O, NO2 lần lượt có số mol là 0,04; 0,01; 0,01. Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây?
T có chứa 5 khí là sản phẩm của phản ứng Y + dung dịch X trong đó có H2; N2O và NO2 nên hai khí còn lại là NO và N2
Đặt T có nN2 = x mol và nNO = y mol thì nT = 0,09 mol = x + y + 0,04 + 0,01 + 0,01 → x + y =0,03 (1)
Khối lượng của T là mT = 28x + 30y + 0,04.2 +0,01.44 + 0,01.46 → 28x + 30y =0,86 (2)
Giải (1) và (2) có x = 0,02 mol và y =0,01 mol
Vì phản ứng tạo khi H2 nên N+5 phản ứng hết → dung dịch thu được chứa SO42- và các cation khác
Khi cho Z + BaCl2 thì chỉ xảy ra phản ứng : Ba2+ + SO42- → BaSO4
→ nBaSO4 = 1,53 mol
Bảo toàn nguyên tố S có nNaHSO4 = nBaSO4 = 1,53 mol
→ mFe(NO3)3 = 192,07 – 1,53.120 = 8,47 g nên nFe(NO3)3 = 0,035 mol
Bảo toàn nguyên tố N có 3nFe(NO3)3 =0,105 mol
nNO + 2nN2O + 2nN2 + nNO2 = 0,01 + 2.0,01+2.0,02 + 0,01 = 0,08 mol < 3nFe(NO3)3
→ Phản ứng có tạo thêm NH4+ : nNH4 =0,105 – 0,08 =0,025 mol
Ta có 4H+ + NO3- + 3e → NO + H2O
10H+ + 2NO3- + 8e → N2O + 5H2O
12H+ + 2NO3- + 10e → N2 +6 H2O
2H+ + NO3- + 1e → NO2 + H2O
10H+ + NO3- + 8e → NH4+ + 3H2O
2H+ +2e → H2
2H+ + O2- → H2O
Vì dung dịch thu được chỉ chứa muối trung hòa nên bảo toàn H có :
nNaHSO4 = 4nNO + 10nN2O + 12nN2 + 2nNO2 + 10nNH4 + 2nO + 2nH2
→ 1,53 = 4.0,01 + 10.0,01 + 12.0,02 + 2.0,01 + 0,025.10 + 2nO + 2.0,04→ nO = 0,4 mol
→ mO(Y) = 6,4 g → mY = mO : 30 .100 = 21,33 g → gần nhất với 20g
Hòa tan hết một hỗn hợp Q chứa 0,6 mol Fe3O4; 0,5 mol Fe; 0,4 mol CuO vào một dung dịch hỗn hợp gồm HCl 3,7M; HNO3 4,7M. Sau khi phản ứng hoàn toàn thu được dung dịch Y trong đó chỉ chứa muối Fe3+ và muối Cu2+ và khí NO (là sản phẩm khử duy nhất). Tổng khối lượng muối trong dung dịch Y là
Qui hỗn hợp Q về: 0,6 mol Fe2O3; 0,5 mol Fe; 0,6 mol FeO; 0,4 mol CuO
4H+ + NO3- + 3e → NO + 2H2O
Vì phản ứng chỉ tạo Fe3+ và Cu2+
Chỉ có Fe và FeO bị oxi hóa ⇒ nH+ pứ oxi hóa = 4nFe + \(\frac{4}{3}\)nFeO = 2,8 mol ⇒ nNO = 0,7 mol
Gọi số mol HCl là 3,7a mol ⇒ số mol HNO3 là 4,7a mol
⇒ nNO3( muối) = 4,7a – 0,7( mol)
Bảo toàn điện tích: trong Y: 3nFe3+ + 2nCu2+ = nCl- + nNO3- ⇒ (0,6.3+0,5).3 + 2.0,4 = 3,7a + 4,7a – 0,7
⇒ a = 1 ⇒ nHCl = 3,7 mol và nNO3( muối) = 4 mol
⇒ mmuối = mFe3+ + mCu2+ + mCl + nNO3( muối) =533,75 gam
Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí B (gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z thu được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ phần trăm của Fe(NO3)2 trong X là
Nếu KOH phản ứng hết thì T chứa KNO2:
nKNO2 = nKOH = 0,5 mol => m chất rắn = 0,5.101 = 50,5 gam > 41,05 (g) (vô lí) => KOH dư
- Đặt T gồm: KOH dư (a mol) và KNO2 (b mol)
+ BTNT "K": nKOH = nKOH dư + nKNO2 => a + b = 0,5
+ m chất rắn = 56a + 85b = 41,05
Giải hệ được: a = 0,05 và b = 0,45
BTNT "N": nKNO2 = nNO3- (dd X) = 0,45 mol
- Đặt A gồm: Fe (x mol) và Cu (y mol)
+ mA = 56x + 64y = 11,6
+ mFe2O3 + mCuO = 160.0,5x + 80y = 16
Giải hệ được x = 0,15 và y = 0,05
TH1: Giả sử dd X chứa: Fe3+ (0,15), Cu2+ (0,05), H+ và NO3- (0,45)
\(11,6(g)A\left\{ \matrix{
Fe:x \hfill \cr
Cu:y \hfill \cr} \right. + HN{O_3}:0,7 \to \left| \matrix{
{\rm{dd}}\,X\left\{ \matrix{
F{e^{2 + }}:u \hfill \cr
F{e^{3 + }}:v \hfill \cr
C{u^{2 + }}:0,05 \hfill \cr
N{O_3}^ - :0,45 \hfill \cr} \right.\buildrel { + KOH:0,5} \over
\longrightarrow \left\{ \matrix{
\downarrow Y\buildrel {Nung} \over
\longrightarrow \underbrace {\left\{ \matrix{
F{e_2}{O_3}:0,5x \hfill \cr
CuO:y \hfill \cr} \right.}_{16(g)} \hfill \cr
{\rm{dd}}\,Z\buildrel {Co\,can} \over
\longrightarrow T\buildrel {Nung} \over
\longrightarrow \underbrace {\left\{ \matrix{
KOH:0,05 \hfill \cr
KN{O_2}:0,45 \hfill \cr} \right.}_{41,05(g)} \hfill \cr} \right. \hfill \cr
\hfill \cr
Khi\,B \hfill \cr
{H_2}O \hfill \cr} \right.\)
BTĐT => nH+ = nNO3- - 2nFe3+ - 2nCu2+ = 0,45 - 0,15.3 - 0,05.2 = -0,1 < 0 (loại)
TH2: Dung dịch X chứa: Fe2+ (u); Fe3+ (v); Cu2+ (0,05) và NO3- (0,45)
+ BTĐT: 2u + 3v + 2.0,05 = 0,45
+ BTNT "Fe": u + v = 0,15
Giải hệ được u = 0,1 và v = 0,05
BTNT H: nH2O = 0,5.nHNO3 = 0,35 mol
BTNT "N": nN(B) = nHNO3 - nNO3- = 0,7 - 0,45 = 0,25 mol
Do dd X chứa NO3- dư nên không sinh ra H2 => Khí B chỉ chứa N và O
BTNT "O": nO(B) = 3nHNO3 - 3nNO3- - nH2O = 0,7.3 - 0,45.3 - 0,35 = 0,4 mol
=> mB = mN + mO = 0,25.14 + 0,4.16 = 9,9 gam
BTKL: m dd X = mA + mdd HNO3 - mB = 11,6 + 87,5 - 9,9 = 89,2 (g)
C% Fe(NO3)2 = (0,1.180/89,2).100% = 20,2%
Hỗn hợp X gồm Mg, Al, MgO, Al2O3. Hòa tan m gam hỗn hợp X bằng dung dịch HCl vừa đủ thì thu được dung dịch chứa m + 70,295 gam muối. Cho 2m gam X tác dụng với dung dịch H2SO4 đặc, nóng, dư thu được 26,656 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho 3m gam X tác dụng với dung dịch HNO3 loãng, dư thu được 11,424 lít hỗn hợp khí NO và N2O (đktc) có tỉ khối so với H2 là 318/17 và dung dịch Y chứa 486,45 gam muối. Giá trị m gần nhất với giá trị nào sau đây?
Quy đổi m gam X thành Mg; Al và O với số mol lần lượt là a, b và c mol
Khi cho X + HCl thì
mmuối = mMgCl2 + mAlCl3 = 95a + 133,5b = m + 70,295 = 24a + 27b + 16z + 70,295 (1)
2m gam X + H2SO4 đặc nóng dư thì :
Mg → Mg2+ + 2e Al → Al3+ + 3e
O + 2e → O2- S+6 + 2e → S+4
Bảo toàn e có 2.2a + 2.3b – 2.2c = 2nSO2 = 2.1,19 (2)
3m gam X + HNO3 loãng dư → NO và N2O với số mol x và y mol
\(\left\{ \begin{gathered}{n_{khi}} = x + y = 0,51 \\{M_{khi}} = \frac{{30x + 44y}}{{x + y}} = \frac{{318}}{{17}}.2 \\\end{gathered} \right. \to \left\{ \begin{gathered}x = 0,24 \\y = 0,27 \\\end{gathered} \right.\)
Vì 2.3a + 3.3b – 3.2c = 2.1,5.1,19 > 0,24.3 + 0,27.8 nên pư tạo NH4+
Mg → Mg2+ + 2e Al → Al3+ + 3e
O + 2e → O2- N+5 + 3e → N+2
2N+5 + 8e →2N+1 N+5 +8e → N-3
Bảo toàn e có 2.3a + 3.3b – 3.2c = 0,24.3 + 0,27.8 + 8nN-3
→ nN-3 = 2.1,5.1,19 – 0,24.3 – 0,27.8 = 0,08625 → nNH4+ = 0,08625 mol
mmuối = mMg(NO3)2 + mAl(NO3)3 +mNH4MO3 = 148.3a + 213.3b + 0,08625.80 = 486,45(3)
Giải (1)(2)(3) được a = 0,49 mol; b = 0,41 mol và c = 0,51 mol
→ m= 24a + 27b + 16c = 30,99 gam gần nhất với 31
Hòa tan hoàn toàn m gam hỗn hợp X gồm Mg, Fe, FeCO3, Cu(NO3)2 vào dung dịch chứa NaNO3 (0,045 mol) và dung dịch H2SO4 thu được dung dịch Y chỉ chứa 62,605 gam muối trung hòa (không có ion Fe3+) và 3,808 lít (đktc) hỗn hợp khí Z (trong đó có 0,02 mol khí H2). Tỉ khối của Z so với O2 là 19/17. Thêm dung dịch NaOH 1M vào Y đến khi thu được kết tủa lớn nhất là 31,72 gam thì vừa hết 865 ml. Mặt khác, cho Y tác dụng vừa đủ với dung dịch BaCl2 được dung dịch T. Cho lượng dư dung dịch AgNO3 vào T thu được tổng 256,04 gam kết tủa. Phần trăm khối lượng của Mg trong X là
Đặt số mol các muối MgSO4, FeSO4, CuSO4, (NH4)2SO4 lần lượt là a, b, c, d
Bảo toàn Na → nNa2SO4(Y) = 0,5nNaNO3 = 0,0225 mol
120a + 152b + 160c + 132d + 0,0225.142 = 62,605 (1)
nNaOH = 2a + 2b + 2c + 2d = 0,865 (2)
m↓ = 58a + 90b + 98c = 31,72 (3)
Sản phẩm sau đó là Na2SO4 => nNa2SO4 = ½ nNaOH + nNa2SO4 ban đầu = 0,4325 + 0,0225 = 0,455
nBaCl2 = 0,455 => Vừa đủ để tạo ra nBaSO4 = 0,455
Sau đó thêm tiếp AgNO3 dư => Tạo thêm AgCl = 0,455.2 = 0,91 mol và nAg = nFe2+ = b
=> m↓ = 108b + 0,91.143,5 + 0,455.233 = 256,04 (4)
Giải (1) (2) (3) (4) => a = 0,2; b = 0,18; c = 0,04; d = 0,0125 (mol)
Như trên đã có nH2SO4 = nNa2SO4 tổng = 0,455
BTNT H: 2nH2SO4 = 8n(NH4)2SO4 + 2nH2 + 2nH2O => nH2O = 0,385 mol
BTKL: mX = mmuối + mkhí + mH2O – mNaNO3 – mH2SO4 = 27,2 gam
Bảo toàn Mg có nMg = nMgSO4 = 0,2 mol → %Mg = 17,65%
Hòa tan hết 7,44 gam hỗn hợp gồm Mg, MgO, Fe, Fe2O3 vào dung dịch chứa 0,4 mol HCl và 0,05 mol NaNO3, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X chứa 22,47 gam muối và 0,448 lít (đktc) hỗn hợp khí gồm NO, N2 có tỉ khối so với H2 bằng 14,5. Cho dung dịch NaOH (dư) vào dung dịch X thu được kết tủa Y, lấy Y nung trong không khí đến khối lượng không đổi thu được 9,6 gam chất rắn. Mặt khác, nếu cho dung dịch X tác dụng với dung dịch AgNO3 (dư) thu được m gam kết tủa. Biết chất tan trong X chỉ chứa hỗn hợp các muối. Giá trị của m là
- Xét hỗn hợp khí:
Đặt nNO = x mol; nN2 = y mol.
⟹ \(\left\{ \begin{array}{l}x + y = 0,02\\30x + 28y = 0,02.14,5.2 = 0,58\end{array} \right.\)
⟹ x = y = 0,01.
- Bảo toàn khối lượng:
mH2O = mhh bđ + mHCl + mNaNO3 - mmuối - mhh khí = 7,44 + 0,4.36,5 + 0,05.85 - 22,47 - 0,58 = 3,24 gam.
⟹ nH2O = 3,24/18 = 0,18 mol.
- Bảo toàn nguyên tố H:
nHCl = 4nNH4+ + 2nH2O ⟹ nNH4+ = (0,4 - 2.0,18)/4 = 0,01 mol.
- Bảo toàn nguyên tố N:
nNaNO3 = nNO3-/X + nNH4+ + nN/khí
⟹ nNO3-/X = nNaNO3 - nNH4+ - nNO - 2nN2 = 0,05 - 0,01 - 0,01 - 0,01.2 = 0,01 mol.
- Dung dịch X gồm \(\left\{ \begin{array}{l}M{g^{2 + }}\\F{e^{2 + }}\\F{e^{3 + }}\\N{a^ + }:0,{05^{mol}}\\NH_4^ + :0,{01^{mol}}\\C{l^ - }:0,{4^{mol}}\\NO_3^ - :0,{01^{mol}}\end{array} \right.\)
⟹ mMg + mFe = 22,47 - 0,05.23 - 0,01.18 - 0,4.35,5 - 0,01.62 = 6,32 gam.
- Xét 9,6 gam hỗn hợp rắn gồm MgO và Fe2O3.
mO/rắn = 9,6 - 6,32 = 3,28 gam ⟹ nO/rắn = 0,205 mol ⟹ nđiện tích Mg2+, Fe2+ = 0,41 mol (1)
- Xét dung dịch X có nđiện tích Mg2+, Fe2+ = 0,4 + 0,01 - 0,05 - 0,01 = 0,35 mol (2)
- Từ (1)(2), tổng số mol điện tích Mg2+ và Fe2+ trong X nhỏ hơn trong 9,6 gam chất rắn vì trong X có Fe2+ còn trong 9,6 gam chất rắn Fe đã bị oxi hóa hoàn toàn thành Fe3+.
⟹ nFe2+ = 0,41 - 0,35 = 0,06 mol.
- Trong dung dịch X có 0,06 mol Fe2+; 0,4 mol Cl-
⟹ Khi tác dụng với AgNO3 sinh ra kết tủa gồm 0,06 mol Ag và 0,4 mol AgCl.
⟹ m ↓ = 0,06.108 + 0,4.143,5 = 63,88 gam.
Cho hỗn hợp A gồm Fe và Fe2O3 tác dụng với dung dịch X gồm H2SO4 và NaNO3, sau phản ứng thu được 0,896 lít khí NO (đktc) và dung dịch Y chỉ chứa các muối. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2 dư thu được 69,13 gam kết tủa. Cho dung dịch Y tác dụng với dung dịch HCl dư thu được 0,224 lít khí NO và dung dịch Z. Biết dung dịch Z không có khả năng phản ứng với dung dịch X, NO là sản phẩm khử duy nhất của N+5. Phần trăm khối lượng của Fe trong hỗn hợp ban đầu gần nhất với giá trị nào sau đây?
\(\left\{ \begin{array}{l}Fe\\F{e_2}{O_3}\end{array} \right.\)+ dd X \(\left\{ \begin{array}{l}{H_2}S{O_4}\\NaN{O_3}\end{array} \right.\)→ dd Y \(\left\{ \begin{array}{l}F{e^{3 + }}\\F{e^{2 + }}\\N{a^ + }\\SO_4^{2 - }\\NO_3^ - \end{array} \right.\) + NO ↑ + H2O
- A + dd X:
4H+ + NO3- + 3e → NO + 2H2O
0,04 ← 0,04
- Dd Y + HCl dư: (sau phản ứng thu được dung dịch Z không có phản ứng với dung dịch X ⟹ Z không còn Fe2+)
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
0,03 ← 0,01
- Dd Y gồm \(\left\{ \begin{array}{l}F{e^{3 + }}:x\\F{e^{2 + }}:0,03\\N{a^ + }:z\\SO_4^{2 - }:y\\NO_3^ - :z - 0,04\end{array} \right.\)⟹ Bảo toàn điện tích: 3x + 0,06 + z = 2y + z - 0,04
⟹ -3x + 2y = 0,1 (1)
- 69,13 gam kết tủa gồm \(\left\{ \begin{array}{l}Fe{(OH)_2}:0,03\\Fe{(OH)_3}:x\\BaS{O_4}:y\end{array} \right.\)
⟹ 107x + 233y = 69,13 - 0,03.90 = 66,43 (2)
(1)(2) ⟹ x = 0,12; y = 0,23.
⟹ nH+ = 2y = 0,46 mol.
- A + dd X:
4H+ + NO3- + 3e → NO + 2H2O
0,16 ←0,04 ← 0,04
2H+ + O2- → H2O
0,3 → 0,15
⟹ nFe2O3 = 0,15/3 = 0,05 mol
Bảo toàn nguyên tố Fe: nFe = 0,12 + 0,03 - 0,05.2 = 0,05 mol.
⟹ %mFe = 25,93% gần nhất với 26%.
Hòa tan hết 16,58 gam hỗn hợp X gồm Al, Mg, Fe, FeCO3 trong dung dịch chứa 1,16 mol NaHSO4 và 0,24 mol HNO3, thu được dung dịch Z (chỉ chứa muối trung hòa) và 6,89 gam hỗn hợp khí Y gồm CO2, N2, NO, H2 (trong Y có 0,035 mol H2 và tỉ lệ mol NO : N2 = 2 : 1). Dung dịch Z phản ứng tối đa với 1,46 mol NaOH, lọc lấy kết tủa đem nung trong không khí tới khối lượng không đổi thu được 8,8 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Fe đơn chất trong X là:
16,58g \(\left\{ \begin{array}{l}Al\\Mg\\Fe\\FeC{O_3}\end{array} \right.\)+ \(\left\{ \begin{array}{l}NaHS{O_4}:1,16\\HN{O_3}:0,24\end{array} \right.\)→ dd Z \(\left\{ \begin{array}{l}A{l^{3 + }}\\M{g^{2 + }}\\F{e^{2 + }}\\F{e^{3 + }}\\NH_4^ + \\N{a^ + }:1,16\\SO_4^{2 - }:1,16\end{array} \right.\) + khí Y \(\left\{ \begin{array}{l}C{O_2}:b\\NO:2c\\{N_2}:c\\{H_2}:0,035\end{array} \right.\) + H2O
- Đặt nNH4+ = a; nCO2 = b; nN2 = c; nNO = 2c.
- Khối lượng khí Y:
44b + 30.2c + 28c + 2.0,035 = 6,89
⟹ 44b + 88c = 6,82 (1)
- 4H+ + NO3- + 3e → NO + 2H2O
12H+ + 2NO3- + 10e → N2 + 6H2O
10H+ + NO3- + 8e → NH4+ + 3H2O
2H+ + CO32- → CO2 + H2O
2H+ + 2e → H2
⟹ nH+ = 4nNO + 12nN2 + 10nNH4+ + 2nCO2 + 2nH2 = 1,16 + 0,24 = 1,4
⟹ 4.2c + 12c + 10a + 2b = 1,4 - 0,035.2
⟹ 10a + 2b + 20c = 1,33 (2)
- Bảo toàn nguyên tố N
nNO3- = nNH4+ + nNO + 2nN2
⟹ a + 2c + 2c = 0,24 ⟹ a + 4c = 0,24 (3)
Từ (1)(2)(3) ⟹ a = 0,01; b = 0,04; c = 0,0575
⟹ nFeCO3 = 0,04 mol.
- nNaOH pứ = 1,46 mol chênh 0,3 mol so với 1,16 mol (3nAl3+ + 2nMg2+ + 2nFe2+ + 3nFe3+ + nNH4+ = 2nSO42- - nNa+ = 1,16 mol) do còn phản ứng NaOH hòa tan Al(OH)3.
⟹ nAl3+ = 1,46 - 1,16 = 0,3 mol.
- Đặt nMg = x mol; nFe = y mol.
⟹ 24x + 56y + 0,3.27 + 0,04.116 = 16,58 ⟹ 24x + 56y = 3,84 (5)
- 8,8 gam chất rắn gồm MgO: x mol; Fe2O3: 0,5y + 0,02 mol
⟹ 40x + 160(0,5y + 0,02) = 8,8 ⟹ 40x + 80y = 5,6 (6)
Từ (5)(6) ⟹ x = 0,02; y = 0,06
⟹ %mFe = 20,27%.
Cho 3,5a gam hỗn hợp X gồm C và S tác dụng với lượng dư dung dịch HNO3 đặc, nóng, thu được hỗn hợp khí Y gồm NO2 và CO2 có thể tích 3,584 lít (đktc). Dẫn toàn bộ Y qua bình đựng dung dịch nước vôi trong dư thu được 12,5a gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là:
Đặt số mol C và S lần lượt là x và y (mol)
Cho X + HNO3 đặc nóng:
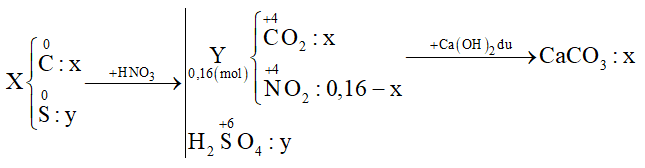
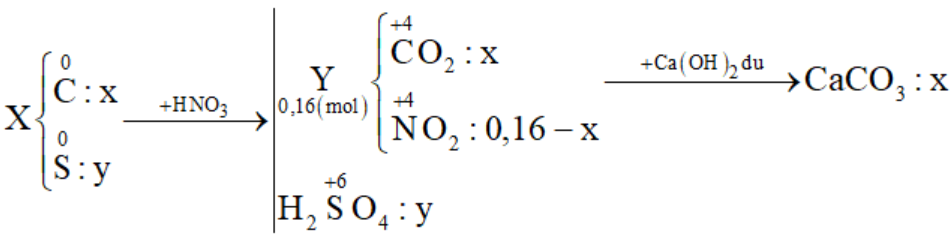
+) Bảo toàn e → 4nC + 6nS = nNO2 → 4x + 6y = 0,16 - x (1)
+) \(\frac{{{m_X}}}{{{m_{CaC{{\rm{O}}_3}}}}} = \frac{{12{\rm{x}} + 32y}}{{100{\rm{x}}}} = \frac{{3,5}}{{12,5}}\) (2)
Giải (1) (2) được x = 0,02 và y = 0,01
⟹ mX = 3,5a = 0,02.12 + 0,01.32 ⟹ a = 0,16
Hòa tan hết 2,72 gam hỗn hợp X gồm: FeS2, FeS, Fe, CuS và Cu trong 500 ml dung dịch HNO3 1M, sau khi kết thúc các phản ứng thu được dung dịch Y và 0,07 mol một chất khí. Cho Y tác dụng với lượng dư dung dịch BaCl2 thu được 4,66 gam kết tủa. Mặt khác, dung dịch Y có thể hòa tan tối đa m gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 là NO. Giá trị của m là
Coi hh X gồm Fe, Cu và S
\(2,72\,g\,X\left\{ \begin{array}{l}Fe:\,x(mol)\\Cu:\,y(mol)\\S\end{array} \right. + HN{O_3}:0,5 \to 0,07\,mol\,NO + dd\,Y\left\{ \begin{array}{l}F{e^{3 + }}\\F{e^{2 + }}\\{H^ + }\\S{O_4}^{2 - }\\N{O_3}^ - \end{array} \right. + BaC{l_2}du \to 4,66\,g\,BaS{O_4}\)
BTNT “S”: nS = nBaSO4 = 4,66 : 233 = 0,02 (mol)
quá trình nhường e
Fe → Fe+3 + 3e
x → 3x (mol)
Cu → Cu+2 + 2e
y → 2y (mol)
S + H2O + 6e → 8H+ + SO42-
0,02 → 0,12→ 0,16 (mol)
quá trình nhận e
4H+ + NO3‑ + 3e → NO + 2H2O (*)
0,28 0,21 ← 0,07 (mol)
Lượng H+ có trong dd Y là: nH+ = nHNO3 + 8nS - 4nNO = 0,5 + 8.0,02 - 4.0,07 = 0,38 (mol)
Ta có hệ: \(\left\{ \begin{array}{l}{m_{hhX}} = 56x + 64y + 0,02.32 = 2,72\\Bt\,e:3x + 2y + 0,12 = 0,21\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,02\\y = 0,015\end{array} \right.\)
Vậy dd Y chứa \(\left\{ \begin{array}{l}F{e^{3 + }}:0,02\,\,mol\\C{u^{2 + }}:0,015\,mol\\{H^ + }:0,38\,\,mol\\S{O_4}^{2 - }:\,0,02\,mol\\N{O_3}^ - :0,43\,mol\end{array} \right. + Cu:a(mol) \to \left\{ \begin{array}{l}F{e^{2 + }}:0,015\,\,mol\\C{u^{2 + }}:0,015\, + a\,mol\\S{O_4}^{2 - }:\,0,02\,mol\\N{O_3}^ - :\end{array} \right. + NO + {H_2}O\)
Cho Cu vào dd Y có: nNO = 1/4nH+ = 1/4.0,38 = 0,095 (mol) (Nhìn theo tương tự như bán phản ứng (*))
Bảo toàn e ta có: 2nCu = nFe3+ + 3nNO = 0,02 + 3.0,095 → nCu = 0,1525 (mol)
→ mCu = 0,1525×64 = 9,76 (g)
Hòa tan hết 11,02 gam hỗn hợp X gồm FeCO3, Fe(NO3)2 và Al vào dung dịch Y chứa KNO3 và 0,4 mol HCl, thu được dung dịch Z và 2,688 lít (đktc) khí T gồm CO2, H2 và NO (có tỷ lệ mol tương ứng là 5 : 2 : 5). Dung dịch Z phản ứng được tối đa với 0,45 mol NaOH. Nếu cho Z tác dụng với dung dịch AgNO3 dư thì thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn và NO là sản phẩm khử duy nhất của N+5 trong các phản ứng trên. Cho các kết luận liên quan đến bài toán gồm:
(a) Khi Z tác dụng với dung dịch KOH thì có khí thoát ra.
(b) Số mol khí H2 trong T là 0,04 mol.
(c) Khối lượng Al trong X là 1,62 gam.
(d) Thành phần phần trăm về khối lượng của AgCl trong m gam kết tủa là 92,75%.
Số kết luận đúng là
Đặt nFe(NO3)2 = x mol và nAl = y mol
Xét hỗn hợp khí T có nT = 0,12 mol thì theo tỉ lệ có nCO2 = 0,05 mol, nH2 = 0,02 mol và nNO = 0,05 mol
→ nFeCO3 = 0,05 mol → 180x + 27y + 0,05.116 = 11,02 (1)
PTHH: 4H+ + NO3- + 3e → 2H2O + NO
2H+ + CO32- → H2O + CO2
2H+ + 2e → H2
→ nH+pư = 0,05.2 + 0,02.2 + 0,05.4 = 0,34 mol → nH+dư = 0,06 mol
Dung dịch Z có Fe3+: z mol thì Fe2+: x + 0,05 – z (mol)
Bảo toàn e có z + 3y = 2nH2 + 3nNO = 0,19 mol (2)
Z + NaOH → thì nNaOH = nH+ dư + 3z + 2(x + 0,05 - z) + 4y = 0,45 mol → 2x + 4y + z = 0,29 mol (3)
Giải (1)(2)(3) có x = 0,02 mol; y = 0,06; z = 0,01 mol
Vậy dung dịch Z có \(\left\{ \begin{array}{l}F{{\rm{e}}^{3 + }}\left( {0,01} \right);F{{\rm{e}}^{2 + }}\left( {0,06} \right);A{l^{3 + }}\left( {0,06} \right);{H^ + }\left( {0,06} \right)\\{K^ + }\left( {0,01} \right)\left( {BT{\rm{D}}T} \right)\\C{l^ - }\left( {0,4} \right)\end{array} \right.\)
Khi cho Z tác dụng với AgNO3 dư:
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO
0,045 ← 0,06
Fe2+ + Ag+ → Fe3+ + Ag
0,015 → 0,015
Ag+ + Cl- → AgCl
0,4 → 0,4
Kết tủa gồm 0,015 mol Ag và 0,4 mol AgCl.
(a) sai, vì Z không có NH4+.
(b) sai, số mol khí H2 trong T là 0,02 mol.
(c) đúng.
(d) sai, %mAgCl = \(\dfrac{{0,4.143,5}}{{0,015.108 + 0,4.143,5}}.100\% \) = 97,26%.
Vậy có 1 phát biểu đúng.

