Dãy gồm các chất cùng tồn tại trong một dung dịch là
Dãy gồm các chất cùng tồn tại trong một dung dịch là H2SO4; HNO3; Fe(NO3)3.
A không tồn tại do Fe2+ tác dụng với H+ và NO3-
B không tồn tại vì Ag+ tác dụng với Cl-
D không tồn tại vì OH- tác dụng với HCO3- và HPO42-
Trong dung dịch X chứa đồng thời các ion: Na+ (0,2 mol); Mg2+ (0,15 mol) và SO42-( x mol). Giá trị của x là
Bảo toàn điện tích ta có:
1.nNa+ + 2nMg2+ = 2nSO42-
=> 1.0,2 + 2.0,15 = 2x
=> x = 0,25 (mol)
Những ion sau đây cùng có mặt trong một dung dịch là:
A loại vì Ag+ + SO42- → Ag2SO4 ↓
B đúng
C loại vì Fe2+ + S2- → FeS↓
D loại vì Fe3+ + 3OH- → Fe(OH)3↓
Dung dịch Y chứa 0,02 mol Mg2+; 0,03 mol Na+; 0,03 mol Cl- và y mol SO42-. Giá trị của y là
Áp dụng định luật bảo toàn điện tích cho dung dịch Y ta có:
2nMg2++nNa+=nCl−+2nSO2−4 => 2.0,02 + 0,03 = 0,03 + 2.y
=> y = 0,02
Những ion có thể cùng tồn tại trong một dung dịch là
* Na+, Ca2+, HSO4-, CO32- Có xảy ra phản ứng :
2HSO−4+CO2−3→H2O+CO2+2SO2−4 => Không thể tồn tại trong dung dịch
* Na+, Mg2+, OH-, NO3- Có xảy ra phản ứng:
Mg2+ + 2OH- → Mg(OH)2↓ => Không thể tồn tại trong dung dịch
* Na+, Ba2+, OH-, Cl- Thỏa mãn điều kiện tồn tại của các ion trong dung dịch
* Ag+, H+, Cl-, SO42- Có xảy ra phản ứng:
Ag+ + Cl- → AgCl↓ => Không thể tồn tại trong dung dịch
Trường hợp nào sau đây các ion không cùng tồn tại trong một dung dịch?
Fe2+ + S2- → FeS↓
Trong các cặp chất cho dưới đây, cặp nào không xảy ra phản ứng với nhau?
A.6 HCl + 2 Fe(OH)3 → 2 FeCl3 + 3 H2O
tạo chất điện li yếu H2O
B. Không phản ứng vì không thỏa mãn 3 điều kiện của phản ứng trao đổi.
C.CuCl2 + 2 AgNO3 → 2 AgCl + Cu(NO3)2
tạo kết tủa AgCl
D.K2SO4 + Ba(NO3)2 → BaSO4 + 2 KNO3
tạo được kết tủa BaSO4
Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong một dung dịch?
A loại vì có phản ứng 2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 3CO2↑ + 6NaCl
B loại vì có phản ứng HNO3 + NaHCO3 → NaNO3 + H2O + CO2↑
C đúng
D loại vì có phản ứng NaCl + AgNO3 → NaNO3 + AgCl↓
Cặp chất nào sau đây không xảy ra phản ứng hóa học?
PTHH:
HCl+NaOH→NaCl+H2O
Zn(OH)2+2HCl→ZnCl2+2H2O
Al(OH)3+NaOH→NaAlO2+2H2O
Trong các cặp chất cho dưới đây, cặp nào không xảy ra phản ứng với nhau?
A. Có phản ứng vì tạo chất điện li yếu (H2O).
B. Không phản ứng vì không thỏa mãn 3 điều kiện của phản ứng trao đổi.
C. Có phản ứng vì tạo kết tủa (AgCl).
D. Có phản ứng vì tạo được kết tủa BaSO4.
Một dung dịch có 0,4 mol Na+, x mol Ca2+, 0,6 mol Cl-. Cô cạn dung dịch trên thì tổng khối lượng muối khan thu được bằng
Áp dụng bảo toàn điện tích: nNa++2nCa2+=nCl−
→0,4+2x=0,6→x=0,1
Bảo toàn khối lượng: mmuoi=mNa++mCa2++mCl−
→mmuoi=0,4.23+0,1.40+0,6.35,5=34,5gam
Cho 10 ml dung dịch hỗn hợp HCl 1M và H2SO4 0,5M. Thể tích dung dịch NaOH 1M cần để trung hòa dung dịch axit đã cho là
nHCl=0,01.1=0,01mol;nH2SO4=0,01.0,5=0,005mol→nH+=nHCl+2nH2SO4=0,01+2.0,005=0,02mol
PTHH:
H++OH−→H2O
Theo phương trình: nOH−=nH+=0,02mol
→nNaOH=nOH−=0,02mol→VNaOH=0,021=0,02 lít = 20 ml
Dung dịch A chứa Mg2+, Ca2+, 0,2 mol Cl-, 0,3 mol NO−3. Thêm dần dung dịch Na2CO3 1M vào dung dịch A cho đến khi thu được lượng kết tủa lớn nhất thì dừng lại. Thể tích dung dịch Na2CO3 đã thêm vào dung dịch là
Vì cả 2 ion Mg2+ và Ca2+ đều tạo kết tủa với CO2−3 nên đến khi được kết tủa lớn nhất thì dung dịch chỉ chứa Na+, Cl- và NO−3
Gọi số mol Na2CO3 là x mol →nNa+=2xmol
Áp dụng định luật bảo toàn điện tích ta có
n+=n−→2x.1=0,2.1+0,3.1→x=0,25
→VNa2CO3=0,251=0,25 lít = 250 ml
Một bạn học sinh thực hiện thí nghiệm sau:
Có năm dung dịch đựng riêng biệt trong 5 ống nghiệm: (NH4)2SO4, FeCl2, Cr(NO3)3, K2CO3, Al(NO3)3. Cho dung dịch Ba(OH)2 đến dư vào 5 dung dịch trên. Sau khi phản ứng kết thúc, số ống nghiệm có kết tủa là:
(NH4)2SO4+ Ba(OH)2 → BaSO4+ 2NH3+ 2H2O
2FeCl3+3 Ba(OH)2 → 2Fe(OH)3+ 3BaCl2
2Cr(NO3)3+ 3Ba(OH)2 → 2Cr(OH)3+ 3Ba(NO3)2
2Cr(OH)3+ Ba(OH)2 → Ba(CrO2)2+ 4H2O
K2CO3+ Ba(OH)2 → BaCO3+ 2KOH
2AlCl3+ 3Ba(OH)2 →2Al(OH)3+ 3Ba(NO3)2
2Al(OH)3+ Ba(OH)2 → Ba(AlO2)2+ 4H2O
Số ống nghiệm có kết tủa là: (NH4)2SO4; K2CO3; FeCl3
Dung dịch X chứa các ion: Ca2+, Na+, HCO3-, Cl-. Trong đó, số mol của ion Cl- là 0,1 mol. Chia X thành hai phần bằng nhau. Phần 1 cho phản ứng với dung dịch NaOH (dư), thu được 2 gam kết tủa.Phần 2 cho phản ứng với dung dịch Ca(OH)2 (dư) thu được 3 gam kết tủa. Mặt khác, nếu đun sôi đến cạn dung dịch X thì thu được m gam kết chất rắn khan. Giá trị của m là
Đặt trong 1/2 dd X {Ca2+:a(mol))Na+:b(mol)HCO3−:c(mol)Cl−:0,05(mol)
Xét dd X + NaOH dư thu được 2 gam kết tủa, còn khi pư với dd Ca(OH)2 dư cho 3 gam kết tủa
→ Chứng tỏ lượng kết tủa 2 gam tính theo số mol của Ca2+ ban đầu.
Lượng kết tủa 3g tính theo số mol của HCO3-
HCO3- + OH- → CO32- + H2O
CO32- + Ca2+ → CaCO3↓
nCaCO3 = 2 : 100 = 0,02 (mol) → nCa2+ bđ = nCaCO3 = 0,02 (mol) → a = 0,02
nCaCO3 = 3 : 100 = 0,03 (mol) → nHCO3- bđ = nCaCO3 = 0,03 (mol) → b = 0,03
Bảo toàn điện tích với các chất trong dd X ta có:
2nCa2++1.nNa+=1.nHCO3−+1.nCl−→2.0,02+b=1.0,03+1.0,05→b=0,04(mol)
Đun sôi 1/2 dd X có phản ứng:
2HCO3- → CO32- + CO2↑ + H2O
0,03 → 0,015 (mol)
Rắn thu được chứa các ion là: Ca2+: 0,02 (mol); Na+: 0,04 (mol); CO32-:0,015 (mol); Cl-: 0,05 (mol)
→ mrắn = 0,02.40 + 0,04.23 + 0,015.60 + 0,05.35,5 = 4,395 (g)
Vậy đun sôi toàn bộ X thu được mrắn = 2×4,395=8,79 (g)
Các ion nào sau đây không cùng tồn tại trong một dung dịch?
Các ion không cùng tồn tại trong một dung dịch là các ion có phản ứng với nhau.
⟹ Dãy chất Na+, Ba2+, Cl-, HCO3-, OH- không cùng tồn tại trong một dung dịch, do xảy ra các phản ứng:
HCO3- + OH- → CO32- + H2O
Ba2+ + CO32- → BaCO3↓
Đáp án: B
Dung dịch X có chứa các ion: Ca2+, Na+, HCO3- và Cl-, trong đó số mol của Cl- là 0,07 mol. Cho ½ dung dịch X phản ứng với dung dịch NaOH dư thu được 2 gam kết tủa. Cho ½ dung dịch X còn lại phản ứng với dung dịch Ca(OH)2 dư thu được 4,5 gam kết tủa. Mặt khác, nếu đun sôi đến cạn dung dịch X rồi nung đến khối lượng không đổi thì thu được m gam chất rắn. Giá trị của m là:
-Cho ½ dung dịch X phản ứng với dung dịch NaOH dư
HCO3- + OH- →CO32- + H2O
Ca2+ + CO32- dư → CaCO3
0,02 0,02
- Cho ½ dung dịch X phản ứng với dung dịch Ca(OH)2 dư
HCO3- + OH- → CO32- + H2O
0,045 0,045
Ca2+ + CO32- → CaCO3
0,045 0,045
Dung dịch X có 0,07 mol Cl-; 0,04 mol Ca2+; 0,09 mol HCO3-; 0,08 mol Na+
Đun sôi dung dịch X thì: 2HCO3- → CO32-+ H2O + CO2
0,09 0,045 0,045 0,045
Sau đó nung chất rắn đến khối lượng không đổi thì CaCO3 bị nhiệt phân tạo thành CaO. Như vậy ta có sơ đồ:
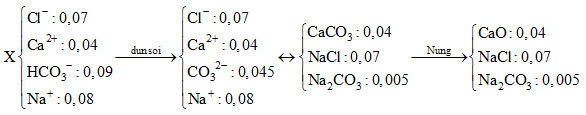
=> m chất rắn = 0,04.56 + 0,07.58,5 + 0,005.106 = 6,865 gam
Cho các phản ứng hóa học sau :
1.(NH4)2CO3 + CaCl2 ->
2. Na2CO3 + CaCl2 ->
3.(NH4)2CO3 + Ca(OH)2 ->
4. K2CO3 + Ca(NO3)2 ->
5.H2CO3 + CaCl2 ->
Số phản ứng có cùng một phương trình ion rút gọn là : CO32- + Ca2+ ->CaCO3 là :
Các phản ứng thỏa mãn : (1) ; (2) ; (4)
Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong một dung dịch?
A loại vì có phản ứng 2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 3CO2↑ + 6NaCl
B loại vì có phản ứng HNO3 + NaHCO3 → NaNO3 + H2O + CO2↑
C đúng
D loại vì có phản ứng NaCl + AgNO3 → NaNO3 + AgCl↓
Những ion sau đây cùng có mặt trong một dung dịch là:
A loại vì Ag+ + SO42- → Ag2SO4 ↓
B đúng
C loại vì Fe2+ + S2- → FeS↓
D loại vì Fe3+ + 3OH- → Fe(OH)3↓

