Cho sơ đồ phản ứng oxi hóa - khử: Cu + HNO3 → Cu(NO3)2 + NO + H2O. Tỉ lệ số mol giữa chất khử và chất oxi hóa là
Bước 1: Xác định chất khử, chất oxi hoá và viết các quá trình cho nhận e
Chất khử : \(\mathop {Cu}\limits^0 \to \mathop {Cu}\limits^{ + 2} + 2e\) | x3
Chất oxi hóa : \(\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} \) | x2
Bước 2: Cân bằng phương trình theo phương pháp thăng bằng electron.
PTHH: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Bước 3: Xác định tỉ lệ số mol giữa chất khử và chất oxi hóa
⟹ Tỉ lệ số mol giữa chất khử và chất oxi hóa là \({n_{Cu}}:{n_{HN{O_3}}} = 3:8\).
Cho 5,6 gam Fe vào 200 ml dung dịch Cu(NO3)2 0,5M và HCl 1,2M thu được khí NO và m gam kết tủa. Xác định m. Biết rằng NO là sản phẩm khử duy nhất của NO3- và không có khí H2 bay ra.
nFe = 5,6 : 56 = 0,1 (mol)
nCu(NO3)2 = 0,2.0,5 = 0,1 (mol) ; nHCl = 0,2.1,2= 0,24 (mol)
3Fe + 2NO3- + 8H+ → 3Fe2+ + 2NO + 4H2O
Ban đầu: 0,1 0,2 0,24
pư: 0,09 ←0,06 ← 0,24
sau: 0,01 0,14
Fe + Cu2+ → Fe2+ + Cu↓
Ban đầu: 0,01 0,2
pư : 0,01 →0,01 → 0,01
=> m kết tủa = mCu = 0,01. 64 = 0,64 (g)
Cho hỗn hợp gồm 0,1 mol CuO và 0,1 mol Cu tác dụng với dung dịch HNO3 đặc nóng, dư thu được V lít khí NO2 (đktc). Giá trị của V là:
Chỉ có Cu phản ứng với HNO3 sinh ra khí.
Áp dụng định luật bảo toàn electron
Quá trình oxi hóa Quá trình khử
Cu → Cu2+ + 2 e N+5 + 1 e → N+4
0.1 → 0.2 mol 0.2 → 0.2 mol
Sử dụng định luật bảo toàn e ta có:
ne cho = ne nhận => \({n_{N{O_2}}}\) = ne nhận = 0,2 mol
=> V = 4,48 lít
Hòa tan hỗn hợp gồm 2,8 gam Fe và 1,6 gam Cu trong 500ml dung dịch hỗn hợp HNO3 0,1M và HCl 0,4M, thu được khí NO (là sản phẩm khử duy nhất) và dung dịch X. Cho X vào dung dịch AgNO3 dư, thu được m (gam) chất rắn. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là:
nFe = 2,8 : 56 = 0,05 (mol)
nCu = 1,6 : 64 = 0,025 (mol)
nHNO3 = 0,05 (mol) ; nHCl = 0,5.0,4 = 0,2 (mol) => ∑ nH+ = 0,25 (mol)
PT ion rút gọn: Fe + NO3- + 4H+ → Fe3+ + NO + 2H2O
pư: 0,05→0,05→0,2 → 0,05 (mol)
Vậy sau phản ứng (1) Fe và NO3- đã phản ứng hết
Cu + 2Fe3+ → Cu2+ + 2Fe2+
0,025→0,05 → 0,025 0,05 (mol)
Vậy dd X thu được chứa: \(\left\{ \matrix{C{u^{2 + }}:0,025 \hfill \cr F{e^{2 + }}:0,05 \hfill \cr {H^ + }:0,05 \hfill \cr C{l^ - }:0,2 \hfill \cr} \right.\)
Cho dd X vào dd AgNO3 có phản ứng
Ag+ + Cl- → AgCl↓
0,2→ 0,2 (mol)
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
0,0375←0,05
=> nFe2+ dư = 0,05 - 0,0375 = 0,0125 (mol)
Fe2+ + Ag+ → Fe3+ + Ag↓
0,0125 → 0,0125 (mol)
Vậy khối lượng kết tủa thu được là: m↓ = mAgCl + mAg = 0,2.143,5 + 0,0125.108 = 30,05 (g)
Cho 2,16 gam Al vào dung dịch chứa 0,4 mol HNO3, thu được dung dịch A và khí N2O (sản phẩm khử duy nhất). Thêm dung dịch chứa 0,25 mol NaOH vào dung dịch A thì lượng kết tủa thu được bằng
nAl = 0,08 mol; nHNO3 = 0,4 mol
PTHH: Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O (Do 0,08/8 < 0,4/30 nên Al phản ứng hết, HNO3 dư)
0,08 → 0,3 → 0,08 (mol)
Vậy dd A gồm: Al3+ (0,08 mol) và H+ dư (0,4 - 0,3 = 0,1 mol) và NO3-
Khi cho 0,25 mol NaOH vào A:
H+ + OH- → H2O
0,1 → 0,1dư 0,15
Al3+ + 3OH- → Al(OH)3
0,15 → 0,05
=> m kết tủa = mAl(OH)3 = 0,05.78 = 3,9 gam
Cho a gam Al tác dụng hết với dung dịch HNO3 loãng thì thu được 0,896 lít hỗn hợp khí X, gồm N2O và NO ở đktc, tỷ khối của X so với hiđro bằng 18,5. Tìm giá trị của a
Bước 1: Tính nN2O, nNO
- Gọi số mol của N2O và NO lần lượt là x và y
\( \to x + y = \dfrac{{0,896}}{{22,4}} \to x + y = 0,04\) (1)
- Tỷ khối của hỗn hợp khí X so với hiđro bằng 18,5 \( \to {M_X} = 18,5.2 = 37\)
\( \to \dfrac{{44{\rm{x}} + 30y}}{{x + y}} = 37\) (2)
- Từ (1) và (2) \( \to \left\{ \begin{array}{l}x = 0,02\\y = 0,02\end{array} \right.\)
Bước 2: Tính mAl = a
- Quá trình trao đổi e:

- Bảo toàn e: \(3{n_{Al}} = 8{n_{{N_2}O}} + 3{n_{NO}}\)
\( \to {n_{Al}} = \dfrac{{8.0,02 + 3.0,02}}{3} = \dfrac{{11}}{{150}}\,\,mol \to a = {m_{Al}} = \dfrac{{11}}{{150}}.27 = 1,98\,\,gam\)
Cho hỗn hợp gồm 7,2 gam Mg và 10,2 gam Al2O3 tác dụng hết với lượng dư dung dịch HNO3. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,448 lít khí N2 duy nhất (đo ở đktc) và dung dịch Y. Khối lượng muối tan trong dung dịch Y là
nMg = 0,3 mol; nAl2O3 = 0,1 mol; nN2 = 0,02 mol
Ta nhận thấy: 2nMg (=0,6 mol) > 10nN2 (=0,2 mol) => Phản ứng tạo NH4NO3
BT e: 2nMg = 10nN2 + 8nNH4NO3 => 2.0,3 = 10.0,02 + 8nNH4NO3 => nNH4NO3 = 0,05 mol
Vậy Y gồm các muối: Mg(NO3)2 (0,3 mol); Al(NO3)3 (0,2 mol) và NH4NO3 (0,05 mol)
=> m muối = 0,3.148 + 0,2.213 + 0,05.80 = 91 gam
Hòa tan hết hỗn hợp X gồm 5,6 gam Fe; 27 gam Fe(NO3)2 và m gam Al trong dung dịch chứa 0,61 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 47,455 gam muối trung hòa và 2,352 lít khí (đktc) hỗn hợp khí Z gồm NO và N2O. Tỉ khối hơi của Z so với H2 là 16. Giá trị của m là
Tính được nNO = 0,09 mol và nN2O = 0,015 mol
\(\left\{ \begin{gathered}
Fe:0,1 \hfill \\
Fe{(N{O_3})_2}:0,15 \hfill \\
Al:b \hfill \\
\end{gathered} \right. + HCl:0,61 \to 47,455(g)\left\{ \begin{gathered}
F{e^{2 + }}:a \hfill \\
F{e^{3 + }}:0,25 - a \hfill \\
A{l^{3 + }}:b \hfill \\
N{H_4}^ + :c \hfill \\
N{O_3}^ - :d \hfill \\
C{l^ - }:0,61 \hfill \\
\end{gathered} \right. + \left\{ \begin{gathered}
NO:0,09 \hfill \\
{N_2}O:0,015 \hfill \\
\end{gathered} \right. + {H_2}O\)
+ BTNT “N”: 0,15.2 = c + d + 0,09 + 0,015.2 (1)
+ m muối = 56.0,25 + 27b + 18c + 62d + 0,61.35,5 = 47,455 (2)
+ BTNT “H” => nH2O = (nHCl – 4nNH4+)/2 = 0,305 – 2c (mol)
BTNT “O”: 0,15.6 = 3d + 0,09 + 0,015 + 0,305 – 2c (3)
+ BTĐT: 2a + 3(0,25-a) + 3b + c = d + 0,61 (4)
Giải (1) (2) (3) (4) được a = 0,1; b = 0,04; c = 0,01; d = 0,17
=> m = mAl = 0,04.27 = 1,08 gam
Hoà tan hoàn toàn hỗn hợp X gồm 0,1 mol CuO và 0,14 mol Al trong 500ml dung dịch HNO3 aM vừa đủ thu được dung dịch Y và 0,672 lít khí N2O duy nhất ở đktc. Tính khối lượng muối tạo thành trong dung dịch Y?
Bước 1: Xác định xem Y có chứa NH4NO3 không.
nN2O = 0,03 mol
- Ta thấy: ne do KL nhường (= 3nAl) > ne do khí nhận (= 8nN2O) ⟹ Sinh ra cả NH4+.
Bước 2: Tính số mol NH4NO3
- Quá trình trao đổi e:
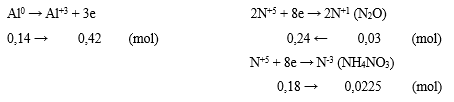
Bước 3: Tính mmuối
- Muối chứa Cu(NO3)2 (0,1 mol); Al(NO3)3 (0,14 mol) và NH4NO3 (0,0225 mol)
⟹ mmuối = 0,1.188 + 0,14.213 + 0,0225.80 = 50,42 gam.
Tổng hệ số cân bằng của các chất tham gia trong phản ứng sau là:
Mg + HNO3 → Mg(NO3)2 + N2O↑ + H2O
\(\begin{array}{l}
x4\,\,\,\,\,\,\,\,\,\,\mathop {Mg}\limits^0 - 2e \to \mathop {Mg}\limits^{ + 2} \\
x1\,\,\,\,\,\,\,\,\,\,\,2\mathop N\limits^{ + 5} + 8e \to 2\mathop N\limits^{ + 1}
\end{array}\)
4Mg + 10HNO3 → 4Mg(NO3)2 + N2O↑ + 5H2O
Tổng hệ số các chất tham gia là: 4 + 10 = 14
Tổng hệ số cân bằng của các chất trong phản ứng dưới đây là :
Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
$\begin{align}& {{\overset{+8/3}{\mathop{Fe}}\,}_{3}}{{O}_{4}}+\text{ }H\overset{+5}{\mathop{N}}\,{{O}_{3}}\xrightarrow{{}}\overset{+3}{\mathop{Fe}}\,{{\left( N{{O}_{3}} \right)}_{3}}+\text{ }\overset{+2}{\mathop{N}}\,O\text{ }+\text{ }{{H}_{2}}O \\ & 3.|3\overset{+8/3}{\mathop{Fe\,}}\,\,\to \,\,3\overset{+3}{\mathop{Fe}}\,\,\,+1e \\ & 1.|\overset{+5}{\mathop{N}}\,\,\,+\,\,3e\,\,\to \,\,\overset{+2}{\mathop{N}}\,O \\ \end{align}$
=> phương trình phản ứng: 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
=> tổng hệ số cân bằng là: 3 + 28 + 9 + 1 + 14 = 55
Để 4,2 gam sắt trong không khí một thời gian thu được 5,32 gam hỗn hợp X gồm sắt và các oxit của nó. Hòa tan hết X bằng dung dịch HNO3, thấy sinh ra 0,448 lít NO (đktc, sản phẩm khử duy nhất) và dung dịch Y. Cô cạn Y thu được m gam muối khan. Giá trị m là
Quy đổi X thành Fe và O
Bảo toàn Fe thì nFe(X) =4,2 : 56 = 0,075 mol
Bảo toàn khối lượng có mO = mX – mFe= 5,32 – 4,2 = 1,12 g => nO = 0,07 mol
Khi cho X + HNO3 thì :
Fe → Fe+3 + 3e O + 2e → O-2
Fe → Fe+2 + 2e N+5 + 3e → N+2
Đặt Fe+2 : x mol và Fe+3 : y mol
Bảo toàn e có 2x + 3y = 2nO + 3nNO → 2x+ 3y = 2.0,07 + 0,02.3 = 0,2 mol e
Ta có nFe = x + y = 0,075 mol nên x = 0,025 mol và y = 0,05 mol
=> muối thu được có 0,025 mol Fe(NO3)2 và 0,05 mol Fe(NO3)3
=> mmuối = 0,025.180 + 0,05.242 =16,6
Phản ứng giữa HNO3 với FeO tạo ra khí NO. Tổng các hệ số trong phương trình của phản ứng Oxi hóa khử này bằng:
3FeO + 10HNO3 → 5H2O + NO + 3Fe(NO3)3
Axit nitric đặc , nóng phản ứng được với tất cả các chất trong nhóm nào sau đây?
B. HNO3 không phản ứng được với Pt
C. HNO3 không phản ứng được với CO2, Au
D. HNO3 không phản ứng được với Au
Cho phản ứng aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O
Các hệ số a,b,c,d,e là những số nguyên đơn giản nhất. Tổng (a+b) bằng
Fe + 4HNO3 → 2H2O + NO + Fe(NO3)3
Hòa tan hoàn toàn 21,38 gam hỗn hợp X gồm Fe, Fe3O4, FeCO3 và FeCl2 (trong đó nguyên tố oxi chiếm 14,967% về khối lượng) vào dung dịch chứa HCl và 0,16 mol NaNO3, thu được dung dịch Y chỉ chứa 47,82 gam muối của kim loại và hỗn hợp hai khí có tỉ khối so với H2 là 17 (trong đó có một khí hóa nâu trong không khí). Cho Y phản ứng hoàn toàn với dung dịch AgNO3 dư, thu được 115,54 gam kết tủa. Phần trăm khối lượng của FeCl2 trong X có giá trị gần nhất với giá trị nào sau đây?
\({m_O} = \dfrac{{14,967\% .21,38}}{{100}} = 3,2\,\,gam \to {n_{O(X)}} = \dfrac{{3,2}}{{16}} = 0,2\,\,mol\)
Hỗn hợp 2 khí chắc chắn có CO2, khí còn lại hóa nâu trong không khí → khí còn lại là NO

Quy đổi hỗn hợp
\(21,38\,(g)\left\{ \matrix{
C{O_2}:2a \hfill \cr
Fe:b \hfill \cr
O:(0,2 - 4a) \hfill \cr
Cl:c \hfill \cr} \right. + \left\{ \matrix{
HCl:d \hfill \cr
NaN{O_3}:0,16 \hfill \cr} \right.\buildrel {} \over
\longrightarrow \left\{ \matrix{
\left\{ \matrix{
NO:5a \hfill \cr
C{O_2}:2a \hfill \cr} \right. \hfill \cr
47,82(g)\left\{ \matrix{
F{e^{2 + }},F{e^{3 + }},N{a^ + } \hfill \cr
N{O_3}^ - ,C{l^ - } \hfill \cr} \right.\buildrel { + AgN{O_3}\,du} \over
\longrightarrow \left\{ \matrix{
\overbrace {Ag,AgCl \downarrow }^{115,54(g)} \hfill \cr
F{e^{3 + }},N{a^ + },N{O_3}^ - \hfill \cr} \right. \hfill \cr
{H_2}O:0,5d \hfill \cr} \right.\)
Sau tất cả ta có:
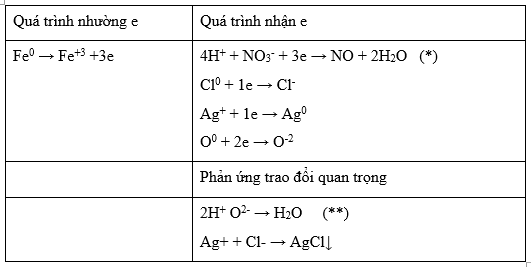
Ta có: mX = 2.44a + 56b + (0,2-4a).16 + 35,5c = 21,38 → 24a + 56b +35,5c = 18,18 (1)
\({n_{{H^ + }}} = 4{n_{NO}} + 2{n_O}\) → d = 4.5a + 2.(0,2- 4a)→ 12a -d = -0,4 (2)
\({n_{{H_2}O}} = \dfrac{1}{2}.{n_{{H^ + }}}\) = 0,5d (mol)
BTKL ta có:
mX + mHCl + \({m_{NaN{{\text{O}}_3}}}\) = mmuối + mkhí + \({m_{{H_2}O}}\)
→ 21,38 + 36,5d + 0,16.85 = 47,82 + 2a.44 + 5a.30 + 0,5d.18
→ 238a - 27,5d = -12,84 (3)
BTNT "Cl": nAgCl = \({n_{C{l^ - }}}\) = c + d (mol)
Bảo toàn e ta có: 3nFe = 2nO + 3nNO + \({n_{C{l^ - }}}\) + nAg
→ 3b = 2(0,2 - 4a) + 3.5a + c + nAg
→ nAg = 3b - 7a - c - 0,4 (mol)
Có: m↓ = mAgCl + mAg → 143,5(c + d) + 108(3b - 7a - c - 0,4) = 115,54
→ -756a + 324b + 35,5c + 143,5d = 158,74 (4)
giải hệ (1), (2), (3), (4) ra được a = 0,02 ; b = 0,24; c = 0,12; d = 0,64
→ \({n_{F{\text{e}}C{l_2}}} = \dfrac{c}{2}\) = 0,06 (mol)
% FeCl2 = \(\dfrac{{0,06.127}}{{21,38}}.100\% \) = 35,64% gần nhất với 36%
Cho hỗn hợp gồm 7,2 gam Mg và 10,2 gam Al2O3 tác dụng hết với lượng dư dung dịch HNO3. Sau khi các phản ứng xảy ra hoàn toàn thu được 0,448 lít khí N2 duy nhất (đktc) và dung dịch Y. Khối lượng muối tan trong Y là
nMg = 0,3 mol; nAl2O3 = 0,1 mol; nN2 = 0,02 mol
Mg0 → Mg+2 + 2e 2N+5 + 10e → N2
0,3 → 0,6 (mol) 0,2 ← 0,02 (mol)
Vì 0,6 > 0,2 ⟹ sản phẩm có NH4NO3.
N+5 + 8e → N-3 (NH4NO3)
(0,6-0,2) → 0,05 (mol)
Muối trong dung dịch sau pư:
nMg(NO3)2 = nMg = 0,3 mol
nAl(NO3)3 = 2nAl2O3 = 0,2 mol
nNH4NO3 = 0,05 mol
→ mmuối = 0,3.148 + 0,2.213 + 0,05.80 = 91 gam.
Cho phản ứng Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
Để được 1 mol NO cần bao nhiêu mol HNO3 tham gia theo phản ứng trên?
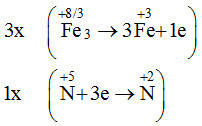
→ 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Cho 8,1 gam Al tác dụng hết với dung dịch HNO3 loãng, dư thu được 1,344 lít N2 (đktc) và dung dịch Z. Cô cạn cẩn thận dung dịch Z thu được m gam chất rắn khan. Giá trị của m là
nAl = 8,1/27 = 0,3 mol
nN2 = 1,344/22,4 = 0,06 mol
Các quá trình nhường nhận electron:
Al - 3e → Al+3
0,3 → 0,9 (mol)
2N+5 + 10e → N20
0,6 ← 0,06 (mol)
Ta thấy số e nhường > số e nhận ⟹ Có cả sản phẩm khử NH4NO3
N+5 + 8e → N-3
0,9-0,6 → 0,0375 (mol)
⟹ Dung dịch Z chứa 0,3 mol Al(NO3)3 và 0,0375 mol NH4NO3.
⟹ m = 0,3.213 + 0,0375.80 = 66,9 g.
Hoà tan hoàn toàn m gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 1M vừa đủ, sau phản ứng thu được dung dịch A gồm 2 muối Fe(NO3)3 và Cu(NO3)2 và 2,24 lít khí NO (đktc) là sản phẩm khử duy nhất. Thể tích dung dịch HNO3 đã dùng là:
nNO=0,1 mol
NO3- + 4H+ + 3e → NO + 2H2O
0,4 ← 0,1
VHNO3 = nHNO3 : CM = 0,4 : 1 = 0,4 lít

