Chất có thể dùng làm khô khí NH3 là
Hóa chất dùng để làm khô khí NH3 là chất có khả năng hút nước nhưng không tác dụng với NH3 \( \to\) chất thỏa mãn là CaO.
A loại vì P2O5 khi tác dụng với nước tạo thành H3PO4 phản ứng được với NH3
\({P_2}{O_5} + 3{H_2}O \to 2{H_3}P{O_4}\)
\({H_3}P{O_4} + 3N{H_3} \to {(N{H_4})_3}P{O_4}\)
B loại vì CuSO4 khan hút nước tạo thành dung dịch có khả năng phản ứng với NH3
\(CuS{O_4} + 2N{H_3} + 2{H_2}O \to Cu{(OH)_2} + {(N{H_4})_2}S{O_4}\)
C loại vì H2SO4 có phản ứng được với NH3
\({H_2}S{O_4} + 2N{H_3} \to {(N{H_4})_2}S{O_4}\)
Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3) như hình vẽ sau đây:
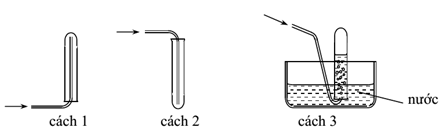
Có thể dùng cách nào trong 3 cách trên để thu khí NH3?
NH3 là khí mùi khai, tan rất nhiều trong nước => không thể thu NH3 bằng cách 3 đẩy nước được.
NH3 có phân tử khối = 17 => nhẹ hơn không khí, do vậy khi thu NH3 bằng cách đẩy không khí mình phải úp ống nghiệm xuống dưới => cách 1 dùng để thu khí NH3
Khí NH3 làm quì tím ẩm chuyển sang màu
khí NH3 tan trong nước tạo dung dịch bazơ => quỳ tím chuyển xanh
Chất nào có thể dùng để làm khô khí NH3?
+ A loại vì H2SO4 phản ứng với NH3: H2SO4 + 2NH3 → (NH4)2SO4
+ B đúng
+ C loại vì P2O5 phản ứng với NH3:
P2O5 + 3H2O → 2H3PO4
3NH3 + H3PO4 → (NH4)3PO4
+ D loại vì tạo Cu(OH)2 sau đó Cu(OH)2 phản ứng với NH3:
CuSO4 + 2NH3 + 2H2O → Cu(OH)2 + (NH4)2SO4
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
Nung hỗn hợp khí A gồm 0,1 mol N2; 0,45 mol H2 trong điều kiện thích hợp thu được hỗn hợp B có dA/B = 10/11. Hiệu suất phản ứng là
- Xét tỉ lệ số mol:
\(\dfrac{{{n_{{N_2}}}}}{1} = \dfrac{{0,1}}{1} < \dfrac{{{n_{{H_2}}}}}{3} = \dfrac{{0,45}}{3}\)
⟹ Tính hiệu suất phản ứng theo N2.
- BTKL: mA = mB ⟹ \({n_A}.\overline {{M_A}} = {n_B}.\overline {{M_B}} \)
⟹ \(\dfrac{{\overline {{M_A}} }}{{\overline {{M_B}} }} = \dfrac{{{n_B}}}{{{n_A}}} \Rightarrow \dfrac{{10}}{{11}} = \dfrac{{{n_B}}}{{0,1 + 0,45}} \Rightarrow {n_B} = 0,5(mol)\)
- Gọi số mol N2 phản ứng là x (mol).
PTHH: N2 + 3H2 ⇄ 2NH3.
x ⟶ 3x → 2x (mol)
⟹ Hỗn hợp B gồm N2 dư: 0,1 – x mol; H2 dư: 0,45 – 3x mol; NH3: 2x mol
⟹ nB = 0,1 – x + 0,45 – 3x + 2x = 0,55 – 2x = 0,5 ⟹ x = 0,025 mol.
Vậy \(H = \dfrac{{{n_{{N_2}(pu)}}.100\% }}{{{n_{{N_2}(bd)}}}} = \dfrac{{0,025.100\% }}{{0,1}} = 25\% \)
Thực hiện phản ứng tổng hợp amoniac trong bình kín ở nhiệt độ xác định. Khi giảm nồng độ N2 đi 2 lần và tăng nồng độ của H2 lên 2 lần thì tốc độc của phản ứng thuận thay đổi như thế nào so với lúc chưa thay đổi nồng độ?
Tốc độ phản ứng thuận tính theo nồng độ của các chất tham gia phản ứng là v = k.[N2].[H2]3
Khi giảm nồng độ N2 đi 2 lần và tăng nồng độ của H2 lên 2 lần thì tốc độ phản ứng thuận khi đó:
v' = k.0,5[N2].23[H2]3 = 4.k.[N2].[H2]3 = 4v.
⟹ Tốc độ phản ứng thuận tăng 4 lần khi giảm nồng độ N2 đi 2 lần và tăng nồng độ của H2 lên 2 lần.
Trong công nghiệp thường sử dụng hai biện pháp để làm tăng hiệu suất của phản ứng tổng hợp amoniac là
- Cân bằng có tổng số mol khí ở vế trái bằng 4 mol và vế phải bằng 2 mol. Khi tăng áp suất chung của hệ sẽ làm cân bằng chuyển dịch theo chiều thuận ⟹ Làm tăng hiệu suất phản ứng.
- Phản ứng thuận là phản ứng tỏa nhiệt (ΔH < 0) ⟹ Khi giảm nhiệt độ của hệ sẽ làm cân bằng chuyển dịch theo chiều thuận ⟹ Làm tăng hiệu suất phản ứng.
Vậy trong công nghiệp thường sử dụng hai biện pháp để làm tăng hiệu suất của phản ứng tổng hợp amoniac là giảm nhiệt độ và tăng áp suất.
Cho 12 lít hỗn hợp N2 và H2 (tỉ khối so với H2 bằng 3,6) nung trong bình kín với xúc tác thích hợp một thời gian thu được 10,56 lít hỗn hợp khí. Các khí được đo ở cùng điều kiện. Hiệu suất phản ứng là
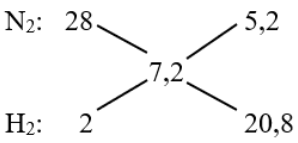
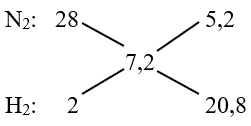 ⟹ VN2 : VH2 = 5,2 : 20,8 = 1 : 4
⟹ VN2 : VH2 = 5,2 : 20,8 = 1 : 4
⟹ VN2 = 2,4 lít và VH2 = 9,6 lít
Ta thấy: \(\dfrac{{2,4}}{1} < \dfrac{{9,6}}{3}\) ⟹ hiệu suất tính theo N2
PTHH: N2 + 3H2 ⇄ 2NH3
Ta có: Vgiảm = 12 - 10,56 = 1,44 lít = 2VN2 pư ⟹ VN2 pư = 0,72 lít
⟹ H = (VH2 pư/VH2 bđ).100% = (0,72/2,4).100% = 30%
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau một thời gian phản ứng, áp suất khí trong bình giảm 20% so với áp suất ban đầu. Biết tỉ lệ số mol của nitơ đã phản ứng là 50%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu là
Xét 1 mol khí N2, nN2 pư = 0,5 mol và gọi nH2 là x
PTHH: N2 + 3H2 ⇄ 2NH3.
0,5 → 1,5 1
nN2 dư = 0,5 mol; nH2 dư = x – 1,5 mol; nNH3 = 1 mol
nSau = 0,5 + x – 1,5 + 1 = x mol
nđầu = 1 + x mol
Áp suất khí trong bình giảm 20% so với áp suất ban đầu ⟹ số mol khí trong bình cũng giảm 20% so với số mol ban đầu (số mol và áp suất tỉ lệ thuận với nhau theo phương trình \(n = \dfrac{{PV}}{{RT}}\))
⟹ nđầu – nSau = 20%.nđầu ⟹ 1 + x – 1 = 0,2. (1 + x) ⟹ x = 4
%nN2 = \(\dfrac{{1.100\% }}{{1 + 4}} = 20\% \), %nH2 =80%.
Đun nóng trong điều kiện thích hợp hỗn hợp A gồm N2 và H2 có tỉ khối so với H2 là 3,6 thu được hỗn hợp B (biết tỉ khối của B so với H2 là 30/7). Hiệu suất phản ứng là
\(\overline {{M_A}} \) = 7,2; \(\overline {{M_B}} \) = 60/7
Ta xét 1 mol hỗn hợp A và trong A gọi nN2 là x, nH2 là y
x + y = 1 và 28x + 2y = 7,2 ⟹ x = 0,2; y = 0,8
⟹ Tính hiệu suất theo N2.
Dùng BTKL ta có
mA = mB ⟹ nA. \(\overline {{M_A}} \) = nB. \(\overline {{M_B}} \) ⟹ \(\dfrac{{\overline {{M_A}} }}{{\overline {{M_B}} }} = \dfrac{{{n_B}}}{{{n_A}}}\)⟹ nB = 0,84 mol
⟹ nA – nB = 2.nN2 phản ứng = 1 – 0,84 = 0,16 mol ⟹ nN2 pư = 0,16/2 = 0,08 mol.
H% = (0,08/0,2).100% = 40%
Điều chế amoniac bằng cách nung hỗn hợp A gồm N2 và H2 có tỉ khối so với H2 là 2,625. Đun nóng hỗn hợp A trong điều kiện thích hợp được hỗn hợp B (biết tỉ khối của B so với H2 là 2,8). Hiệu suất phản ứng là
\(\overline {{M_A}} \) = 5,25; \(\overline {{M_B}} \) = 5,6
Ta xét 1 mol hỗn hợp A và trong A gọi nN2 là x, nH2 là y
x + y = 1 và 28x + 2y = 5,25 ⟹ x = 0,125; y = 0,875
⟹ Tính hiệu suất theo N2.
Dùng BTKL ta có
mA = mB ⟹ \({n_A}.\overline {{M_A}} = {n_B}.\overline {{M_B}} \) ⟹ \(\dfrac{{\overline {{M_A}} }}{{\overline {{M_B}} }} = \dfrac{{{n_B}}}{{{n_A}}}\)⟹ nB = 0,9375 mol
⟹ nA – nB = 2.nN2 phản ứng = 1 – 0,9375 = 0,0625 mol ⟹ nN2 pư = 0,0625/2 = 0,03125 mol.
H% = (0,03125/0,125).100%) = 25%
Dẫn 6,72 lít N2 (đktc) phản ứng với 16,8 lít H2 (đktc) trong điều kiện thích hợp thu được hỗn hợp B có dA/B = 17/21. Hiệu suất phản ứng là
Dựa vào tỉ lệ số mol: \(\dfrac{{{n_{{N_2}}}}}{1} = \dfrac{{0,3}}{1} > \dfrac{{{n_{{H_2}}}}}{3} = \dfrac{{0,75}}{3}\)⟹ Tính hiệu suất phản ứng theo H2.
BTKL: mA = mB ⟹ \({n_A}.\overline {{M_A}} = {n_B}.\overline {{M_B}} \) ⟹ \(\dfrac{{\overline {{M_A}} }}{{\overline {{M_B}} }} = \dfrac{{{n_B}}}{{{n_A}}} \Rightarrow \dfrac{{17}}{{21}} = \dfrac{{{n_B}}}{{0,3 + 0,75}} \Rightarrow {n_B} = 0,85(mol)\)
PTHH: N2 + 3H2 ⇄ 2NH3.
x ← 3x → 2x mol
Gọi nN2 phản ứng = x mol ⟹ nH2 phản ứng = 3x mol; nNH3 = 2x mol
⟹ Hỗn hợp B gồm: N2 dư: 0,3 – x mol; H2 dư: 0,75 – 3x mol; NH3: 2x mol
⟹ nB = 0,3 – x + 0,75 – 3x + 2x = nA – 2x = nA – \(\dfrac{2}{3}\)nH2 phản ứng
⟹ nA – nB = \(\dfrac{2}{3}\).nH2 phản ứng ⟹ 1,05 – 0,85 = \(\dfrac{2}{3}\).nH2 pư ⟹ nH2 pư = 0,3 mol.
H% = (0,3.100%)/0,75 = 40%.
Cho hỗn hợp khí A gồm 0,2 mol N2; 0,9 mol H2 phản ứng trong điều kiện thích hợp thu được hỗn hợp B biết dA/B =51/55. Hiệu suất phản ứng là
Dựa vào tỉ lệ số mol: \(\dfrac{{{n_{{N_2}}}}}{1} = \dfrac{{0,2}}{1} < \dfrac{{{n_{{H_2}}}}}{3} = \dfrac{{0,9}}{3}\)⟹ Tính hiệu suất phản ứng theo N2.
BTKL: mA = mB ⟹ \({n_A}.\overline {{M_A}} = {n_B}.\overline {{M_B}} \) ⟹ \(\dfrac{{\overline {{M_A}} }}{{\overline {{M_B}} }} = \dfrac{{{n_B}}}{{{n_A}}} \Rightarrow \dfrac{{51}}{{55}} = \dfrac{{{n_B}}}{{0,2 + 0,9}} \Rightarrow {n_B} = 1,02(mol)\)
PTHH: N2 + 3H2 ⇄ 2NH3.
ta có nA – nB = 2.nN2 phản ứng ⟹ 1,1 – 1,02 = 2.nN2 pư ⟹ nN2 pư = 0,04 mol.
H% = (0,04/0,2).100% = 20%.
Nung hỗn hợp chứa 2,24 lít N2; 8,96 lít H2 trong điều kiện thích hợp. Phản ứng xong thu được hỗn hợp chứa 9,856 lít hỗn hợp khí (các khí đều đo ở đktc). Hiệu suất phản ứng là
Dựa vào tỉ lệ số mol: \(\dfrac{{{n_{{N_2}}}}}{1} = \dfrac{{0,1}}{1} < \dfrac{{{n_{{H_2}}}}}{3} = \dfrac{{0,4}}{3}\)⟹ N2 hết trước còn H2 hết sau.
Gọi nN2 phản ứng =x mol ⟹ nN2 dư =0,1 – x mol.
PTHH: N2 + 3H2 ⇄ 2NH3.
x ← 3x → 2x
Ta có nhỗn hợp = nN2 dư + nH2 dư + nNH3 = 0,1 – x + 0,4 – 3x + 2x = 0,44
⟹ x = 0,03 mol ⟹ H% = (0,03/0,1).100% = 30%.
Cho 10,08 lít N2 tác dụng với 20,16 lít H2 (các khí đo ở đktc) trong điều kiện thích hợp. Phản ứng xong thu được hỗn hợp chứa 26,88 lít mol hỗn hợp khí. Hiệu suất phản ứng là
Dựa vào tỉ lệ số mol: \(\dfrac{{{n_{{N_2}}}}}{1} = \dfrac{{0,45}}{1} > \dfrac{{{n_{{H_2}}}}}{3} = \dfrac{{0,9}}{3}\) ⟹ hiệu suất tính theo H2
Gọi nH2 phản ứng = x ⟹ nH2 dư = 0,9 – x.
PTHH: N2 + 3H2 ⇄ 2NH3.
x/3 ← x → 2x/3
Ta có nhỗn hợp = nN2 dư + nH2 dư + nNH3 = 0,45 – x/3 + 0,9 – x + 2x/3 = 1,2
⟹ x = 0,225 mol ⟹ H% = (0,225/0,9).100% = 25%.
Cho 0,84 lít N2 và 4,2 lít khí H2 vào bính kín nung nóng trong điều kiện thích hợp thu được V lít NH3 (các khí đều đo ở đktc). Biết hiệu suất phản ứng là 32%. Giá trị của V là
nN2 = 0,0375 mol; nH2 =0,1875 mol
PTHH: N2 + 3H2 ⇄ 2NH3
Từ pthh ta có tỉ lệ: \(\dfrac{{{n_{{N_2}}}}}{1} < \dfrac{{{n_{{H_2}}}}}{3}\) ⟹ hiệu suất tính theo N2
Với H% = 32% ta có nN2 phản ứng = 0,0375.32% = 0,012 mol ⟹ nNH3 = 0,012.2 = 0,024 mol
⟹ VNH3 =0,5376 lít
Cho 3,36 lít N2 và 16,8 lít khí H2 vào bính kín nung nóng trong điều kiện thích hợp thu được V lít NH3 (các khí đều đo ở đktc). Biết hiệu suất phản ứng là 25%, giá trị của V là
nN2 = 0,15 mol; nH2 = 0,75 mol
PTHH: N2 + 3H2 ⇄ 2NH3.
Từ PTHH ta có tỉ lệ: \(\dfrac{{{n_{{N_2}}}}}{1} < \dfrac{{{n_{{H_2}}}}}{3}\) ⟹ hiệu suất tính theo N2
Với H% = 25% ta có nN2 phản ứng = 0,15.25% = 0,0375 mol
⟹ nNH3 = 0,0375.2 = 0,075 mol
⟹ VNH3 = 1,68 lít
Cho 2a mol N2 và 3a mol H2 vào bình kín nung nóng với điều kiện thích hợp thu được V lít NH3 (đktc) biết hiệu suất phản ứng là 35%. Mối liên hệ giữa V và a là
PTHH: N2 + 3H2 ⇄ 2NH3.
Từ pthh ta có tỉ lệ: \(\dfrac{{{n_{{N_2}}}}}{1} = \dfrac{{2a}}{1} > \dfrac{{{n_{{H_2}}}}}{3} = \dfrac{{3a}}{3}\) ⟹ hiệu suất tính theo H2
Với H% = 35% ta có nH2 phản ứng = 3a.35% = 1,05a mol ⟹ nNH3 = 1,05a.2/3 = 0,7a mol
⟹ VNH3 = 0,7a.22,4 = 15,68a (lít)
⟹ V = 15,68a
Nhận định đúng về tính chất NH3 là
A sai vì trong phân tử NH3 nguyên tử N có 1 cặp e hóa trị.
B đúng.
C sai, dung dịch NH3 có tính bazo yếu.
D sai NH3 tác dụng với một số dung dịch muối (bởi tính chất bazo yếu)
Cho NH3 dư vào dung dịch chất nào sau đây, thu được kết tủa?
Cho NH3 dư vào dung dịch FeSO4 ta thu được kết tủa.
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 ↓ + (NH4)2SO4
Chú ý: NH3 có thể hòa tan Cu(OH)2, Zn(OH)2, Ag2O tạo thành dung dịch phức chất nên không thu được kết tủa.

