Phát biểu nào sau đây sai?
A sai vì NH3 không phải là nhiên liệu tên lửa mà là N2H4
B, C, D đúng
Phản ứng nào sau đây dùng để điều chế NH3 trong phòng thí nghiệm?
Phản ứng điều chế NH3 trong phòng thí nghiệm:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O.
Cho hình vẽ và các mệnh đề sau:
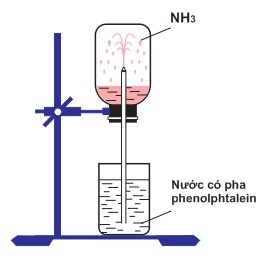
(1) Thí nghiệm trên chứng tỏ NH3 tan nhiều trong nước.
(2) Thí nghiệm trên chứng tỏ NH3 có tính bazơ.
(3) Nước phun vào bình do NH3 tan mạnh trong nước làm tăng áp suất trong bình.
(4) Nước ở trong bình chuyển từ không màu sang màu xanh.
Số mệnh đề đúng là:
(1) Đúng, NH3 tan nhiều làm giảm áp suất bình chứa.
(2) Đúng, vì phenolphtalein chuyển hồng.
(3), (4) Sai
Dẫn 2,24 lít khí NH3 (đktc) đi qua ống đựng 32 gam bột CuO nung nóng thu được chất rắn X và khí Y. Thể tích khí Y sinh ra là:
PTHH: 2NH3+ 3CuO \(\xrightarrow{{{t}^{o}}}\) 3Cu + N2 + 3H2O
Bđ: 0,1 0,4
Pư: 0,1 → 0,15 → 0,05 (mol)
nY = nN2 = 0,05.22,4 = 1,12 lít
Trong các phản ứng sau:
1) 2NH3 + H2SO4 → (NH4)2SO4;
2) 4NH3 + 3O2 → 2N2+ 6H2O;
3) 2NH3 + Cl2 → N2 + 6HCl;
4) 3NH3 + 3H2O + Fe(NO3)3 → Fe(OH)3 + 3NH4NO3;
5) 2NH3 → N2 + 3H2;
Số phản ứng trong đó NH3 thể hiện tính khử là
1) NH3 không phải chất khử vì N giữ nguyên số oxi hóa
2) NH3 là chất khử vì N-3→ N0
3) NH3 là chất khử vì N-3→ N0
4) NH3 không phải chất khử vì N giữ nguyên số oxi hóa
5) NH3 là chất khử vì N-3→ N0
→ Có 3 phản ứng NH3 thể hiện tính khử.
Cho các phản ứng sau:
(1) 2NH3 + H2SO4 → (NH4)2SO4.
(2) 4NH3 + 3O2 → 2N2 + 6H2O.
(3) 2NH3 + 3Cl2 → N2 + 6HCl.
(4) 3NH3 + 3H2O + Al(NO3)3 → Al(OH)3 +3NH4NO3.
(5) 4NH3 + 5O2 → 4NO + 6H2O.
(6) 2NH3 + 3CuO → 3Cu + 3N2 + 3H2O
Các phản ứng trong đó NH3 có tính khử là
(1) sai vì số oxi hóa của nguyên tố N không đổi (trước và sau pư đều là -3)
(2) đúng vì N-3 → N0
(3) đúng vì N-3→ N0
(4) sai vì số oxi hóa của nguyên tố N không đổi (trước và sau pư đều là -3)
(5) đúng vì N-3 → N+2
(6) đúng vì N-3 → N0
Hình vẽ bên mô tả hiện tượng của thí nghiệm thử tính tan của khí A trong nước. Khí A có thể là khí nào trong các khí sau:
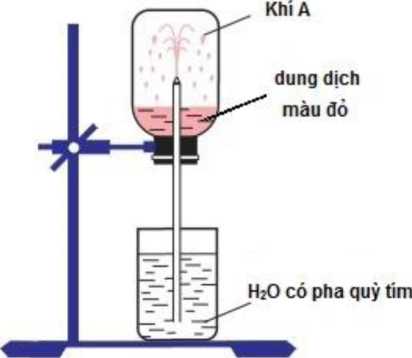
Khí trong bình khi hòa tan trong dung dịch quì tím có màu đỏ => dung dịch có tính axit
Mặt khác, khi khí tan khiến có nước ở bình dưới phun lên bình trên => chứng tỏ khí tan rất mạnh trong nước làm giảm áp suất trong bình trên => chênh lệch áp suất => nước bị kéo từ bình dưới đi lên.
=> Chỉ có khí HCl thỏa mãn 2 điều kiện trên
Trong phòng thí nghiệm, có thể chứng minh khả năng hòa tan rất tốt trong nước của một số chất khí theo hình vẽ:
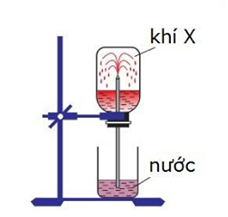
Thí nghiệm trên được sử dụng với các khí nào sau đây
Theo hình vẽ chất khí này tan tốt trong nước
→ Thí nghiệm trên được sử dụng với các khí : HCl và NH3 là hai khí tan tốt trong nước
Cho vài giọt quỳ tím vào dung dịch NH3 thì dung dịch chuyển thành
Dd NH3 có môi trường bazo nên làm quỳ tím chuyển sang màu xanh
Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3) như hình vẽ sau đây:
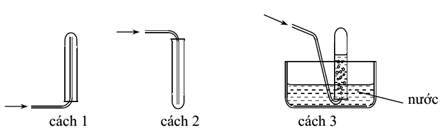
Có thể dùng cách nào trong 3 cách trên để thu khí NH3?
NH3 là khí mùi khai, tan rất nhiều trong nước => không thể thu NH3 bằng cách 3 đẩy nước được.
NH3 có phân tử khối = 17 => nhẹ hơn không khí, do vậy khi thu NH3 bằng cách đẩy không khí mình phải úp ống nghiệm xuống dưới => cách 1 dùng để thu khí NH3
X là hỗn hợp khí H2 và N2 có tỉ khối đối với oxi bằng 0,225. Dẫn X vào bình có xúc tác bột sắt, đun nóng thì thu được hỗn hợp khí Y có tỷ khối đối với oxi bằng 0,25. Tính hiệu suất tổng hợp NH3
MX = 0,225.32 = 7,2
H2: 2 20,8
7,2 => nH2/nN2 = 20,8/5,2 = 4
N2: 28 5,2
Giả sử nH2 = 4 mol và nN2 = 1 mol
BTKL: mX = mY => 4.2 + 1.28 = nY.0,25.32 => nY = 4,5 mol
3H2 + N2 \(\overset {{t^o},xt} \leftrightarrows \) 2NH3
Bđ: 4 1 (mol)
Pư: 3x x 2x (mol)
Sau: 4-3x 1-x 2x (mol)
nY = 4-3x + 1-x + 2x = 4,5 => x = 0,25 mol
Hiệu suất tính theo N2 => H = (0,25/1.100%) = 25%
Dung dịch (đặc) nào sau đây khi tiếp xúc với dung dịch NH3 đặc sẽ tạo thành khói trắng ?
Dd HCl đậm đặc tiếp xúc với NH3 đặc sẽ tạo ra khói trắng
HCl + NH3 → NH4Cl (khói trắng)
Hiện tượng xảy ra khi cho giấy quỳ khô vào bình đựng khí amoniac là
NH3 không làm đổi màu giấy quỳ khô.
Hỗn hợp X gồm N2 và H2 có tỉ khối hơi so với H2 là 3,6. Cho hỗn hợp X vào bình kín với xúc tác thích hợp rồi thực hiện phản ứng tổng hợp NH3 thấy thu được hỗn hợp Y gồm N2, H2 và NH3. Biết tỉ khối hơi của Y so với H2 bằng 4. Hiệu suất phản ứng tổng hợp NH3 trong phản ứng trên là
MX = 3,6.2 = 7,2 (g/mol) ; MY = 4.2 = 8 (g/mol)
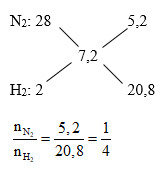
Coi hỗn hợp ban đầu có 5 mol thì nN2 = 1 (mol); nH2 = 4 (mol)
Gọi số mol của N2 pư là x (mol)
PTHH: N2 + 3H2 \(\underset{{}}{\overset{{{t^0},p,xt}}{\longleftrightarrow}}\) 2NH3
PƯ x → 3x 2x => số mol giảm là 2x (mol)
=> số mol sau pư: nsau = ntrước - ngiảm = 5 – 2x (mol)
Ta có:
\(\begin{gathered}
\frac{{ntrc}}{{n\,sau}} = \frac{{Msau}}{{M\,truoc}} \Rightarrow \frac{5}{{5 - 2x}} = \frac{8}{{7,2}} \hfill \\
\Rightarrow 36 = 40 - 16x \hfill \\
\Rightarrow x = 0,25\,(mol) \hfill \\
\% H = \frac{{{n_{{N_2}pu}}}}{{{n_{{N_2}bd}}}}.100\% = \frac{{0,25}}{1}.100\% = 25\% \hfill \\
\end{gathered} \)
Cho cân bằng hóa học sau trong bình kín:
\({N_2}(k) + 3{H_2}(k) \rightleftarrows 2N{H_3}(k);\,\,\Delta H = - 92KJ/mol\)
Trong các yếu tố:
(1) Thêm một lượng N2 hoặc H2.
(2) Thêm một lượng NH3.
(3) Tăng nhiệt độ của phản ứng.
(4) Tăng áp suất của phản ứng.
(5) Dùng thêm chất xúc tác.
Có bao nhiêu yếu tố làm cho tỉ khối của hỗn hợp khí trong bình so với H2 tăng lên?
Tỉ khối hỗn hợp khí với H2 tăng => chứng tỏ số mol khí giảm ( vì khối lượng trước phản ứng và sau phản ứng không đổi) => phản ứng dịch chuyển theo chiều thuận
Các yếu tố thỏa mãn là (1) và (4)
Cho vài giọt quỳ tím vào dung dịch NH3 thì dung dịch chuyển thành
Dung dịch NH3 có môi trường bazơ nên làm quỳ tím chuyển sang màu xanh.
Cho các phản ứng sau; NH3 thể hiện tính khử trong phản ứng:
NH3 thể hiện tính khử khi tác dụng với các chất có tính oxi hóa, sau phản ứng số oxi hóa của N sẽ tăng.
Tính chất hóa học của NH3 là
Tính chất hóa học của NH3 là tính bazo yếu, tính khử.
Cho 4 mol N2 và 16 mol H2 vào bình kín. Tại thời điểm cân bằng thu được x mol hỗn hợp khí. Biết hiệu suất của phản ứng tổng hợp NH3 là 70%. Tính x?
![]()
=> H tính theo N2
H= ![]() mol
mol
N2 + 3 H2 <-> 2NH3
bđ 4 16
p/u 2,8 8,4 5,6
sau 1,2 7,6 5,6
=> x=14,4 mol
Thêm NH3 đến dư vào dung dịch hỗn hợp chứa 0,01 mol FeCl3 ; 0,2 mol CuCl2. Khi các phản ứng xảy ra hoàn toàn, khối lượng kết tủa thu được là :
FeCl3, CuCl2 ![]() Fe(OH)3
Fe(OH)3
Do Cu(OH)2 sinh ra tạo phức hết với dung dịch NH3
=> mkết tủa = m Fe(OH)3
FeCl3 + 3NH3+ 3H2O -> Fe(OH)3 + 3NH4Cl
0,01 0,01
=> m Fe(OH)3 = 107.0,01=1,07 gam

