Có 4 dung dịch muối riêng biệt: CuCl2, ZnCl2, FeCl3, AlCl3. Nếu thêm dung dịch KOH dư, rồi thêm tiếp dung dịch NH3 dư vào 4 dung dịch trên thì số chất kết tủa thu được là
CuCl2, ZnCl2, FeCl3, AlCl3 ![]() Cu(OH)2 , Fe(OH)3
Cu(OH)2 , Fe(OH)3 ![]() Fe(OH)3
Fe(OH)3
Do KOH dư => kết tủa Zn(OH)2 , Al(OH)3 tan hết
Zn(OH)2 + 2KOH -> K2ZnO2 + 2H2O
Al(OH)3 + KOH -> KAlO2 + 2H2O
Cu(OH)2 tạo phức với dung dịch NH3 => chất rắn chỉ còn Fe(OH)3
Cu(OH)2 + 4NH3 -> [Cu(NH3)4](OH)2
Sục khí NH3 đến dư vào dung dịch nào dưới đây để thu được kết tủa?
AlCl3 + 3NH3 + 3H2O → Al(OH)3 ↓ + 3NH4Cl
CuCl2 + 2NH3 + 2H2O → Cu(OH)2 ↓ + 2NH4Cl
Cu(OH)2 + 4NH3 -> [Cu(NH3)4](OH)2 (tan)
Cho phản ứng tổng hợp sau : 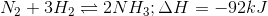
Yếu tố không giúp tăng hiệu suất phản ứng là:
Các biện pháp nhằm tăng hiệu suất phản ứng thực chất là tăng chiều thuận của phản ứng.
A. Phản ứng là phản ứng tỏa nhiệt vì có ΔH<0. Tăng nhiệt độ → phản ứng xảy ra theo chiều thu nhiệt → CB chuyển dịch theo chiều nghịch → giảm hiệu suất
B. Tăng áp suất → phản ứng xảy ra theo chiều làm giảm số mol phân tử khí → CB chuyển dịch theo chiều thuận → tăng hiệu suất
C. Lấy NH3 → phản ứng xảy ra theo chiều làm tăng lượng NH3 → CB chuyển dịch theo chiều thuận → tăng hiệu suất
D. Bổ sung khí N2 → phản ứng xảy ra theo chiều làm giảm lượng N2 → CB chuyển dịch theo chiều thuận → tăng hiệu suất
Tính bazơ của NH3 là do
- Tính bazơ của NH3 là do trên nguyên tử N còn cặp e tự do không tham gia liên kết.
- Theo thuyết bronsted , bazo là chất nhận proton
- Theo thuyết areniut, bazo là chất tan trong nước phân li ra ion OH-
H2O + NH3 ⇌ OH– + NH4+
Tính chất hóa học của NH3 là
Tính chất hóa học của NH3 là vừa có tính khử, vừa có tính bazơ
Cho quỳ tím vào dung dịch NH3 1M, quỳ tím chuyển sang màu gì ?
Vì dung dịch NH3 có tính bazơ => làm quỳ chuyển xanh
NH3 thể hiện tính bazơ trong phản ứng
NH3 thể hiện tính bazơ trong phản ứng: 2NH3 + H2SO4 → (NH4)2SO4.
Khí NH3 có lẫn hơi nước. Hóa chất dùng để làm khô khí NH3 là
Hóa chất dùng để làm khô khí NH3 là chất không tác dụng được với NH3 => chất đó là CaO
A loại vì P2O5 khi tác dụng với nước thu được H3PO4 phản ứng được với NH3
B loại vì H2SO4 phản ứng được với NH3
Cặp muối nào tác dụng với dung dịch NH3 dư đều thu được kết tủa ?
Cặp muối khi tác dụng với dung dịch NH3 dư đều tạo kết tủa là AlCl3 và FeCl3
A sai vì Na2SO4 không tạo kết tủa với NH3
C sai vì CuSO4 tạo kết tủa, sau đó kết tủa tan khi NH3 dư
D sai vì AgNO3, Zn(NO3)2 đều tạo kết tủa, sau đó kết tủa tan khi NH3 dư
Cho phản ứng tổng hợp NH3 trong công nghiệp: N2 + 3H2 $\overset{{{t}^{0}},xt}{\leftrightarrows}$ 2NH3 ∆H = – 92 KJ
Hiệu suất của phản ứng giữa N2 và H2 tạo thành NH3 tăng nếu
Theo nguyên lí Lơ-sa-tơ-li-ê: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Theo phương trình, chiều thuận làm giảm áp suất và tăng nhiệt độ (∆H < 0) là phản ứng tỏa nhiệt
Khi tăng áp suất => cân bằng chuyển dịch theo chiều làm giảm áp suất => chiều thuận
Khi giảm nhiệt độ => cân bằng chuyển dịch theo chiều làm tăng nhiệt độ => chiều thuận
Cho dung dịch NH3 dư vào dung dịch chứa FeCl3, CuCl2, AlCl3, ZnSO4, MgCl2 thu được kết tủa Y. Thành phần của Y gồm
NH3 dư có Cu(OH)2 và Zn(OH)2 tạo phức tan
=> kết tủa thu được gồm Fe(OH)3, Al(OH)3, Mg(OH)2.
Nhận biết dung dịch AlCl3 và ZnCl2 người ta dùng hóa chất nào sau đây ?
Để nhận biết AlCl3 và ZnCl2, người ta dùng dung dịch NH3 dư
AlCl3 tạo kết tủa và không tan trong NH3 dư còn ZnCl2 tạo kết tủa sau đó tan.
Trong phòng thí nghiệm, khí NH3 được điều chế bằng cách
Trong phòng thí nghiệm, khí NH3 được điều chế bằng cách cho muối amoni tác dụng với kiềm.
Phản ứng của NH3 với Cl2 tạo ra “khói trắng” . Chất này có công thức phân tử là :
2NH3 + 3Cl2 → N2 + 6HCl
NH3 khí + HClkhí → NH4Cl (khói trắng)
Cho phương trình hoá học của phản ứng tổng hợp amoniac:
N2 (k) + 3H2 (k) $\overset{{{t}^{0}},xt}{\leftrightarrows}$ 2NH3 (k)
Khi tăng nồng độ của hiđro lên 2 lần, tốc độ phản ứng thuận
tốc độ phản ứng thuận : v = [N2].[H2]3
Khi tăng nồng độ của hiđro lên 2 lần => v’ = [N2].(2.[H2])3 = 8.[N2].[H2]3 = 8v
=> tốc độ phản ứng tăng lên 8 lần
Điều chế NH3 từ hỗn hợp gồm N2 và H2 (tỉ lệ 1 : 3). Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,6. Hiệu suất phản ứng là
N2 + 3H2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2NH3
ban đầu: 1 mol 3 mol
phản ứng: a → 3a → 2a
dư: 1 – a 3 – 3a 2a
=> nhỗn hợp sau phản ứng = 1 – a + 3 – 3a + 2a = 4 – 2a
nhỗn hợp trước phản ứng = 1 + 3 = 4 mol
Bảo toàn khối lượng: mtrước = msau => Mt.nt = Ms.ns
\(\,\, = > \,\,\frac{{{M_t}}}{{{M_s}}} = \frac{{{n_s}}}{{{n_t}}}\,\, = > \,\,\frac{{4 - 2a}}{4} = 0,6\,\, = > \,\,a = 0,8\)
$=>H = \frac{{0,8}}{1}.100\% = 80\% $
Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là :
Theo phương trình phản ứng tổng hợp NH3 ta thấy N2 và H2 phản ứng theo tỉ lệ là \(\frac{{{n_{{H_2}}}}}{{{n_{{N_2}}}}} = \frac{3}{1}\).
Theo đề bài ta thấy \(\frac{{{n_{{H_2}}}}}{{{n_{{N_2}}}}} = \frac{{{V_{{H_2}}}}}{{{V_{{N_2}}}}} = \frac{1}{1}\). Vậy H2 thiếu nên hiệu suất phản ứng tính theo H2.
Thể tích H2 phản ứng là 10.60% = 6 lít
VH2 phản ứng = 6 lít => VN2 phản ứng = 2 lít
N2 + 3H2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2NH3
ban đầu: 10 10
phản ứng: 2 → 6 → 4
dư: 8 4 4
=> Vsau = 8 + 4 + 4 = 16
Vì trước và sau phản ứng nhiệt độ không thay đổi nên : \(\frac{{{V_1}}}{{{V_2}}} = \frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}}}{{p{}_2}} \Rightarrow \frac{{20}}{{16}} = \frac{{10}}{{{p_2}}} \Rightarrow {p_2} = 8\,\,atm.\)
Hỗn hợp X gồm N2 và H2 có ${{\overline{M}}_{X}}=12,4.$ Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết rằng hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. ${{\overline{M}}_{Y}}$ có giá trị là
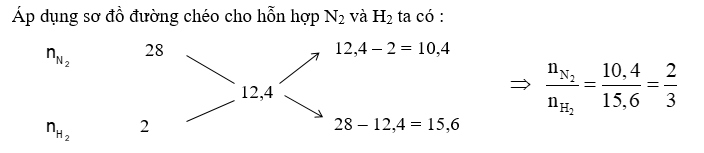
Với tỉ lệ trên suy ra H2 thiếu, hiệu suất phản ứng tính theo H2.
Trong hỗn hợp X ta chọn nN2 = 2 mol và nH2 = 3 mol
=> nH2 phản ứng = 3.40% = 1,2 mol => nN2 phản ứng = 0,4 mol, nNH3 sinh ra = 0,8 mol
nkhí giảm = (1,2 + 0,4) – 0,8 = 0,8 mol
=> \({n_Y} = {n_X} - 0,8 = 2 + 3 - 0,8 = 4,2\,\,mol\)
Theo định luật bảo toàn khối lượng ta có :
\({m_Y} = {m_X} = {m_{{N_2}}} + {m_{{H_2}}} = 2.28 + 3.2 = 62\,\,gam\)
Vậy \({\overline M _Y} = \frac{{{m_Y}}}{{{n_Y}}} = \frac{{62}}{{4,2}} = 14,76\)
Cho hỗn hợp gồm N2, H2 và NH3 có tỉ khối so với hiđro là 8. Dẫn hỗn hợp đi qua H2SO4 đặc, dư thì thể tích khí còn lại một nửa. Thành phần phần trăm (%) theo thể tích của mỗi khí trong hỗn hợp lần lượt là :
Khi cho hỗn hợp gồm N2, H2 và NH3 đi qua dung dịch H2SO4 đặc, dư thì toàn bộ NH3 bị hấp thụ.
Theo giả thiết thì sau khi đi qua dung dịch H2SO4 đặc thì thể tích khí còn lại một nửa
=> Coi V(NH3 )=1 thì V(N2) +V(H2)=1 (1)
$\frac{{1*17 + {V_{{N_2}}}*28 + {V_{{H_2}}}*2}}{2}*100\% = 8*2$ (2)
Giải (1) và (2) ta có V (N2)=0,5, V(NH3)=0,5
%N2 = %VH2= $\frac{{0,5}}{2}*100\% = 25\% $
%NH3 =50%
Sau quá trình tổng hợp NH3 từ H2 và N2 $({{n}_{{{H}_{2}}}}:{{n}_{{{N}_{2}}}}=3:1)$, áp suất trong bình giảm đi 10% so với áp suất lúc đầu. Biết nhiệt độ của phản ứng giữ không đổi trước và sau phản ứng. Phần trăm theo thể tích của N2, H2, NH3 trong hỗn hợp khí thu được sau phản ứng lần lượt là :
Theo giả thiết \({n_{{H_2}}}:{n_{{N_2}}} = 3:1\) nên ta giả sử lúc đầu có 1 mol N2 và 3 mol H2.
Trong một bình kín có nhiệt độ không đổi thì áp suất tỉ lệ thuận với số mol hỗn hợp khí :
$\frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}}}{{{p_2}}} = \frac{{{p_1}}}{{90\% {p_1}}}$ \( \Rightarrow \) nhỗn hợp khí sau phản ứng = \({n_2}\)= $4.\frac{{90}}{{100}} = 3,6\,\,mol$
Cách 1 : Tính số mol của các chất sau phản ứng dựa vào phản ứng
Phương trình phản ứng hoá học:
N2 + 3H2 $ \rightleftarrows $ 2NH3 (1)
bđ: 1 3 0 : mol
pư: x 3x 2x : mol
dư: 1–x 3–3x 2x : mol
Theo (1) ta thấy : nhỗn hợp khí sau phản ứng = (1 – x) + (3 – 3x) + 2x = 4 – 2x = 3,6 \( \Rightarrow \) x = 0,2
Vậy phần trăm về thể tích của các khí là :
$\% {V_{{N_2}}} = \frac{{1 - 0,2}}{{3,6}}.100\% = 22,22\% ;\,\,\% {V_H}_{_2} = \frac{{3 - 3.0,2}}{{3,6}}.100\% = 66,67\% ;\,\,\,\% {V_{N{H_3}}} = 11,11\% .$
Cách 2 : Dựa vào sự tăng giảm thể tích khí
Gọi số mol N2 và H2 phản ứng là x và 3x mol. Sau phản ứng số mol khí giảm bằng một nửa lượng phản ứng tức là giảm 2x mol.
Ta có : ${n_{({N_2},\,\,{H_2})\,\,ban\,\,đầu}} - {n_{khí\,\,gỉam}} = {n_{({N_2},\,\,{H_2},\,\,N{H_3})\,\,sau\,\,phản\,\,ứng}} \Rightarrow 4 - 2x = 3,6 \Rightarrow x = 0,2\,\,mol.$

